小动物超声在小鼠胸主动脉瘤/夹层模型中的诊断作用
2020-01-02王晓武段维勋俞世强
夏 麟,王晓武,段维勋,俞世强
(空军军医大学西京医院心血管外科,西安 710032)
近年来,胸主动脉瘤(thoracic aortic aneurysm,TAA)以及TAA 进展形成主动脉夹层(thoracic aortic dissection, TAD)的发病率显著升高,已成为危害国人健康的重要医疗与社会问题[1]。 胸主动脉瘤/夹层(thoracic aortic aneurysm/dissection, TAAD)是遗传(Marfan 综合征、Loeys-Dietz 综合征、Ehlers-Danlos综合征、Turner 综合征等)、高血压、动脉粥样硬化、吸烟等多种因素诱发主动脉壁组织稳态失衡,管壁结构完整性被破坏,在血压应力作用下导致主动脉壁组织变薄,逐步瘤样扩张性疾病,甚至各层之间出现裂隙,进展为夹层破裂,从而引起短时间内大出血,因此,如果不能及时诊断、治疗TAAD,将会危及患者生命[1-3]。
目前,有许多基础研究开始关注TAAD 的发病因素、遗传特点以及诊断和治疗,而安全、简单、无创的TAAD 动物模型的诊断方法在实验研究中具有非常重要的监测及评估作用。 临床上TAAD 的检测方式主要包括CT 血管造影(CT angiography,CTA)和心血管超声,CTA 作为TAAD 筛查的“金标准”已成为入院诊疗主动脉瘤的主流方式,但出于安全、经济等方面考量,CTA 并未广泛应用于基础实验。 超声检查则在小动物血管研究中凸显出方便易行等诸多优势,然而心血管超声是否能够替代CTA 成为主动脉稳态基础研究的标准检测方式尚无定论。
目前,文献报道有四大类较为成熟的小动物主动脉瘤造模方法:基因突变模型(FBN1、TGFβR、SMAD3、ACTA2)[3-4]、外科手术模型(猪胰蛋白酶腔内灌注[5-6],CaCl2浸润血管外壁[7-8])、AngII 皮下泵注模型[9-10]以及β-氨基丙腈(BAPN)饮水诱导模型[11-12]。 前三类建模方法多数针对于腹主动脉瘤(abdominal aortic aneurysm, AAA),目前BAPN 饮水诱导是建立TAAD 动物模型的有效方法之一。基于该建模方法的基础研究发展迅速[13-14],文献报道和笔者经验显示BAPN 诱导TAAD 成模率稳定在75%以上[15]。 然而建模过程中TAAD诊断手段的安全性和有效性尚未进行评估。 因此,本研究拟利用BAPN 饮水诱导C57BL/6 小鼠的TAAD 模型,通过小动物超声动态观察小鼠瘤体的发展变化并与Micro-CT 结果进行比较,为评价小动物超声检测在TAAD 动物模型中的诊断价值提供实验依据。
1 材料和方法
1.1 实验动物
24 只SPF 级C57BL/6 雄性小鼠(8 ~10 g, 3 周龄)购于空军军医大学实验动物中心[SCXK(军)2017-0043]并在实验动物中心SPF 区域[SYXK(陕)2019-001]继续饲养至7 周龄。 所有动物实验均符合美国国立卫生院(National Institutes of Health,NIH)出版的《实验动物保护和使用指南》【NIH 出版物,No. 8523,1996 修订】,研究方法符合3R(减少,替代,优化)原则并通过空军军医大学实验动物中心福利与伦理委员会审查(20180306)。
1.2 主要试剂与仪器
β-氨基丙腈(批号:A3134,Sigma-Aldrich 公司);异氟烷(批号:H19980141,河北一品制药股份有限公司);碘帕醇造影剂(批号:H20053388,上海博莱科信谊药业有限责任公司);Vevo 2100 小动物超声仪(加拿大VisualSonics 公司);Siemens Inveon小动物CT 机(德国Siemens 公司)。
1.3 实验方法
1.3.1 制备动物模型方法
24 只3 周龄雄性C57BL/6 小鼠,体重(9.15±1.57) g,随机平均分为模型组和对照组。 模型组小鼠给予正常饮食和溶有BAPN 的饮用水(1 g/(kg·d))喂水4 周;对照组给予正常饮食和和正常饮水。动态监测小鼠体重,并于造模结束时(第4 周)用Vevo 2100 小动物超声仪检测小鼠胸主动脉及左侧颈总动脉。 实验过程中所有死亡小鼠立即解剖,判断是否因TAAD 破裂死亡,破裂死亡小鼠胸腔可见血凝块。
1.3.2 Vevo 2100 小动物超声仪检测小鼠胸主动脉瘤
使用Vevo 2100 小动物超声仪进行胸主动脉瘤探测。 C57BL/6 小鼠经异氟烷麻醉后胸腹部脱毛,在鼠板上的心电图金属电极上涂导电膏,将鼠仰卧位放置于鼠板中央,将鼠的口鼻置于连接麻醉仪的管道中,用胶布将鼠的四肢固定于四个金属电极片上。 于小鼠的胸部涂上37℃预热的耦合剂,将鼠板向操作者右侧倾斜约30°,C57BL/6 小鼠选用MS400 探头,将探头与鼠身体长轴平行,并向操作者右侧倾斜约30°,选择Ao Arch 检测模式,前后左右微调探头,直到获得清晰的右心室图像,将图像向鼠头侧缓慢移动,可见主动脉弓图像,以同时看见无名动脉、左侧颈总动脉及左侧锁骨下动脉为标志。
1.3.3 Micro-CT 检测小鼠主动脉夹层动脉瘤
C57BL/6 小鼠异氟烷麻醉后作胸部正中切口分离皮肤及皮下筋膜,于肋骨剑突穿透横膈膜进入胸腔,利用止血钳牵拉胸腺及胸骨以暴露心脏及大血管。 选用27-gauge IV 型导管针于实验鼠左心室预灌肝素化PBS(5 U/mL)10 mL,同时切开右心室或下腔静脉以排出血液。 驱血完成后立刻灌注碘帕醇造影剂,当观察到冠状动脉、肺动脉、肠及肝脉管系统充盈造影剂后停止灌注,使用Siemens Inveon小动物CT 机进行主动脉扫描,并在多模态3 维可视化插件辅助下进行血管重建。
1.3.4 小动物超声仪检测小鼠左侧颈总动脉
采用传播时间(TT)法估计脉搏波速(PWV)。其原理是超声记录两个确定距离测量点之间脉搏波传播时间进而计算PWV,计算公式如下:PWV=近、远端测量点距离(D)/TT。 TT 计算方式如下:TT=远端时间延迟-近端时间延迟(远、近端时间延迟定义为远、近端测量点速率上升拐点与心电图R 波波峰之间时间差)。 利用脉冲多普勒超声可记录在近端和远端两个测量点实验鼠心电图,注意测量窗选取应尽量在实验鼠具有稳定心率和呼吸时间段内进行。 因为超声易于获取左侧颈总动脉(LCCA)矢状位切面且LCCA 可提供主动脉弓与颈动脉分叉之间超过10 mm 的无分支血管通路,故选取实验鼠LCCA 作为测量靶点。 D 测量则在B 超模式下进行,近端测量点选取在主动脉弓向LCCA 下游约1 mm 处,远端测量点选取在LCCA 分叉处上游约1.5 mm 处。
TT 法测量使用VisualSonics Vevo 2100 小动物超声仪。 B 超数据在频率40 MHz,帧率30 fps 下获取。 多普勒数据在频率30 MHz,脉冲回复频率50 kHz 下获取。 ECG 信号使用心率探测系统记录并在1 kHz 低通滤波器平滑处理后以8 kHz 频率导入Vevo 2100 系统。 结果使用VisualSonics 分析软件进行分析。
1.4 统计学分析
采用GraphPadPrism 5.1 软件进行统计学分析。实验数据以平均数±标准差(±s)表示,两组之间数据统计学差异分析采用Student t 检验方法,概率统计采用双侧检验,以P<0.05 为差异有显著性。
2 结果
2.1 两组小鼠体重变化
两组小鼠造模第0 周体重无明显差异(P =0.575);与对照组相比,造模第2 周模型组小鼠体重明显降低(P<0.01),造模第4 周,模型组小鼠体重仍然显著低于对照组(P<0.01)(表1)。
2.2 小动物超声仪检测小鼠TAAD
B 超和多普勒彩超影像显示,对照组小鼠胸主动脉管径大小均匀一致,胸主动脉最大内径为(1.056±0.141) mm;β-氨基丙腈模型组小鼠胸主动脉在主动脉弓处出现膨出瘤样变化,胸主动脉最大内径到(2.118±0.338) mm,显著高于对照组(图1,表2)。
2.3 小动物超声仪检测小鼠左侧颈总动脉
B 超和多普勒彩超影像数据显示,对照组小鼠脉搏波速为(1.92±0.14) m/s,β-氨基丙腈模型组小鼠脉搏波速明显增大到(3.91±0.35) m/s,显著高于对照组(图2,表2)。
2.4 Micro-CT 检测小鼠胸主动脉瘤/夹层
Micro-CT 三维重建影像显示,对照组小鼠胸主动脉管径大小均匀一致,形态光滑连续;β-氨基丙腈模型组小鼠胸主动脉出现局部膨大,明显动脉瘤体形成(图3)。
表1 C57BL/6 小鼠体重变化Table 1 Changes of body weight of the C57BL/6 mice(±s, n=12)
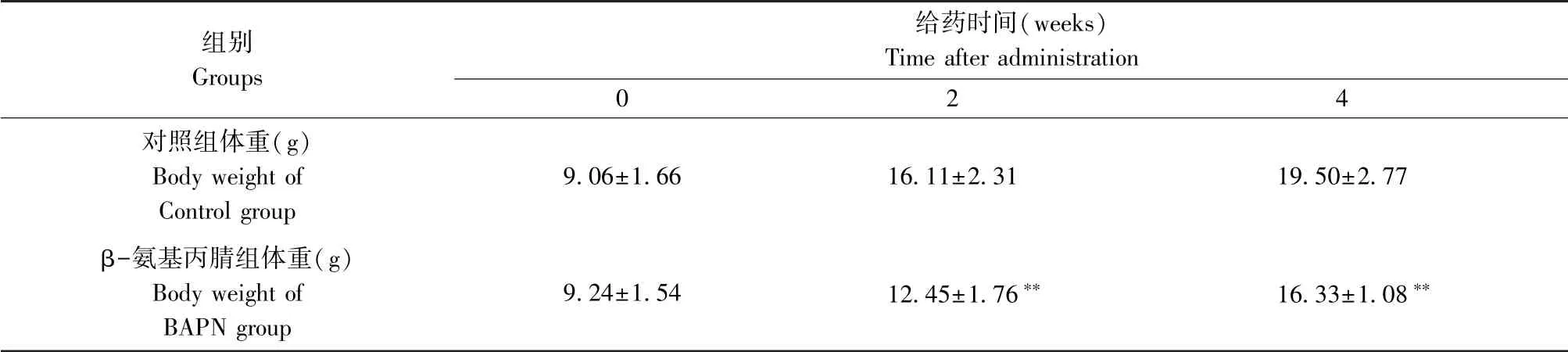
表1 C57BL/6 小鼠体重变化Table 1 Changes of body weight of the C57BL/6 mice(±s, n=12)
注:与对照组比较,∗∗P<0.01。Note. Compared with the control group, ∗∗P<0.01.
组别Groups给药时间(weeks)Time after administration 0 2 4对照组体重(g)Body weight of Control group 9.06±1.66 16.11±2.31 19.50±2.77 β-氨基丙腈组体重(g)Body weight of BAPN group 9.24±1.54 12.45±1.76∗∗ 16.33±1.08∗∗

图1 两组小鼠主动脉弓超声影像图比较Figure 1 Comparison of the ultrasound images of the mouse aortic arch in each group
表2 C57BL/6 小鼠胸主动脉最大内径及脉搏波速比较Table 2 Comparison of the maximum aortic internal diameter and PWV in the C57BL/6 mice(±s, n=12)

表2 C57BL/6 小鼠胸主动脉最大内径及脉搏波速比较Table 2 Comparison of the maximum aortic internal diameter and PWV in the C57BL/6 mice(±s, n=12)
注:与对照组比较,∗∗P<0.01。Note. Compared with the control group, ∗∗P<0.01.
组别Groups胸主动脉最大内径(mm)Maximum aortic internal diameter脉搏波速(m/s)PWV对照组Control group 1.056±0.141 1.92±0.14 β-氨基丙腈组BAPN group 2.118±0.338∗∗ 3.91±0.35∗∗
3 讨论
胸主动脉瘤/夹层是临床最常见的一种血管病变,非常凶险,发病急,死亡率高,被称为“夺命三明治”[16-18],及时准确诊断TAAD 非常重要。 目前,临床主要通过CTA 检查和心血管超声检测诊断TAAD,鉴别TAAD 的类型。 其中,CTA 技术是明确诊断TAAD 最重要的方法,在诊断TAAD 时的特异性和敏感性均可达到100%。 超声心动图检测是诊断急性主动脉夹层最简单、有效的方法,但存在一定的假阴性和假阳性率,其敏感度是60%~80%,特异性是80%~96%[19]。
我们实验室利用小动物超声仪和Micro-CT 检测小鼠TAAD,观察小鼠胸主动血管内径的变化和脉搏波速变化。 通过对两种检测方法的比较,我们认为利用小动物超声仪检测小鼠TAAD 具有一定的优势。
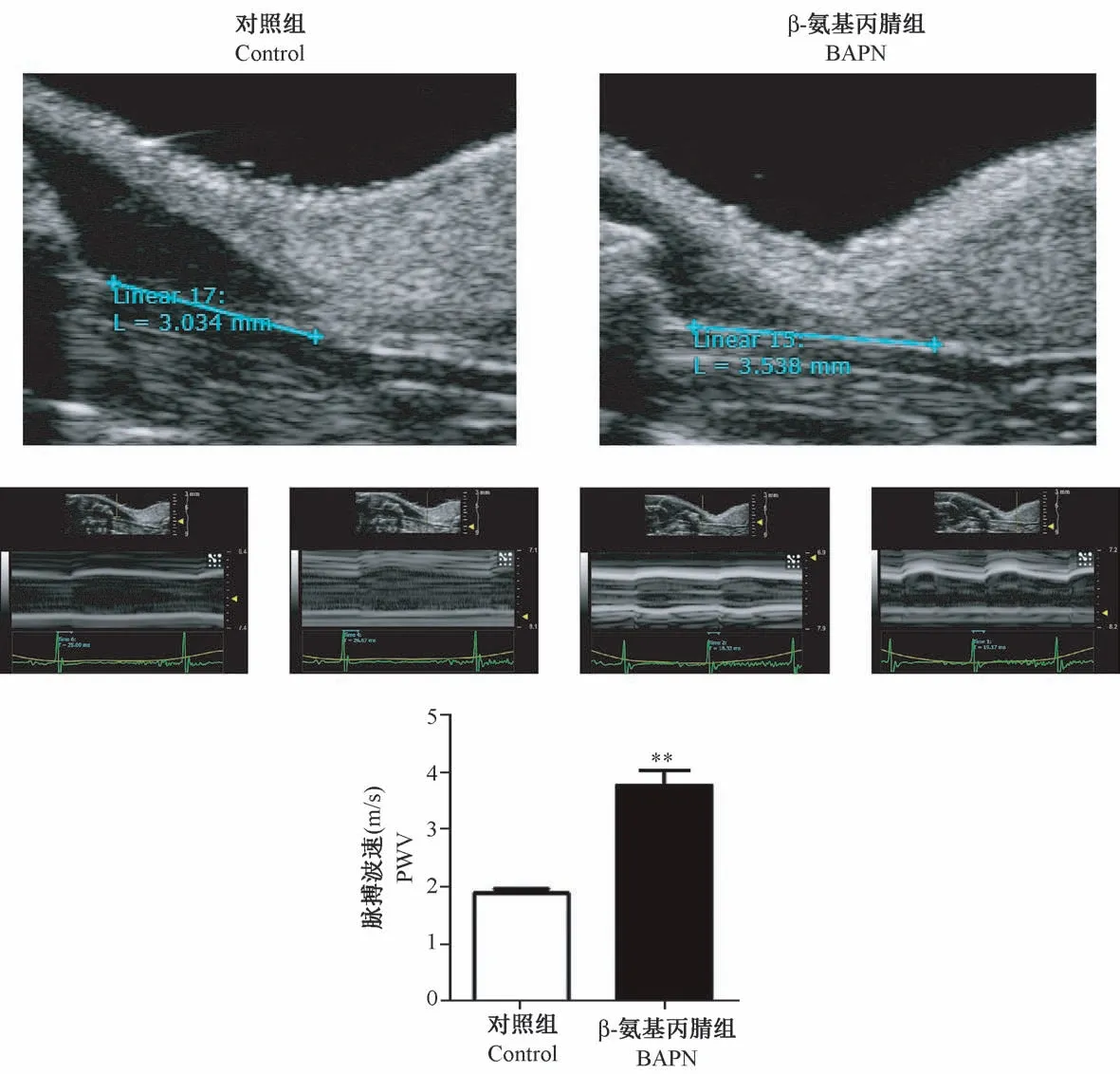
图2 两组小鼠左侧颈总动脉超声影像图比较Figure 2 Comparison of the ultrasound images of the mouse left common carotid artery in each group
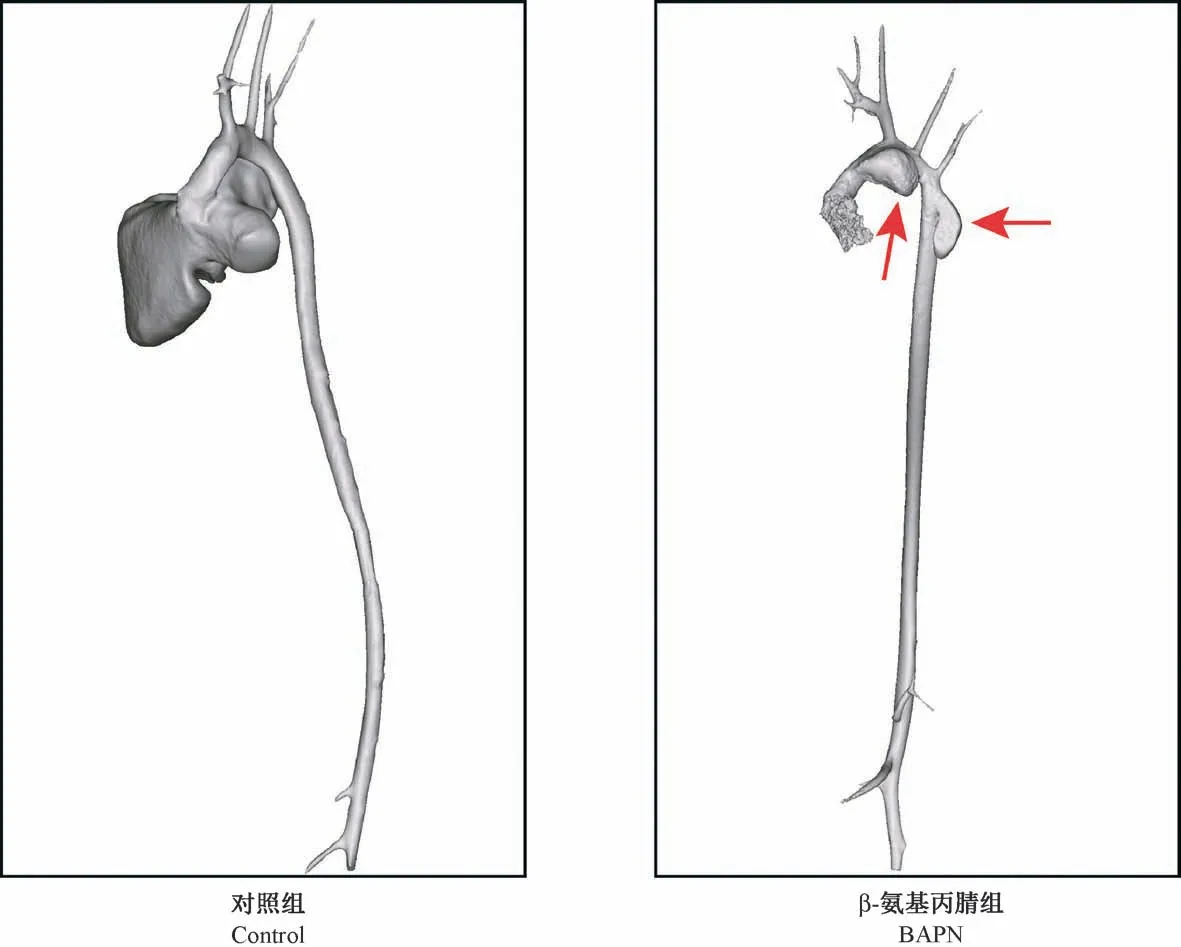
图3 两组小鼠胸主动脉Micro-CT 三维重建图比较Figure 3 Comparison of the three-dimensional reconstruction images of the mouse thoracic aortas in each group by Micro-CT
首先,小动物超声具有对动物无创伤、操作简单、检测需要时间短、成本低等优势。 通过小动物超声仪检测动态观察小鼠胸主动脉,不仅可以及时剔除造模不理想的动物,减少实验的盲目性;而且可以通过组间对照、自身对照动态评价药物等处理因素对瘤体大小的作用,实现实验的针对性;同时可以及时发现因瘤体过大而处于高危状态的动物,在瘤体破裂之前提前处理,避免实验的不可控性;另外,基于小动物超声仪的使用普及增加,利用小动物超声仪检测主动脉瘤更加易于实现[15,20-21]。Micro-CT 也能检测TAAD,与小动物超声仪相比较,CT 检测在TAAD 动物模型中的诊断中有以下不足:1)CT 检测小鼠TAAD 需要注射造影剂,成本高,检测时间长,且预灌造影剂通常需要处死动物;2)CT检测无法实现动态观察颈总动脉血管状态和血流速度;3)CT 检测不可避免存在射线污染;4)目前小动物CT 机普及范围远不及小动物超声仪[22]。
其次,小动物超声仪能够检测颈总动脉并计算PWV[23],作为一种常用的主动脉功能学评价指标,小动物超声仪能提供小鼠TAAD 造模过程中更为全面的质量控制。
因此,小动物超声检测是一种简单、快速、安全评价小鼠TAAD 模型的建立、动态变化的诊断方法,直观、无创、用时短、成本低、准确性高,值得在胸主动脉瘤/夹层等动物实验研究中推广应用。
