人柯萨奇B2 病毒感染恒河猴模型的初步研究
2020-01-02段素琴杨亚平杨凤梅李艳艳马绍辉和占龙
段素琴,杨亚平,杨凤梅,李艳艳,刘 权,赵 远,马绍辉,和占龙
(中国医学科学院/北京协和医学院 医学生物学研究所, 云南省重大传染病疫苗研发重点实验室,昆明 650118)
近年来,手足口病(hand foot and mouth disease,HFMD)在亚太地区呈持续高发态势,中国大陆每年发病数超百万人,死亡近千人,已成为重要的公共卫 生 问 题[1]。 HFMD 主 要 是 由 肠 病 毒 71(Enterovirus 71,EV-71)、柯萨奇病毒A16(Coxsackie virus A16,CA16)和柯萨奇病毒A6(Coxsackie virus A6,CA6)引起的,但自2008 年以来,其他的柯萨奇病毒例如CV-B2、CV-B1 和CV-B4 等在手足口病人也经常被检测并报道[2-3]。
人类柯萨奇B2 病毒(Coxsackie virus B2,CVB2),是一类无包膜,单股正链RNA 病毒,隶属人类肠道病毒B 组。 该病毒感染后可能会发生HFMD、心肌炎、克山病和无菌的脑膜炎等疾病,特别是小于1 岁的婴幼儿由于免疫功能相对不足,感染后病症较为严重[4-6]。 据报道,我国早在1995 年山东就爆发了CV-B2 导致的病毒性脑膜炎的流行,在各省都有流行的相关的报道,并且台湾省于1999、2002、2003 和2006 年CV-B2 的感染率均异常增高[7-8]。
据报道CV-B2 可以引发致命的心肌炎,但到目前为止针对CV-B2 病毒疫苗和药物的研究和相关的动物模型未见详细报道,尤其是非人灵长类动物模型[9]。 本研究旨在选择与人最为接近的非人灵长类恒河猴婴猴作为实验模型进行人类柯萨奇B2病毒婴猴感染模型的初步研究,为进一步研究该病毒引起HFMD 的发病机制、病理生理、药物和疫苗的研发及评价等方面提供实验基础。
1 材料和方法
1.1 实验动物
选取普通级标准、背景清晰、3 ~4 月龄,雄性5只恒河猴婴猴,编号分别为18001、18003、18005、18007、18009,实验前对所有动物进行CV-B2 病毒中和抗体检测均为阴性,体重0.6 ~0.7 kg(误差不大于10%),来源于中国医学科学院医学生物学研究所灵长类中心[SCXK(滇)K2015-0004];动物饲养于医学生物学研究所实验动物部[SYXK(滇)K2015-0006],光照12 h/d,温度26℃~29℃,湿度40%~60%。 实验前动物单笼隔离饲养适应两周,每天饲喂4 餐,牛奶和蒸糕为主,辅助适量水果,自由饮水。 本实验经中国医学科学院医学生物学研究所动物福利伦理委员会审查批准(批号:DWSP201810002),动物实验房符合相关标准,实验期间按实验动物使用的3R 原则给予人道主义关怀。
1.2 主要试剂与仪器
CV-B2(RW41-2/YN/CHN/2012)保存于中国医学科学院医学生物学研究所遗传室。
Takara PrimeScriptTMOne Step RT-PCR Kit Ver.2(日本);Tiangen 2 × Taq PCR Mastermix(中国);琼脂糖(西班牙);Vivacell EcoDye DNA 染料核酸染料(美国)。
Sysmex XT-2000i 血细胞仪(日本希森美康);Mindray BS-2000 自动生化分析仪(中国迈瑞);Motic 显微镜及成像系统(中国);BioTeK 酶标仪(美国伯乐);Thermo 低温高速离心机(美国); Bio-Rad PCR system(美国);立式高压灭菌锅(SX-500,日本Tomy 公司);制冰机(IMS-200,常熟雪科);海尔冰箱(BCD- 215KMLM);医用低温保存箱(DW -25L262,海尔);移液枪(Eppendorf,德国);枪头(Axygen,美国);1.5 mL 离心管(Axygen,美国);福尔马林(茂业试剂,中国);止血干棉花(中国);手术器械(中国);肛式体温计(中国)。
1.3 实验方法
1.3.1 动物感染及样本采集
(1)结合人的肠道病毒的主要感染途径,参考Chen 等[10]的EV71 建模方式,按照每只动物经口腔感染滴定毒株106TCID50/mL 的CV-B2。
(2)样本采集:于感染后第0、1、2、3、4、5、7、11、14 天采集后肢静脉血,抗凝血1 mL、非抗凝血2 mL。 采集感染后第3 天的疱疹组织浸泡于10%福尔马林进行固定,并用无菌棉签蘸取疱疹液保存于-80℃冰箱中。
1.3.2 临床观察和记录
(1)第0 ~14 天,每天观察3 次动物临床症状,包括饮食量、活动度、精神状态、疱疹、排便情况等,并进行标准评分记录:正常-0;精神萎靡-1;弓背沉郁-2;活动减少-3;消瘦-4;四肢麻痹-5;濒死或死亡-6;饮食量减少-7;疱疹-8。
(2)第0~14 天,每天早晨9:00 测量肛拭体温。
1.3.3 指标检测
(一)血细胞检测和生化检测
取抗凝血150 μL,按照操作说明测定血细胞。非抗凝血标本在4℃静置半小时,待血清自然析出(无溶血现象),4℃,4000 r/min,离心10 min,轻轻吸出血清至1.5 mL 离心管中,及时对样品进行生化指标(肝功、肾功、心肌酶)的检测。
(二)血液和疱疹PCR 的鉴定
1.针对CV-B2(RW41-2/YN/CHN/2012)选择保守序列作为靶基因,通过Primer Premier 5.0 软件设计两组巢式PCR 的引物(见表1),引物昆明硕勤技术服务有限公司合成。
2.用TRIzol 法提取感染后的疱疹液和血液的RNA,以提取的RNA 作为模板,通过巢式PCR 对血液和疱疹液中的病毒情况进行检测。 首先,用TaKaRa 公司的PrimeScriptTMOne Step RT-PCR Kit Ver.2 试剂盒进行RT-PCR,反应体系为:PrimeScript 1 Step Enzyme Mix 1 μL,2 × 1 Step Buffer 10 μL,RNA 模板2 μL,F1 1 μL,R1 1 μL,ddH2O 5 μL。 反应条件为:50℃逆转录30 min,94℃预变性3 min,94℃变性30 s,52℃退火30 s,72℃延伸1 min,34个循环后再72℃延伸7 min。 其次,进行二次PCR,反应体系为:2×Taq PCR Mastermix 12.5 μL,F2 1 μL,R2 1 μL,RT-PCR 产物2 μL,ddH2O 8.5 μL。反应条件为:94℃预变性3 min,94℃ 变性30 s,62℃退火30 s,72℃延伸40 s,34 个循环后再72℃延伸5 min。 最后,取5 μL 扩增产物进行1.5%琼脂糖凝胶电泳,根据DNA marker (DL 2000,TaKaRa)、阳性对照、阴性对照判定结果,用凝胶成像系统观察条带大小并拍照。 PCR 阳性扩增片段送昆明硕勤测序公司进行测序,通过与Genbank 中CV-B2 序列(RW41-2/YN/CHN/2012)进行比对以确定PCR检测结果的准确性。
(三)组织病理将固定好的疱疹组织及时送昆明金裕医学检验中心进行制片, HE 染色(hematoxylin-eosin staining),病理结果利用全自动病理图文系统进行扫描观察。
1.4 统计学分析
利用SPSS 统计学软件,对数据计算均值,以平均值±标准差(±s)进行相关数据分析。
本实验设计考虑实验猴的伦理及研究成本等因素,设计为实验前后对照方案,动物的体温、血细胞、生化检测指标均采取实验前、实验后数据。
2 结果
经口腔方式(消化道)感染恒河猴婴猴后出现体温升高,手、足、口、生殖器等部位出现疱疹,血象、心肌酶、肝功能和肾功能的改变,结合RT-PCR和病理结果可以确定恒河猴婴猴感染CV-B2 后出现了典型的手足口病的症状。
2.1 临床观察记录
恒河猴婴猴感染CV-B2 后,每天对其进行临床症状观察,体温呈现不规则热型,低热(38℃~39℃之间),感染第2、7、14 天略有上升(见图1);在感染初期并没有发生明显的起伏变化,排便均正常。 在感染第2 天起5 只实验猴均出现活动减少、精神低迷、饮食量减少等现象,未出现四肢麻痹和死亡;在感染第2 天开始,每只猴子均在不同时间点、不同部位出现手、足、口部疱疹,所有猴子咽部均出现约2~3 mm 大小的灰白色疱疹,周围有红晕,伴有充血情况,疱疹症状在3~5 d 不等全部消退(见图2 和表2)。
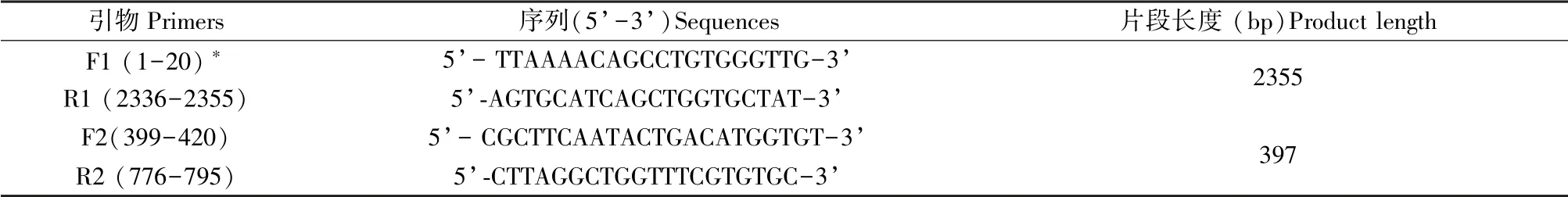
表1 CV-B2 的特异性引物Table 1 Specific primers for CV-B2
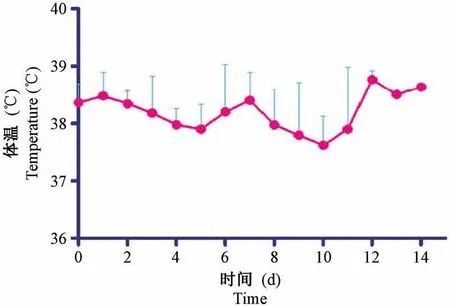
图1 恒河猴感染CV-B2 体温变化情况Figure 1 Changes in body temperature of the rhesus monkeys infected with CV-B2
2.2 血细胞和生化变化情况
2.2.1 血细胞指标
感染CV-B2 后恒河猴婴猴白细胞数从第1 天开始呈现出下降的趋势,第3 天回升,之后趋于平稳(见图3A);单核细胞在第1 天升高,然后下降,第4天开始上升恢复到正常水平(见图3B);淋巴细胞数在感染后第1 天急剧下降,一直持续到第4 天达到最低点,第5 天开始上升恢复到正常水平(见图3C);嗜酸性粒细胞总体趋于上升趋势,在第1 天和第11 天出现急剧升高现象(见图3D);嗜碱性粒细胞感染后第1 天出现急剧的下降,持续至11 d 逐步回升(见图3E);中性粒细胞则总体处于上升趋势(见图3F)。
2.2.2 生化指标
对恒河猴婴猴的血清进行生化检测,发现心肌酶、肝功、肾功都发生了相应的改变,心肌酶乳酸脱氢酶(LDH)、肌酸激酶(CK)、肌酸激酶同工酶(CKMB)呈现上升趋势,在第3 天、第5 天和第7 天出现明显的升高(见图4A、4B、4C)。 丙氨酸氨基转移酶(ALT)、白球比(A/G)、球蛋白(GLB)、总蛋白(TP)和天门冬氨酸氨基转移酶(AST)发生不同程度的增高(见图4D、4E、4F、4G、4H),在第7 天均出现最高峰值。 血清尿素(UREA)在第5 天最高,随后逐渐下降(见图4I);血清肌酐(CREA)在感染后第1 天起急剧增高,一直持续到第14 天仍然处于较高水平(见图4J)。
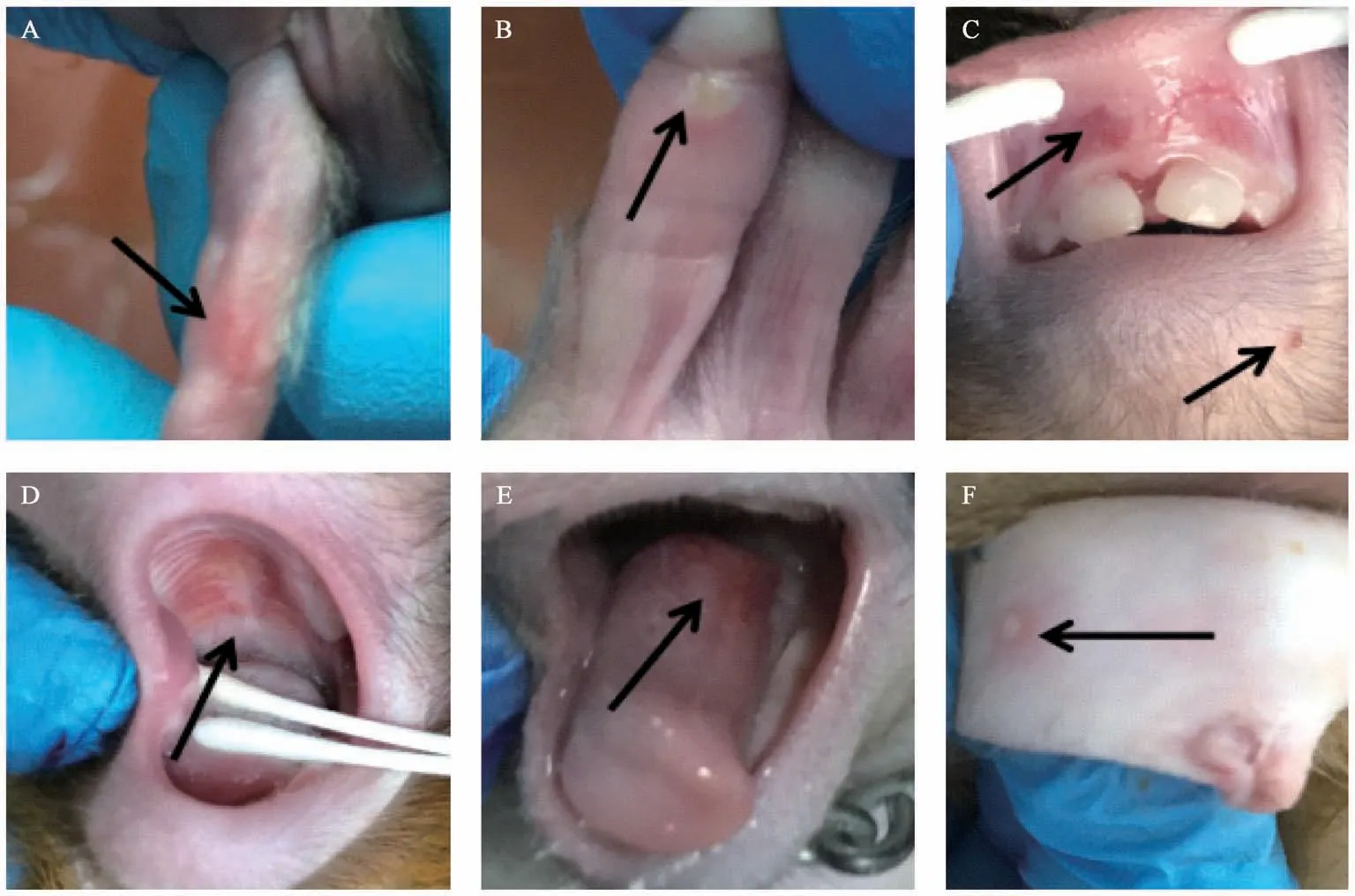
图2 恒河猴婴猴感染CV-B2 的疱疹情况Figure 2 Herpes infection in the rhesus monkeys infected with CV-B2
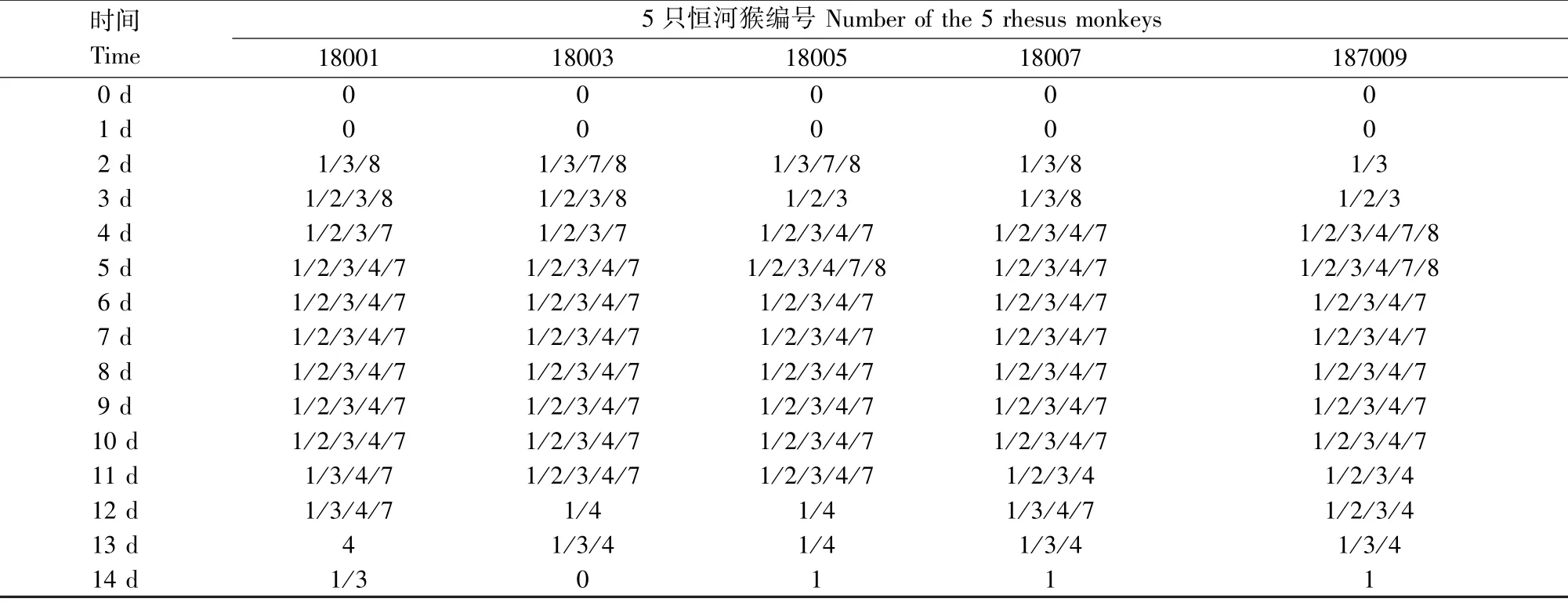
表2 恒河猴婴猴感染CV-B2 的临床症状Table 2 Clinical symptoms of the infant rhesus monkeys infected with CV-B2

图3 恒河猴婴猴感染CV-B2 后的血细胞的变化情况Figure 3 Changes in blood cells of the infant rhesus monkeys infected with CV-B2
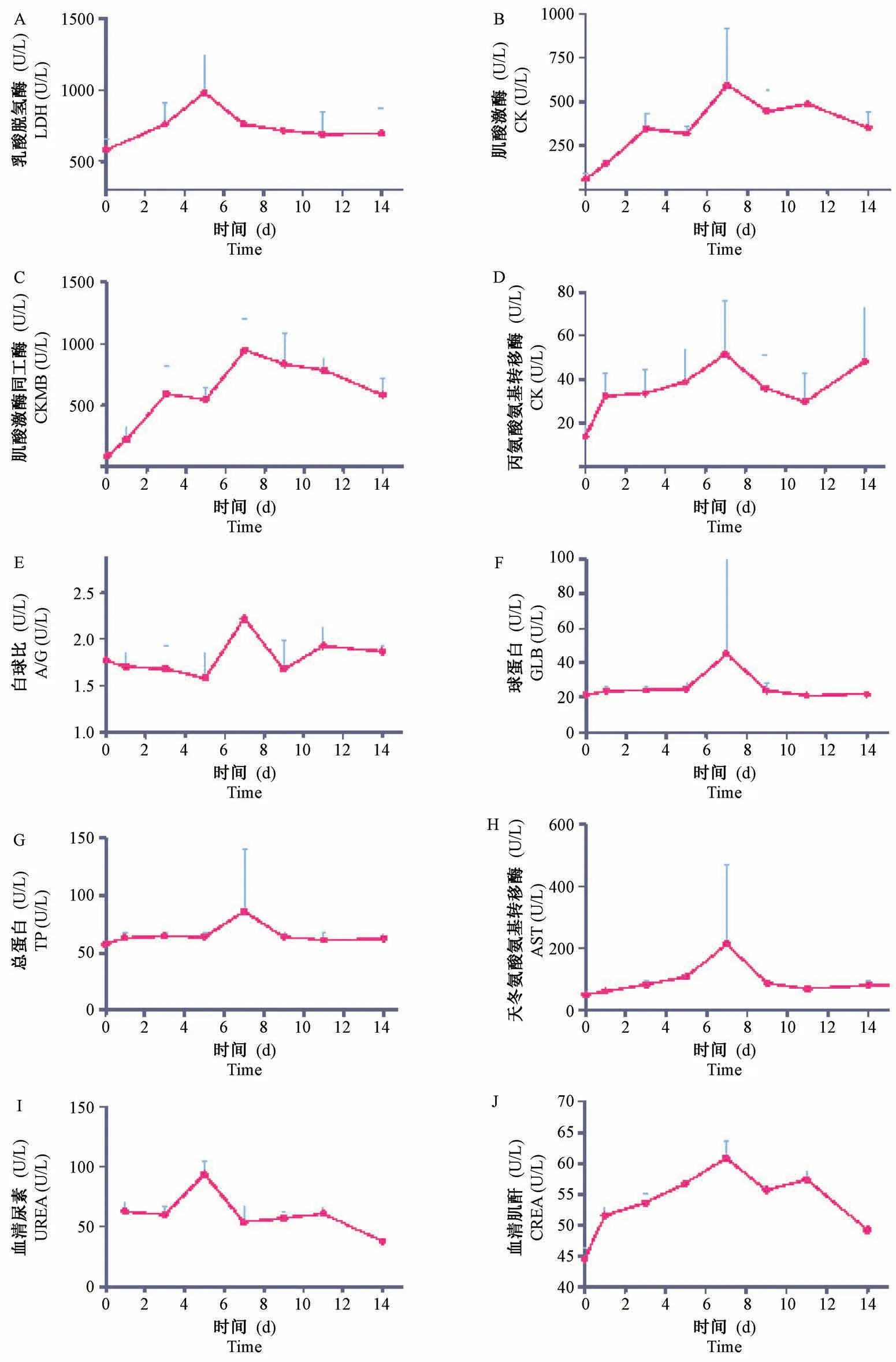
图4 恒河猴婴猴感染CV-B2 后的血清生化的变化Figure 4 Changes in serum biochemistry of the infant rhesus monkeys infected with CV-B2
2.3 血液和疱疹PCR 的检测结果
琼脂糖凝胶电泳检测RT-PCR 产物,扩增产物400 bp,扩增条带见图5。 经纯化测序,单向测序得400 bp 序列,该序列与CV-B2 病毒序列完全一致。
2.4 病理观察结果
感染后第5 天的疱疹组织通过镜检可以看到疱疹呈鳞状上皮增厚,表面角化过度,局部坏死伴炎细胞浸润,脓肿形成(见图6)。
3 讨论

图5 恒河猴婴猴感染CV-B2 后血液疱疹检测结果Figure 5 Blood herpes test results after the infant rhesus monkeys infected with CV-B2
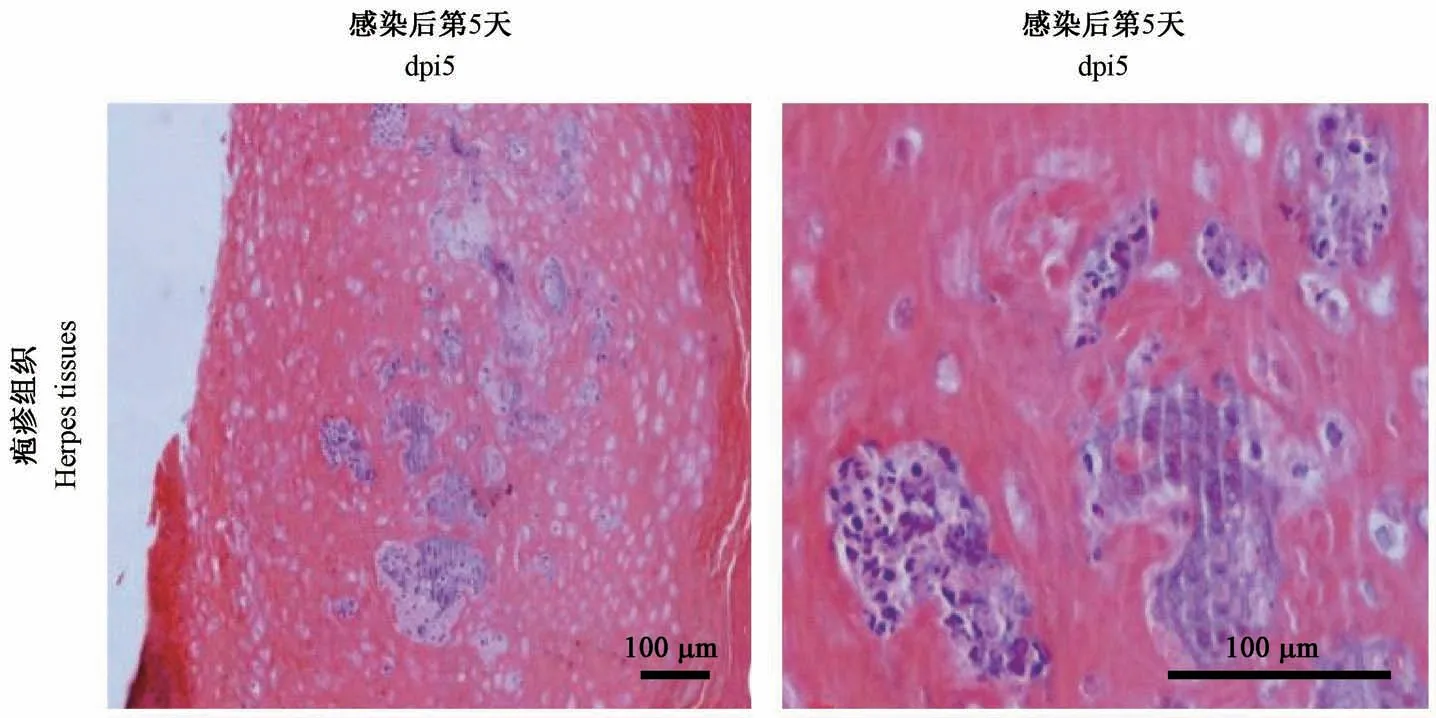
图6 恒河猴婴猴感染CV-B2 后的疱疹的病理改变(HE 染色)Figure 6 Pathological changes of herpes in the infant rhesus monkeys after CV-B2 infection(HE staining)
手足口病病毒感染动物模型主要包括小鼠、乳鼠、免疫缺陷小鼠、受体基因修饰小鼠、树鼩和非人灵长类动物等[11],主要研究集中在EV-A71,CVA16,CV-A6 和CVA10 病原体,引起神经损伤、后肢麻痹以及呼吸道受累等症状[12-16]。 但是柯萨奇B病毒主要引起心脏、胰腺、肝、肾等组织器官的病变,不同的临床CV-B 分离株与CAR 均有明显的相互作用[17-18]。 早有报道显示,大于90%的CV-B 感染发生在婴儿、儿童和青少年中,因此,建立敏感的新生儿CV-B 感染的动物模型对于发病机制的研究至关重要[19]。 有研究者利用3~4 周龄的C3H/He J小鼠先后进行了CV-B3 和CV-B5 的感染,发现CVB3 感染可导致小鼠出现胰腺炎和心肌炎,而CV-B5感染只引起胰腺炎[20]。 Zhong 等[21]用CV-B5 感染3~4 周龄BALB/c 小鼠,发现小鼠在感染6 d 后出现了间质性肺炎和心肌炎。 Dong 等[22]发现CV-B4在小鼠模型上可以发生皮质视神经水肿以及心肌炎的症状。 最新报道的韩国Hong 等[23]利用CVB2/04/279 建立的小鼠心肌炎和胰腺炎模型,该模型小鼠感染采用人工注射的方法,这种方式与经呼吸道和消化道等自然感染过程具有一定差别,因此对该病毒感染评价方面会存在一些差异。 非人灵长类作为高等级模式动物,能够感染肠道病毒的EV71 和CA16,至今非人灵长类的CV-B2 模型尚未有报道[24]。
本实验通过CV-B2 经口腔感染方式感染恒河猴婴猴,感染后恒河猴出现WBC 降低,中性粒细胞升高,提示为病毒的感染,结合文献报道中性粒细胞升高可作为诊断重症手足口病患儿的一个参考指标,中性粒细胞的增高可能与机体特异性免疫(细胞与体液)功能较低、非特异性免疫炎症反应代偿性增强有关。 淋巴细胞的减少可能是因为CV-B2直接或者间接诱导细胞凋亡,并且凋亡对机体免疫反应产生抑制作用。 CV-B2 感染机体后,单核细胞相应的增加来吞噬病毒,紧接着将所携带的抗原决定簇转交给淋巴细胞,诱导淋巴细胞的特异性免疫性反应进而促进免疫应答的发生。 研究结果中的嗜酸性粒细胞的升高提示启动了病毒感染的炎症反应,释放了炎性颗粒中的内容物,引起组织损伤。
通过对手足口病婴幼儿患者实验室检测发现心肌酶谱的活性变化和持续时间与心肌细胞坏死程度呈正相关,手足口病病程中动态监测心肌酶的指标是有价值的[25]。 恒河猴感染CV-B2 后LDH、CK 升高表明不同程度的心肌损害,而CK-MB 是心肌特异性同工酶,在心肌细胞中含量最高,正常血清中含量极微,当心肌细胞受损时释放入血,故对判断心肌损害具有高度特异性,因此CKMB 升高提示心肌的受损[26],因此我们预测在恒河猴婴猴感染的早期就出现了心肌的损伤情况。
20 世纪初,就有相关报道指出CV-B2 与肝衰竭的相关性。 众所周知,ALT、AST 是人体内广泛分布的酶,主要存在于肝脏、心脏组织细胞中,当这些组织发生病变时,该酶活力增多,表明在感染CV-B2后肝细胞受损,细胞膜通透性增加,胞浆内的ALT、AST 释放入血,导致血清浓度可升高。 恒河猴感染第7 天GLB 升高,可能是机体对抗病毒感染持续产生球蛋白发挥免疫作用。 TP 和GLB 水平表现出相同的变化趋势,这可能是二者与CV-B2 病毒感染后机体代谢增加有关。 多项临床研究表明使用丙种球蛋白治疗手足口病可以改善症状,加快恢复[27-28]。 Lin 等[29]人的研究也表明使用高剂量的丙种球蛋白治疗重症手足口病效果很好。 而A/G在第七天同时发生增高,说明发生感染之后出现了肝脏的合成功能的异常。 同时CREA、UREA 的改变,同时使肾脏功能受到损伤并也可能发生了一定的病变。
通过RT-PCR 方法检测血液和疱疹液中病毒,同时疱疹组织出现鳞状上皮增厚,局部坏死伴炎细胞浸润,脓肿形成等病理改变,可以确定引起恒河猴婴猴出现一系列临床症状的病原体为CV-B2,并出现病毒血症的发生。
因此经口腔方式(消化道)感染恒河猴婴猴后出现体温升高,手、足、口、生殖器等部位出现疱疹,血象、心肌酶、肝功能和肾功能的改变,结合RTPCR 和病理结果可以确定恒河猴婴猴感染CV-B2后出现了典型的手足口病的症状和多器官的损伤。
基于以上研究的成果,我们认为该模型选取的动物年龄适当、感染方式、样本选取和检测方法和技术是可行的,其所有结果均反映了一个较为完整的病毒感染的过程,能够复制和再现相应模型的临床、病原、病理及实验室检测情况,该研究结果为后续利用恒河猴感染建立CV-B2 手足口病模型,开展致病机制、病理学、免疫学以及药物和疫苗的研发和评价等积累了资料、奠定了良好的基础。
