基于ARE-Nrf2 的皮肤致敏体外检测方法及其在样品检测中的应用
2020-01-02刘春凤张丽婷李小林张子龙
刘春凤,张丽婷,李小林,施 镇,张子龙,李 健,陈 田∗,邱 璐∗
(1.上海海关动植物与食品检验检疫技术中心,上海 200135; 2.上海家化联合股份有限公司启初研究中心,上海 200082; 3.上海国际旅行卫生保健中心,上海 200335)
由皮肤过敏引起的过敏性皮炎占皮肤相关疾病的15%~20%[1],因此对接触皮肤的化学品及化妆品进行过敏性测试是安全性评价的重要项目。 现在大部分皮肤致敏测试仍然依赖于动物测试,小鼠局部淋巴结检测(LLNA)作为一种替代方法,以淋巴结的T细胞增殖定量测定代替皮肤临床症状观察[2],可以减少实验动物的使用量,可取代传统动物实验:豚鼠的经典方法、几内亚猪最大化试验(GPMT)和Buehler试验(OECD TG 406),但没有实现完全替代。 随着2013 年欧盟相关法规实验动物禁令的推行[3-5],样品检测对体外方法的需求越来越多。
致敏检测体外方法的研发基于有害结局路径(Adverse Outcome Pathway,AOP)的概念,将皮肤致敏的过程分为四个关键事件,基于每一个关键事件的分子起始事件都有对应的体外测试方法被开发,有些已被列入世界经济合作和发展组织(OECD)测试指南TG442,如直接多肽反应试验(direct peptide reactivity assay,DPRA)[6]、ARE-Nrf2 荧光素酶方法[7]、人细胞系活化实验(human cell line activation test, h-CLAT)[8]等。
ARE-Nrf2(antioxidant responsive element-NF-E2-related factor 2)荧光素酶方法是针对角质形成细胞的活化的关键事件建立的体外替代方法,目前OECD 收录的有KeratinoSensTM以及LuSens。 它的原理是:Keap1-Nrf2-ARE 信号通路可以通过控制抗氧化酶或者蛋白的表达来保护细胞不受氧化应激的损伤,该信号通路可以被皮肤致敏物激活。 目前ARE-Nrf2 荧光素酶方法只用于对单一化学物进行检测。 我国的化妆品监管为成品监管,因此探索体外的方法在化妆品成品检测中的应用对我们的化妆品检测有更为重要的意义。 本研究旨在建立ARE-Nrf2 荧光素酶方法,并探索本方法对成品检测的可行性。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF 级BALB/c 小鼠,雌性,8 ~12 周龄(18 ~22 g),44 只,由上海杰思捷实验动物有限公司提供[SCXK(沪) 2018-0004]。 动物实验在上海出入境检验检疫局动植物与食品检验检疫技术中心[SYXK(沪) 2014-0020]进行,动物实验环境条件为屏障系统动物房,温度18℃~22℃,湿度40%~65%,自由饮食,12 h 人工照明。 该实验研究由上海出入境检验检疫局动植物与食品检验检疫技术中心实验动物伦理委员会批准( IACUC 号:SHCIQAFTC-M015),并遵照动物实验3R 原则在饲养和实验过程中给予了恰当的人道关怀。
1.1.2 细胞
人永生化表皮细胞HaCaT 细胞购于北纳生物。
1.2 主要试剂与仪器
DMEM 培养基、胎牛血清(FBS)(56℃加热灭活30 min)、0.25%胰酶/EDTA 溶液(Trypsin/EDTA)、青霉素/链霉素双抗、磷酸盐缓冲液(DPBS)、遗传霉素G-418、TRIzol plus RNA 纯化试剂盒及cDNA反转录试剂盒(赛默飞,美国);二甲基亚砜(DMSO)(西格玛奥德里奇,美国);荧光素酶检测试剂盒(珀金埃尔默, 美国);CCK-8 试剂(株式会社同仁化学研究所,日本);无菌离心管、细胞培养瓶及培养板(25 cm2、75 cm2培养瓶、96 孔平底细胞培养板)(康宁,美国);SRBR Green 染料(海方生物,中国)。 水杨酸(CAS:69-72-7)、乳酸(CAS:50-21-5)、甘油(CAS:56-81-5)、SDS(CAS:151-21-3)、1-丁醇(CAS:71-36-3)、异丙醇(CAS:67-63-0)、肉桂醛(CAS:104-55-2)、二甲基丙烯酸二醇酯(CAS:97-90-5)、肉桂醇(CAS:104-54-1)、2-巯基苯并噻唑(CAS:149-30-4)、4-甲氨基苯酚硫酸盐(CAS:55-55-0)、2,4-二硝基氯苯(CAS:97-00-7)、对苯醌(CAS:106-51-4)、甲醛(CAS:50-00-0)、间苯二酚(CAS:108-46-3)、苄基溴(CAS:10039-0)均购自Sigma 公司。
待测样品:某品牌抗菌洗衣液、瞬清亮彩洗衣液、瞬清无磷洗衣液、自制化妆水配方、市售某品牌化妆水、市售化妆水添加50%肉桂醇。
II 级生物安全柜(Labconco,美国);二氧化碳培养箱(Thermo,美国);荧光读板机(Perkin Elmer,美国);全波长酶标仪(BioTek,美国);细胞计数仪(Orflo,美国);离心机(Thermo,美国);细胞冻存盒(康宁,美国)(Coolcell);倒置显微镜(徕卡,德国);PCR 仪(ABI,美国);实时定量PCR 仪(ABI,美国);DNA 电泳仪(伯乐,美国)。
1.3 实验方法
1.3.1 细胞培养方法
HaCaT 细胞及稳转细胞株均在含10%胎牛血清(FBS) 的DMEM (Dulbecco’ s modified eagle medium)培养基中于5% CO2,37℃细胞培养箱内常规培养。
1.3.2 质粒构建及稳转细胞株筛选
细胞株的构建参见Emter 等人的方法[9],PGL4.17 质粒从Promega 购得,在KpnI 和HindIII酶切位点之间插入人工合成的含有人AKR1C2-ARE 和SV40 启动子的序列5’-GGTACCTGGTCGC AAGGTGTGCAAGCTGCTGAGTCACCCTGACTGCATC AACCCCAGGAGCTAGATCTGCGATCTGCATCTCAAT TAGTCAGCAACCATAGTCCCGCCCCTAACTCCGCCC ATCCCGCCCCTAACTCCGCCCAGTTCCGCCCATTCT CCGCCCCATCGCTGACTAATTTTTTTTATTTATGCAG AGGCCGAGGCCGCCTCGGCCTCTGAGCTATTCCAG AAGTAGTGAGGAGGCTTTTTTGGAGGCCTAGGCTTT TGCAAAAAGCTT-3’, 构 建 成 功 的 pGL4.17-AKR1C2-ARE-SV40 质粒含有荧光素酶基因以及neor基因,可以用于稳转细胞株的筛选。 使用Nucleofector 系统(Lonza)用程序U-020 转染HaCaT细胞。 使用含有500 μg/mL G-418 的培养基来筛选稳定的克隆,分离、扩增单克隆细胞,筛选到的稳定生长的克隆进行PCR 及荧光素酶鉴定及细胞冻存。1.3.3 聚合酶链式反应(PCR)及实时定量PCR鉴定
荧 光 素 酶 的 引 物 序 列: 正 向 引 物 5’-ACGCACATATCGAGGTGGAC-3’, 反 向 引 物 5’-TGCTTTGGAAGCCCTGGTAG-3’,β 肌动蛋白的引物序列:正向引物5’-AGCGAGCATCCCCCAAAGTT-3’,反向引物:5’-GGGCACGAAGGCTCATCATT-3’。正常生长的细胞使用TRIzol 法进行RNA 的提取,反转录得到cDNA,PCR 体系为20 μL,含有4 μL cDNA、4 μL ddH2O、1 μL 正向引物(10 μmol/L)、1 μL反向引物(10 μmol/L)和10 μL 2×Taq mix,放到PCR 中,运行以下程序95℃5 min, 95℃15 s,55℃30 s,68℃30 s,后面三步35 个循环,将所得PCR 产物进行琼脂糖凝胶电泳。 荧光定量PCR 体系为 20 μL, 含 有 4 μL cDNA、 0.4 μL ROX referencedye2、4.6 μL ddH2O、 0.5 μL 引 物(10 μmol/L)和10 μL SYBR green mix。 均匀地加到96孔板中,每个样品三个复孔,将96 孔板放到7500 Fast Real-Time PCR System (ABI)仪器中,运行以下程序95℃5 min, 95℃15 s, 60℃1 min,后面两步40 个循环。 数据通过β 肌动蛋白进行归一化。
1.3.4 受试物暴露
将测试化学物以200 mmol/L 的浓度溶解在去离子水中,不溶于水的溶于DMSO 中。 将化学物在溶剂中按2 倍稀释系数稀释8 个浓度,配成100 倍母液。 将DSens 细胞接种在96 孔板中(100 μL 不含G418 的生长培养基)。 24 h 后,进行化学物暴露,化学物用含有1% FBS 的100 μL 新鲜培养基稀释到终浓度,溶剂的最终浓度为1%。 在每个实验中,在所有8 种浓度下都有6 个复孔,每个板含有细胞和溶剂的对照孔。 孵育48 h 后,去除测试化学物,用DPBS 洗涤细胞一次,加入100 μL 细胞裂解液,1 min 后转移到检测用白板,使用荧光读板机进行读数。 对于细胞活力测定,孵育48 h 后,去除测试化学物,用DPBS 洗涤细胞一次,加入100 μL 新鲜培养基,向每个孔中加入10 μL CCK8 溶液,温育1~3 h 后,450 nm 测光吸收。
1.3.5 LLNA:BrdU-ELISA 实验方法
雌性BALB/c 小鼠随机分组,每组4 只小鼠,样品连续3 d 涂抹于小鼠双耳背,第5 天腹腔注射BrdU标记液,第6 天摘取小鼠耳部淋巴结,制备淋巴细胞悬液,采用ELISA 法测定BrdU 掺入细胞的水平。
1.3.6 结果分析
(1)诱导倍数计算
诱导倍数(I)= (L 受试物-L 空白)/(L 溶剂-L空白)
式中:
L 受试物—— 受试物荧光读数;
L 空白—— 空白(不含细胞不含受试物)荧光读数;
L 溶剂—— 溶剂对照(阴性对照)荧光读数均值。
(2)EC1.5 计算
EC1.5=(Cb-Ca)×((1.5-Ia)/(Ib-Ia))+Ca
式中:
Ca —— 诱导值大于1.5 时的受试物最低浓度,μmol/L;
Cb —— 诱导值小于1.5 时的受试物最高浓度,μmol/L;
La —— 大于1.5 时受试物最低浓度对应的诱导值(平行均值);
Lb —— 小于1.5 时受试物最高浓度对应的诱导值(平行均值)。
(3)细胞活性计算
细胞活性=(V 受试物-V 空白)/(V 溶剂-V 空白)×100
式中:
V 受试物—— 受试物的吸收值;
V 空白—— 空白(不含细胞不加受试物)的吸收值;
V 溶剂—— 溶剂对照的吸收均值。
(4)ICx 计算
ICx=(Cb-Ca)×((100-x)-Va)/(Vb-Va)+Ca
式中:
X —— 要计算的抑制率百分比(%,如IC50 或者IC30)
Ca —— 抑制率大于x%的最低浓度,μmol/L;
Cb —— 抑制率小于x%的最高浓度,μmol/L;
Va —— 抑制率大于x%的最低浓度下的细胞活率(%);
Vb —— 抑制率小于x%的最高浓度下的细胞活率(%)。
(5)结果判断:
a.对于任何一个结果的判定都要经过至少两次独立的实验,每次实验至少三个平行,如果两次结果不一致,则应进行第三次实验。 实验应在不同的时间,所用受试物必须新鲜配制。
b.阳性结果的判定:两次或三次实验的结果都满足以下四条,则被预测为阳性结果,否则为阴性。
i.受试物的最大诱导倍数Imax 大于等于1.5,与对照相比有显著性差异(t-test);
ii.EC1.5 浓度下细胞的存活率大于70%;
iii.EC1.5 浓度小于1000 μmol/L,或者未确定分子量的受试物小于200 μg/mL;
iv.荧光素酶诱导有明显的剂量依赖性增加。
如果在给定的重复中,所有三个第一条件都得到满足,但不能观察到荧光素酶诱导的明显剂量依赖性的增加,那么这种重复的结果应该被认为是不确定的,可能需要进一步的测试。 此外,在最大试验浓度<1000 μmol/L (或对未确定分子量的试验化学品为200 μg/mL)且在最高试验浓度时细胞活力<70%活力的受试物所获得的阴性结果也应视为非决定性结果。
1.4 统计学分析
2 结果
皮肤致敏剂可作用于传感器蛋白Keap1,从而使其与核转录因子Nrf2 解离,解离的Nrf2 可以激活多种抗氧化基因和Ⅱ相解毒酶基因的转录[10]。 我们通过转染pGL4.17-AKR1C2-ARE-SV40 质粒构建的稳转细胞株,荧光素酶信号反映了内源性Nrf2 依赖基因的致敏物激活状态,此方法可以通过定量检测由Keap1-Nrf2-ARE 反应通路激活引起的荧光素酶基因表达情况,作为皮肤致敏的反应量化指标。本研究是基于OECD TG 442D 测试指南进行[7],但是稳转细胞株是由我们自己构建,因此需要进行验证是否与商品化KeratinoSensTM细胞株有一致的作用条件,以及对指南中的参考物质是否具有很好的检测能力。
2.1 稳转细胞株的鉴定
将G-418 筛选出的两株可以正常生长的细胞株(标记为DSens-1,DSens-2)进行PCR 鉴定,如图1A所示,只有DSens-1 有荧光素酶的表达,而野生型的HaCaT 细胞跟DSens-2 都是阴性的结果,因此DSens-1 为阳性细胞株(以后称DSens)。 将PCR 鉴定出的阳性稳转细胞株DSens 进行阳性物质肉桂醛(CAS:104-55-2)测试,检测该细胞株是否对肉桂醛有剂量效应。 结果表明肉桂醛浓度与荧光素酶的表达量有明显的量效关系(图1B),表明稳转细胞株的构建是成功的。
2.2 DSens 实验条件确定
我们的操作规程参照了OECD TG 442D 测试指南,但是由于使用的稳转细胞株发生了改变,因此需要确定最佳的实验条件。 首先进行铺板密度的确认:将细胞以不同的数量接种到96 孔板(0.0625-6×104个细胞/孔),使用64 μmol/L 的肉桂醛暴露48 h,检测肉桂醛的最大诱导倍数,结果如图2A 所示,64 μmol/L 肉桂醛的诱导倍数在接种量大于1×104个细胞/孔时在2 ~8 之间,并且,接种量在1×104个细胞/孔时,诱导倍数最大,表明在此细胞密度下检测的敏感性最高。 这个结果与KeratinoSensTM的推荐实验条件是一致的,并且数值符合KeratinoSensTM可接受的标准。 其次,荧光素酶试剂盒确认:我们使用了辉光型的荧光素酶试剂盒而非瞬时发光的荧光素酶试剂盒,虽然的荧光衰减随时间较为缓慢,但是不清楚是否会对最终的结果判定产生影响。 为了确定在加入裂解液之后的不同时间读取数值对最终结果判定的影响,我们对同一样品进行不同时间点的数据读取,结果显示,随着时间的延长,样品的荧光强度会缓慢下降(图2B),但是对数据处理后的EC1.5 影响不大(表1),不会影响到对结果的判定。

图1 稳转细胞株的鉴定Figure 1 Identification of the stably transfected cell line

图2 细胞数量及数据读取时间对DSens 实验的影响Figure 2 Effects of DSens cell number and data reading time on the DSens cell experiment

表1 根据图2B 的数据计算的肉桂醛的EC1.5Table 1 EC1.5 of cinnamaldehyde calculated according the date in Figure2B
2.3 化学物样品检测
本研究共对16 种化学物进行检测,包括OECD 指南推荐的10 种化学物和6 种自选化学物(表2)。 从结果可以看出,DSens 对OECD 指南推荐的10 种化学物的预测与KeratinoSensTM预测结果一致[7],并与LLNA 的结果相符[11]。 从EC1. 5 的数值来看,10 种化合物都在OECD 指南的参考范围内。 6 种自选化学物的结果也与LLNA 的结果一致[11],其中SDS 是典型的具有刺激性但无致敏性的物质,DSens 对其检测结果没有出现假阳性。 KeratinoSensTM对间苯二酚的检测出现假阴性的结果[9],但是DSens 给出了与LLNA 一致的阳性预测。
2.4 混合物样品检测
KeratinoSensTM的方法因为缺乏动物实验的验证而不能确定其在混合物检测中的准确性,DSens 方法也存在同样的问题,因此我们在混合物样品的选取上尽量选择已知检测结果的样品以便进行结果的验证。 混合物样品浓度按照未知分子量的物质来设置,最高浓度为200 μg/mL。 洗衣液样品的LLNA:BrdU-ELISA 的预测结果如表3 显示,样品组不同浓度组的SI 与对照组相比没有显著性差异,预测结果为阴性。 表4 结果显示:三个洗衣液的样品暴露的DSens 细胞中荧光素酶基因的表达没有被激活,在设置的一系列浓度中最大诱导倍数Imax 没有大于1.5 的数值,DSens 预测为阴性,与LLNA:BrdU-ELISA 的预测结果一致(表3);自制化妆水中的肉桂醛是化妆品中可以添加的香料致敏物,但其浓度超过限度可能会引起致敏反应,DSens 结果显示样品的EC1.5 为(82.43±13.36)μg/mL<200 μg/mL,预测为阳性,与DPRA 结果一致(多肽平均消除率为13.98%)[12];某品牌化妆水在实验浓度范围内最大诱导倍数Imax 没有大于1.5 的数值,预测为阴性,与人体斑贴试验结果一致;组合化妆水中添加了50%的肉桂醇,肉桂醇是一种弱致敏物,广泛应用于食品香精及化妆品香精中, DSens 结果显示样品的EC1.5 为(90.52±13.31)μg/mL<200 μg/mL,预测为阳性。 总体样品的检测结果显示,6 种样品的预测结果与已知的结果一致,预测成功率100%,并且能够预测出过量添加的弱致敏物,说明DSens方法具有对混合物样品进行预测的潜力,为化妆品成品或者日用化学品的致敏检测提供有价值的参考。

表2 DSens 结果与KeratinoSensTM及LLNA 结果比较Table 2 Comparison of results of DSens Prediction, with that of KeratinoSensTM Prediction and LLNA Prediction

表3 洗衣液样品LLNA:BrdU-ELISA 检测结果Table 3 Laundry samples LLNA: BrdU-ELISA test results
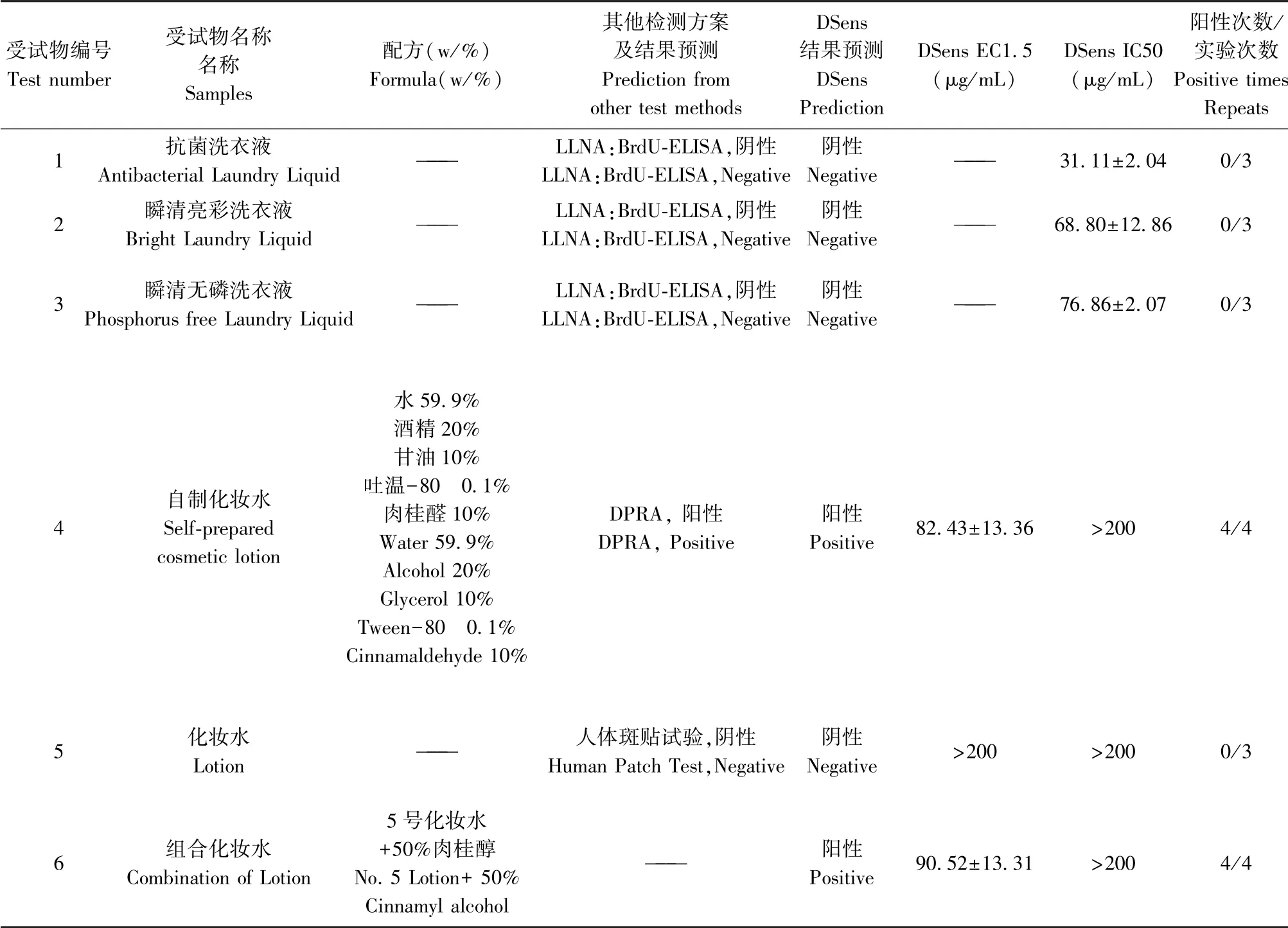
表4 混合物样品DSen 细胞预测结果与其他预测结果比较Table 4 Comparison of the prediction results of mixture products obtained by DSens method and the results of other prediction test methods
3 讨论
物质的致敏性预测作为最重要的安全性评价项目之一,对体外方法的需求非常高,但是由于致敏反应的复杂性,单靠一种体外方法难以对物质的致敏性进行准确的判断,因此多种体外检测方法的组合运用,可以提高检测的准确率。 体外检测方法,尤其是组合方法的运用,可以帮助我们找到优化的实验动物的替代方案,更好的服务于国内的化妆品企业及原料商。 目前商品化的KeratinoSensTM在国内的转移转化存在诸多困难,DSens 方法是国内建立的ARE-Nrf2 荧光素酶方法,它可以弥补国内这一方法的空缺,为国内的体外致敏检测方法提供的更多的选择,也为体外组合方法提供了更多的可能性。
本研究使用OECD TG 442D 测试指南推荐的10 种化学物对该方法进行了成功的验证,这显示该方法的可靠性,可以作为进一步研究和推广应用的基础。 此外,我们另外选取了6 种化学物,其结果与Emter 等[9]人的文章中的数据进行的比对,发现DSens 对间苯二酚的检测结果为致敏阳性,与人体试验和LLNA 结果相符,并没有出现KeratinoSensTM的 假 阴 性 结 果。 这 也 显 示 出 DSens 与KeratinoSensTM方法虽然采用了相同的技术手段,两者之间也存在细微的差异。 但这种差异性产生的原因还不清楚,一种可能的原因由于外源基因插入基因组位置的不同导致稳转细胞株存在一定的差异性,这使得Dsens 对酚类物质的预测不会出现假阴性的结果,当然要证实这一点,我们还需要去验证更多化学物如丁香酚、二氢丁香酚等,这值得我们去进一步的讨论和研究。
本研究采用DSens 方法对混合物样品进行致敏性检测,并与其他检测方法的预测结果进行比较,取得了一致的结果,表明了DSens 方法具有用于产品致敏预测的潜力。 由于我国对产品安全性的监控采用成品测试的方法,DSens 对成品的预测潜力可以为企业研发产品测试提供新的可能。 未来将尝试建立以ARE-Nrf2 荧光素酶方法为基础的系列体外检测方法,可用于可溶性混合物成品如:化妆水、乳液、洗护产品、植物提取物及日用化学品等样品检测。
