氧化铈上负载不同金属(铁、钴、镍、钯)复合催化剂对甲烷完全氧化的性能研究
2020-01-01王丁朱淑英闫晓亮李瑞丰
王丁,朱淑英,闫晓亮,李瑞丰
(太原理工大学 化学化工学院,山西 太原 030024)
甲烷,是天然气中的主要成分,也是导致温室效应的气体,其危害程度是二氧化碳的20倍以上[1-6]。在完全氧化甲烷的过程中,含有晶格氧的氧化铈(CeO2)可以激活分子氧[7-8],金属原子或离子可以有效地激活碳氢化合物中的C—H键,合成纳米复合材料的MOx/CeO2将有望结合两者的优点,实现甲烷在低温条件下的完全氧化。
作为同一周期内的铁、钴、镍三种元素,其金属性逐渐减弱,非金属性逐渐增强,是诸多催化反应的活性成分。金属钯作为金属镍同一族的贵金属元素,被认为是甲烷完全氧化反应最有效的活性成分[9-10]。本文将4种不同的金属负载到氧化铈上,探究其对甲烷完全氧化反应的影响。
1 实验部分
1.1 试剂与仪器
硝酸铁[Fe(NO3)3·9H2O,25 g 阿拉丁,99.999%]、硝酸钴[Co(NO3)2·6H2O,500 g 阿拉丁,99%]、硝酸镍[Ni(NO3)2·6H2O,500 g阿拉丁,98%]、硝酸钯[Pd(NO3)2·2H2O,1 g阿拉丁,Pd>39%]、硝酸铈[Ni(NO3)3·6H2O,100 g阿拉丁,99.95%];蒸馏水 (H2O,自制);无水乙醇 (EtOH,500 mL科密欧,>99.7%),分析纯。
Rigaku D/Max-2500 型全自动旋转靶X-射线衍射仪;AutoChem Ⅱ29020型化学吸附仪。
1.2 催化剂的制备
通过水热合成法[11-12]制备纯的CeO2。将10 mL的0.4 mol/L的硝酸铈溶液混合到70 mL的6.0 mol/L 的氢氧化钠溶液当中,在室温条件下继续搅拌0.5 h。搅拌结束后,将混合溶液装入不锈钢反应釜(内衬材料为聚四氟乙烯)当中,随后将反应釜密封,放入120 ℃烘箱,水热合成时间为24 h。合成结束后,取出反应釜,待反应釜冷却至室温后,对合成物进行洗涤、离心(如此反复多次),随后将合成物放入70 ℃烘箱内干燥8 h。干燥结束后,将合成物转移至马弗炉,按照升温的速率2 ℃/min升温至450 ℃,保持3 h,从而得到纯的CeO2。
通过沉积沉淀法将纳米簇状的MOx负载到CeO2上。将1 g CeO2与100 mL H2O混合,搅拌(转速360 r/min),从而形成黄色悬浮状溶液。随后向黄色悬浮状溶液中加入10 mL金属硝酸盐溶液,在室温下搅拌2 h。搅拌结束后,通过1 mol/L的NaOH溶液(逐滴加入)调节溶液pH,使得混合液的pH=10。调节pH结束后继续搅拌8 h。搅拌结束后,离心,洗涤,70 ℃烘箱进行干燥(8 h),最终得到催化剂前体样品。将催化剂前体样品放置于5%H2/95%N2氛围下,温度400 ℃,还原1 h。随后在5%O2/95%N2氛围下,温度500 ℃,氧化1 h,从而得到催化剂 。
1.3 催化剂反应性能的评价
催化剂的评价在固定床反应器上进行,催化剂用量0.1 g,混合0.3 g石英砂,装填到石英管中 。20 mL/min 的10% CH4/Ar混合10 mL/min 的纯氧,空速为18 000 mL/(g·h)。出口气体用配有TCD 的气相色谱仪(SRI 8610#3,配有HayeSep D以及Molecular Sieve 5A色谱柱)在线分析。反应起始温度为200 ℃,按照每40 min 1次的序列进样方法,在反应温度为200~600 ℃间进行产物检测。
1.4 催化剂的表征
在LabX XRD-6000型全自动旋转靶X射线衍射仪上进行结构分析,Cu-Kα射线,Ni滤波,40 kV,30 mA,8(°)/min 的扫描速度,步长 0.01°,扫描范围为 5~35°。H2-TPR 表征在多功能TP-5000 吸附仪上进行。样品装量50 mg(40~60目),300 ℃He吹扫1 h,然后在流量40 mL/min 的含7% H2的氮气流中以10 ℃/min 从室温到1 000 ℃进行程序升温还原,热导池( TCD )检测。
2 结果与讨论
2.1 表征分析
2.1.1 XRD表征 通过改进的水热合成法,在碱性条件下合成纯的氧化铈。随后,通过沉积沉淀法形成以催化剂前体,之后在氧气氛围下进行煅烧(煅烧温度为500 ℃)形成以氧化铈为载体的金属氧化物催化剂。通过XRD表征结果可以发现,纯的氧化铈载体分别在28.5,33.0,47.4,56.3°以及59.0°位置出峰,这与氧化铈的面心立方体结构(JCPDS43-1002)相吻合,其出峰位置分别对应(111),(200),(220),(311)以及 (222)晶面[13]。

图1 氧化铈的XRD谱图
通过沉积沉淀法引入金属后,对催化剂进行XRD表征,样品出峰位置与之前表征的氧化铈相同,表明金属的引入并没有破坏氧化铈的结构。由于载体的负载量低,未能在谱图上观察到金属或金属氧化物的特征峰。




图2 不同催化剂的XRD谱图Fig.2 XRD patterns of different catalysts
(1)a.1.0% FeOx/CeO2;b.2.0% FeOx/CeO2;c.5.0% FeOx/CeO2;d.10.0% FeOx/CeO2;(2)e.1.0% CoOx/CeO2;f.2.0% CoOx/CeO2;g.5.0% CoOx/CeO2;h.10.0% CoOx/CeO2;(3)i.1.0% NiOx/CeO2;j.2.0% NiOx/CeO2;k.5.0% NiOx/CeO2;l.10.0% NiOx/CeO2;(4)m.0.1% PdOx/CeO2;n.0.2% PdOx/CeO2;o.0.5% PdOx/CeO2;p.1.0% PdOx/CeO2;q.5.0% PdOx/CeO2
2.1.2 H2-TPR表征 通过H2-TPR实验,在温度较高时(900 ℃),CeO2被还原为Ce2O3。4种不同的复合型金属氧化物催化剂中,都在还原温度区间内出现了不同的还原峰,表明金属在氧化铈上所形成的氧化物状态非唯一。负载在氧化铈上的钯的氧化物,在更低温度下(125 ℃)被氢气还原,该还原峰所对应的钯的氧化态为PdO,从而能够在低温的条件下提供反应所需要的激发态的氧原子,相对于铁(325 ℃)、钴(250 ℃)以及镍(275,330 ℃)所需的还原温度更低[14-15]。
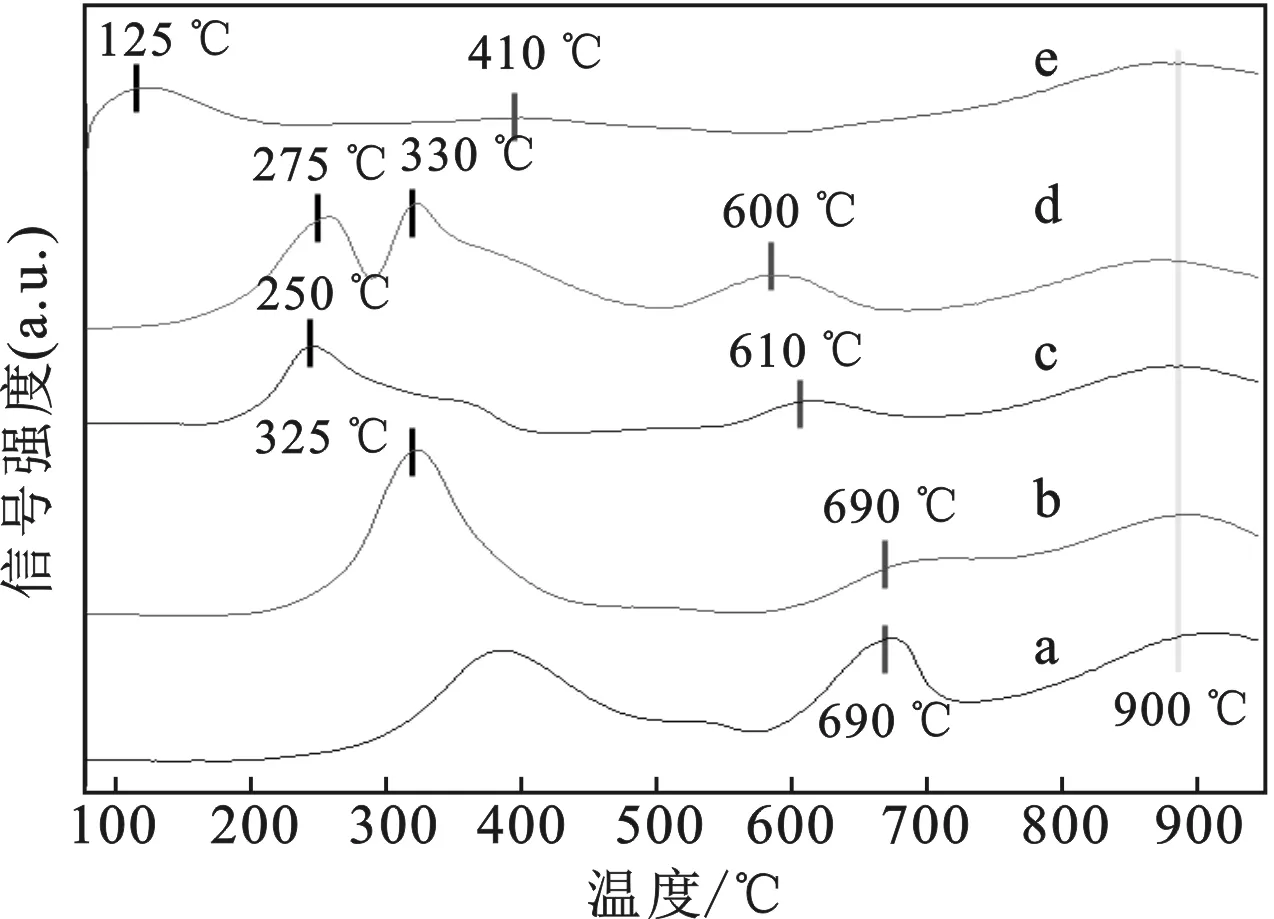
图3 四种催化剂以及载体H2-TPR结果Fig.3 H2-TPR results for 4 catalysts and CeO2 a.CeO2;b.5.0% FeOx/CeO2;c.5.0% CoOx/CeO2; d.5.0% NiOx/CeO2;e.5.0% PdOx/CeO2
并且,通过对比4种催化剂H2-TPR还原峰位置,位于还原温度中间的还原峰(由实线标记),其还原温度在4种不同的催化剂的还原过程中依次降低。分别为5.0% FeOx/CeO2>5.0% CoOx/CeO2>5.0% NiOx/CeO2>5.0% PdOx/CeO2,而5.0% FeOx/CeO2对应的还原温度与氧化铈载体对应的还原温度一致(都是690 ℃),证明负载不同的金属可能会改变载体的部分相的还原温度[16],继而证明了钯的氧化物相对于其他3种金属氧化物来说,能在更低的温度下利用氧空位并促进甲烷完全燃烧反应中活性氧的使用。
2.2 催化性能分析
为探究不同金属与CeO2载体之间的可能存在的协同作用,在相同反应条件下对FeOx/CeO2、CoOx/CeO2、NiOx/CeO2、PdOx/CeO2催化剂的催化性能进行分析。通过在不同的反应温度下进行反应,改变金属的负载量,从而得出以下几个方面的对比分析。
2.2.1 催化效果随温度的变化 金属镍,作为廉价的过渡金属,在较为温和的条件下即可从高价态还原为低价态,因此被广泛应用到诸多的反应当中[17-18]。并且,金属镍与金属钯属于同一族元素,其催化活性与金属钯接近。本小节以金属镍为例,当反应温度从200 ℃上升到600 ℃时,甲烷在温度较低的阶段(200~400 ℃)转化率几乎为0,这表明该催化剂在该阶段反应活性很低或者没有参加反应。当反应温度达到400 ℃以上,甲烷的转化率随着温度上升而逐渐增加。对于不同负载量的催化剂,镍的负载量为5.0%时,其催化效果显著高于其他负载量的催化剂(1.0%,2.0%,10.0%),甲烷的转化率在反应温度为400 ℃时达到1.26%,反应温度为500 ℃时达到67.42%,在反应温度为600 ℃时达到96.58%。同比单独载体的CeO2,其400,500,600 ℃所对应的甲烷转化率分别为0,7.86%,77.25%,充分说明了负载了金属镍的CeO2,其催化效果显著提高,这也就表明,在甲烷的完全氧化反应过程中,通过沉积沉淀法引入的金属Ni起到了重要的作用。

图4 不同负载量的NiOx/CeO2以及CeO2催化性能
2.2.2 催化效果随不同负载金属的变化 通过对比实验结果发现,当金属的负载量为5.0%时,其催化效果最佳。于是,选择相同负载量(5.0%)不同负载金属的催化剂进行对比。实验结果表明,5.0% NiOx/CeO2和5.0% FeOx/CeO2催化效果很接近,相对于5.0% CoOx/CeO2其催化效果有着明显的提高。

图5 相同负载量不同负载金属的MOx/CeO2催化性能Fig.5 Catalytic performance of 100 mg of same load MOx/CeO2 for complete oxidation of methane 反应空速为18 000 mL/(g·h),催化剂用量为100 mg
当负载金属为Pd时,在反应温度为250 ℃时,甲烷的转化率为4.56%,相对于其他3种催化剂,5.0% FeOx/CeO2在400 ℃的甲烷转化率为2.11%,5.0% CoOx/CeO2在450 ℃的甲烷转化率为2.58%,5.0% NiOx/CeO2在400 ℃的甲烷转化率为2.11%,其反应温度大大降低。

表1 不同催化剂下甲烷完全氧化反应的起始反应温度
进一步比较甲烷转化率为50%所对应的反应温度,发现5.0% PdOx/CeO2所对应的反应温度为295 ℃,5.0% FeOx/CeO2所对应的反应温度为480 ℃,5.0% CoOx/CeO2所对应的反应温度为530 ℃,5.0% NiOx/CeO2所对应的反应温度为475 ℃。

表2 不同催化剂下甲烷转化率为50%的反应温度
通过对比实验数据,比较负载不同金属的催化剂在甲烷完全氧化反应中,甲烷完全氧化(甲烷转化率100%)所对应的反应温度,其中5.0% PdOx/CeO2所对应的反应温度为400 ℃,5.0% FeOx/CeO2所对应的反应温度为600 ℃,5.0% CoOx/CeO2所对应的反应温度大于600 ℃,5.0% NiOx/CeO2所对应的反应温度为600 ℃。

表3 不同催化剂下甲烷转化率接近100%的反应温度
2.3 稳定性实验
5.0% PdOx/CeO2催化剂的稳定性是在反应温度为400 ℃的条件下进行的,反应空速为18 000 mL/(g ·h),催化剂用量为100 mg保持不变。如图6所示,甲烷的转化率在第1 d(前24 h)只发生了微小的变化,这就表明,该催化剂在高温处理下表现出极好的催化稳定性。当反应进行了48 h后,甲烷的转化率降低了7.34%。当反应继续进行,甲烷的转化率在96 h(4 d)后降低了15.71%。分析甲烷转化率下降的可能原因:(1)反应进行中产生H2O,使得催化剂活性降低[2];(2)高温下催化剂表面结构发生变化,催化剂的形态发生变化。虽然5.0% PdOx/CeO2催化剂在反应进行4 d后,甲烷的转化率有所降低,但依旧能够保持74.19%之高,相对于其他催化剂在同等条件下甲烷转化率很低(5.0% NiOx/CeO2)或者未发生反应(5.0% CoOx/CeO2)来说,其转化率依旧很高。

图6 5.0% PdOx/CeO2催化剂在400 ℃下的稳定性测试Fig.6 Stability test of 5.0% PdOx/CeO2 at 400 ℃ 反应空速为18 000 mL/(g·h)
3 结论
通过比较4种负载不同金属(铁、钴、镍、钯)纳米复合催化剂对甲烷完全氧化反应的影响,得出了4种金属中金属钯更适合催化甲烷完全氧化反应的结论。并且催化剂5.0% PdOx/CeO2在反应温度为250 ℃就能起活,在反应温度为295 ℃时能够实现49.73%的甲烷转化率,并且在反应温度为400 ℃时就能达到98.47%的甲烷转化率。对催化剂进行XRD表征,样品出峰位置与之前表征的氧化铈相同,表明金属的引入并没有破坏氧化铈的结构。通过H2-TPR表征手段发现,4种不同的复合型金属氧化物催化剂中,负载在氧化铈上的钯的氧化物,在更低温度下(125 ℃)被氢气还原,相对于铁(325 ℃)、钴(250 ℃)以及镍(275,330 ℃)所需的还原温度更低。在稳定性实验中,该催化剂在高温处理下表现出极好的催化稳定性。当反应进行了48 h后,甲烷的转化率降低了7.34%。当反应继续进行,甲烷的转化率在96 h(4 d)后降低了15.71%,但依旧能够保持74.19%之高。
