游泳运动对2型糖尿病大鼠腓肠肌AMPK/SIRT1/PGC-1α信号通路和自噬的影响
2020-01-01李庆学徐磊贾绍辉陈宁
李庆学 徐磊 贾绍辉 陈宁
1武汉体育学院健康科学学院,运动训练监控湖北省重点实验室,天久运动营养研发中心(武汉430079)
2临沂大学体育与健康学院(山东临沂276000)
3武汉体育学院研究生院(湖北武汉430079)
糖尿病是一种以高血糖为主要特征的慢性代谢性疾病,根据发病机理与机制大致可以分为1型糖尿病(type 1 diabetes mellitus,T1DM)和2型糖尿病(type 2 diabetes mellitus,T2DM),其中T2DM患者约占糖尿病患者总数的 90%~95%,其主要发病机制与胰岛素分泌绝对或相对不足、外周组织胰岛素抵抗有关[1]。骨骼肌约占体重的36%~42%,是机体代谢旺盛的组织,也是机体氧化分解的主要场所,其胰岛素抵抗是引发或加重T2DM的重要原因之一。大量研究表明,规律性运动可改善骨骼肌能量代谢和减轻胰岛素抵抗,是非药物治疗T2DM有效的手段之一[2]。然而到目前为止,运动改善T2DM骨骼肌胰岛素抵抗作用机制仍未完全明晰。AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK)、沉默信息调节因子1(silent information regulator 1,SIRT1)和过氧化物酶体增殖活化受体γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator 1 alpha,PGC-1α)构成机体能量感知和代谢调控系统,可通过调控多个信号通路维持细胞甚至全身的能量稳态[3]。研究发现,运动或能量限制可增加骨骼肌、脂肪及肝脏等组织AMP/ATP比值并激活AMPK,AMPK激活后提高细胞内NAD+水平而激活SIRT1活性,激活后的SIRT1和AMPK可通过去乙酰化和磷酸化修饰作用提高PGC-1α的转录活性,从而改善外周组织能量代谢提高胰岛素敏感性[4]。胰岛素抵抗个体骨骼肌发生脂质积累及线粒体功能紊乱等异常形态改变,该特征改变与自噬功能异常时表现一致,Andreas等[5]对T2DM胰岛素抵抗患者骨骼肌检测发现其自噬相关基因和蛋白表达下降,因此骨骼肌自噬功能紊乱与其胰岛素抵抗密切相关。运动作为有效的生理性自噬诱导手段可诱导骨骼肌代谢适应、提高线粒体功能和骨骼肌运动能力,降低胰岛素抵抗[6,7],因此运动激活自噬或许是运动促进T2DM患者健康的潜在重要机制。
目前,运动对AMPK/SIRT1/PGC-1α信号通路和自噬的影响及其在改善骨骼肌胰岛素抵抗中的调控关系尚不完全明确。因此,本研究通过对8周高糖高脂饮食和一次小剂量STZ(30 mg/kg)腹腔注射联合诱导的T2DM大鼠模型进行8周无负重游泳运动,观察AMPK/SIRT1/PGC-1α信号通路与自噬相关蛋白活性,分析长期规律性运动对改善T2DM大鼠骨骼肌胰岛素抵抗的作用机制,为进一步揭示运动改善T2DM的机制提供理论依据。
1 材料与方法
1.1 实验动物及其造模
SPF级6周龄雄性SD大鼠64只,体重150~170 g,购于湖北省疾病预防控制中心,动物许可证号:SCXK(鄂)2011-0012。所有大鼠饲养于武汉体育学院实验动物房,室温22℃ ±3℃,相对湿度55% ±3%,光照时间8:00~20:00。
参照Islam等[8,9]研究构建T2DM大鼠模型。所购大鼠普通饲料适应性饲养1周后,随机分成正常饮食对照组(NC组,n=9)和高糖高脂饮食组(n=55),高糖高脂饮食组8周高脂饮食后,禁食不禁水过夜12 h腹腔注射小剂量链脲佐菌素(STZ,30 mg/kg)诱导T2DM大鼠模型,对照组腹腔注射柠檬酸-柠檬酸钠缓冲液。分别于STZ注射后1周和2周后尾尖采血进行空腹血糖检测以检验T2DM造模情况,T2DM成模的标准:2周内12 h禁食空腹血糖≥11.1 mmol/L[10,11]。将成功诱导的T2DM大鼠(n=49)随机分为糖尿病组(DM组,n=24)和糖尿病运动干预组(DME组,n=25)。
1.2 运动方案
DME组大鼠运动方案参照Lajoie等[12]研究报道并稍加改进,具体如下:不负重游泳训练,水温30℃ ±1℃,第1周游泳时长为15 min,每周递增15 min,直至延长为90 min,其中90 min游泳在45 min时休息5 min。游泳训练时间共持续8周,每周训练5天,每天1次。
1.3 取材
各组大鼠末次训练后恢复24 h进行取材,取材前12 h所有个体禁食不禁水,尾尖采血测量空腹血糖后,迅速断颈处死大鼠并采集血液,快速取出腓肠肌后用PBS进行清洗,一部分快速放入液氮临时保存,然后转移至-80℃冰箱长期保存。
1.4 测定指标及方法
1.4.1 口服糖耐量测试
取材前3天进行口服糖耐量测试(oral glucose tolerance test,OGTT)。所有大鼠禁食不禁水12 h后采用50% 葡萄糖溶液(2 g/kg体重)灌胃,尾尖采血并采用艾科血糖测试仪及配套试纸条检测灌胃后0、30、60、120 min血糖,计算OGTT曲线下区域面积(the area under blood glucose curve,AUC),计 算 公式 为 :AUC=(a+2b+3c+2d)/4-2a,其中a、b、c、d分别代表灌胃前及灌胃后30、60、120 min血糖。
1.4.2 空腹血糖和胰岛素抵抗指数(HOMA-IRMA-IR)测试
高糖高脂饲养前,所有大鼠禁食不禁水12 h,尾尖采血进行空腹血糖(fasting blood glucose,FBG)检测,以后每2周检测1次。末次训练恢复24 h,FBG检测后断颈处死大鼠并取血,所取血液经4℃过夜后3000转离心15 min分离血清,采用酶联免疫法测血清胰岛素水平,根据空腹血糖和空腹胰岛素水平(fasting insulin,Fins)计算胰岛素抵抗指数(homeostasis model assessment-insulin resistance index,HOMA-IR),计算公式为:HOMA-IR=FBG*Fins/22.5。
1.4.3 Western blot blot检测
将大鼠腓肠肌组织从-80℃冰箱取出,快速称取400 mg,放入0.6 L含蛋白裂解液(RIPA,碧云天生物技术有限公司,中国)和蛋白酶抑制剂(PMSF,碧云天生物技术有限公司,中国)混合液中,其中PMSF∶裂解液=1∶100,充分匀浆、超声后,离心取上清进行BCA(碧云天生物技术有限公司,中国)蛋白浓度测定,水浴锅内100℃煮沸10 min使蛋白变性,采用10%的SDS-PAGE进行凝胶电泳。电泳时蛋白上样量为40 μg,85 V 恒压电泳至蛋白Marker分开后,调至120 V直至蓝色染料跑出后关闭电泳仪;350 mA恒流将蛋白转移至硝酸纤维素膜(NC膜);5%脱脂奶粉封闭1.5 h,1×TBST缓冲液清洗后加入一抗AMPK(1∶1000)、PAMPK(1∶1000)、SIRT1(1∶1000)、PGC-1α(1∶2000)、LC-3(1∶500)、p62(1∶1000)、Atg7(1∶1000)、Beclin1(1∶1000)、Bcl-2(1∶500)、Bax(1∶500)、IRS(1∶2000)、p-IRS(1∶2000)和GLUT4(1∶1000)购于美国Cell Signaling Technology公司,4℃摇床过夜;TBST清洗后加入二抗(GAPDH购于美国Cell Signaling Technology公司,稀释比例为1∶10000),室温下摇床孵育2 h;1×TBST缓冲液清洗后,滴加ECL化学发光剂(Thermo公司,美国),置Clinx Chemi Scope荧光及化学发光成像系统(上海勤翔科学仪器有限公司,中国)检测;采用Image J软件对Western Blot图片中各条带灰度值进行分析。
1.5 统计学分析
所有数据均用SPSS17.0统计软件处理,结果采用平均数±标准差(x±s)表示。采用单因素方差分析(One-way ANOVA)计算各组间均值和标准差,独立样本t检验检测NC、DM和DME组间各指标差异,以P<0.05表示差异具有显著性。
2 结果
2.1 各组大鼠空腹血糖、胰岛素抵抗指数和口服糖耐量的变化
与NC组相比,DM组和DME组大鼠空腹血糖在高糖高脂饮食前(0 w)和8周高糖高脂饮食后均无显著性差异(P>0.05),STZ注射2周内空腹血糖显著增加(P<0.01)。与DM组相比,DME组大鼠运动干预4周、6周和8周后空腹血糖显著下降(P<0.05)(图1A)。与NC组相比,DM组和DME组大鼠8周游泳运动干预后HOMA-IR显著增加(P<0.01),DME组的HOMA-IR较DM组显著下降(P<0.05)(图1B)。与NC组相比,8周游泳运动干预后DM组和DME组大鼠口服糖耐量测试AUC面积显著增加(P<0.01),DME组AUC面积较DM组显著下降(P<0.05)(图1C)。

图1 各组大鼠空腹血糖、胰岛素抵抗指数和口服糖耐量测试曲线下面积的变化
2.2 各组大鼠IRS-IRS-1 1、p-IRS--IRS-1 1和GLUTGLUT4 4蛋白表达的变化
与NC组相比,DM组p-IRS-1/IRS-1比值和GLUT4蛋白表达显著下降(P<0.01),DME组较DM组p-IRS-1/IRS-1比值和GLUT4蛋白表达显著增加(P<0.01)(图2A和B)。
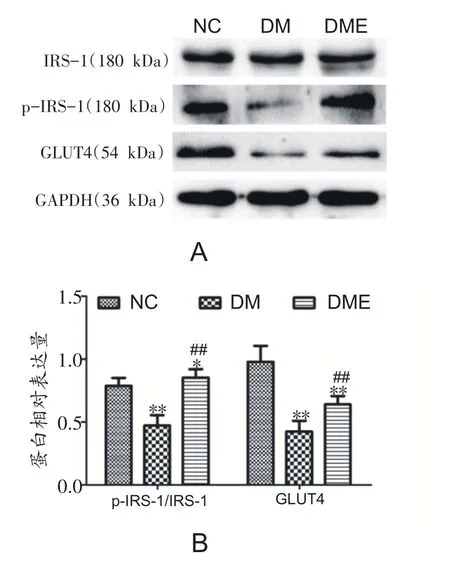
图2 各组大鼠腓肠肌IRS-1、p-IRS-1和GLUT4蛋白表达的变化
2.3 各组大鼠腓肠肌AMPKAMPK、p-AMPK-AMPK、SIRTSIRT1 1和PGC-PGC-1 1α 表达的变化
与NC组相比,DM组p-AMPK/AMPK比值、SIRT1和PGC-1α蛋白表达显著降低(P<0.01)。8周运动干预后,DME组较DM组p-AMPK/AMPK比值、SIRT1和PGC-1α蛋白表达显著增加(P<0.05,P<0.01)(图3A和B)。
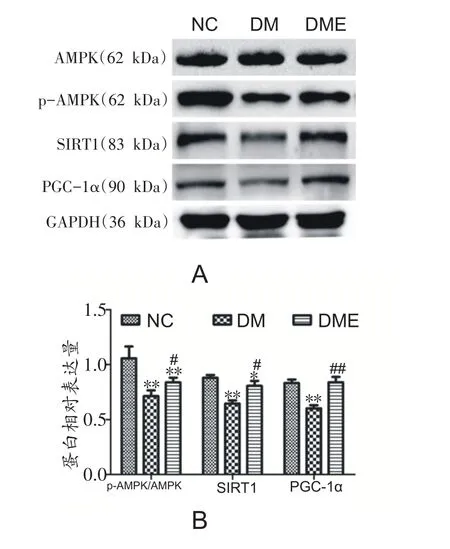
图3 各组大鼠腓肠肌AMPK、p-AMPK、SIRT1和PGC-1α表达的变化
2.4 各组大鼠腓肠肌自噬相关蛋白表达的变化
与NC组相比,DM组Atg7、Beclin1蛋白表达及LC3-Ⅱ/Ⅰ比值显著下降(P<0.05,P<0.01和P<0.01),p62蛋白表达显著增加(P<0.01)。DME组较DM组Atg7、Beclin1蛋白表达及LC3-Ⅱ/Ⅰ比值显著增加(P<0.01,P<0.01和P<0.05),p62蛋白表达显著降低(P<0.01)(图4A和B)。
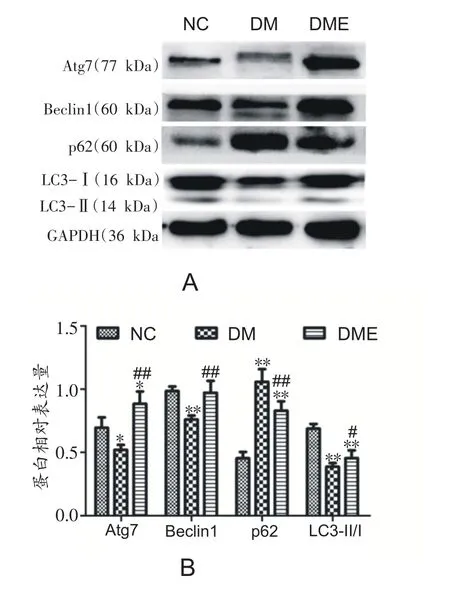
图4 各组大鼠腓肠肌自噬相关蛋白表达的变化
2.5 各组大鼠腓肠肌凋亡相关蛋白表达的变化
与NC组相比,DM组Bcl-2蛋白表达和Bcl-2/Bax比值显著下降(P<0.01),Bax蛋白表达显著增加(P<0.05);DME组较DM组Bcl-2蛋白表达和Bcl-2/Bax比值显著增加(P<0.01),Bax蛋白表达显著下降(P<0.05)(图5A和B)。
3 讨论
骨骼肌是胰岛素刺激葡萄糖摄取的主要器官,其胰岛素抵抗是导致糖尿病患者高血糖的主要原因之一[13]。研究证实AMPK信号通路及自噬在骨骼肌胰岛素抵抗方面发挥重要调控作用,然而有氧运动干预对AMPK/SIRT1/PGC-1α信号通路和自噬的影响及在改善T2DM骨骼肌胰岛素抵抗中的作用研究较少。本研究通过对8周高糖高脂和一次小剂量STZ腹腔注射联合诱导的 T2DM大鼠进行8周无负重游泳运动,发现游泳运动干预显著改善T2DM大鼠空腹血糖、HOMAIR水平和口服糖耐量面积,增加了腓肠肌AMPK/SIRT1/PGC-1α信号通路与自噬相关蛋白活性,显著抑制促凋亡蛋白活性,提示长期规律性运动对T2DM大鼠骨骼肌胰岛素抵抗的改善可能与AMPK/SIRT1/PGC-1α信号通路和自噬激活,抑制骨骼肌细胞凋亡有关。
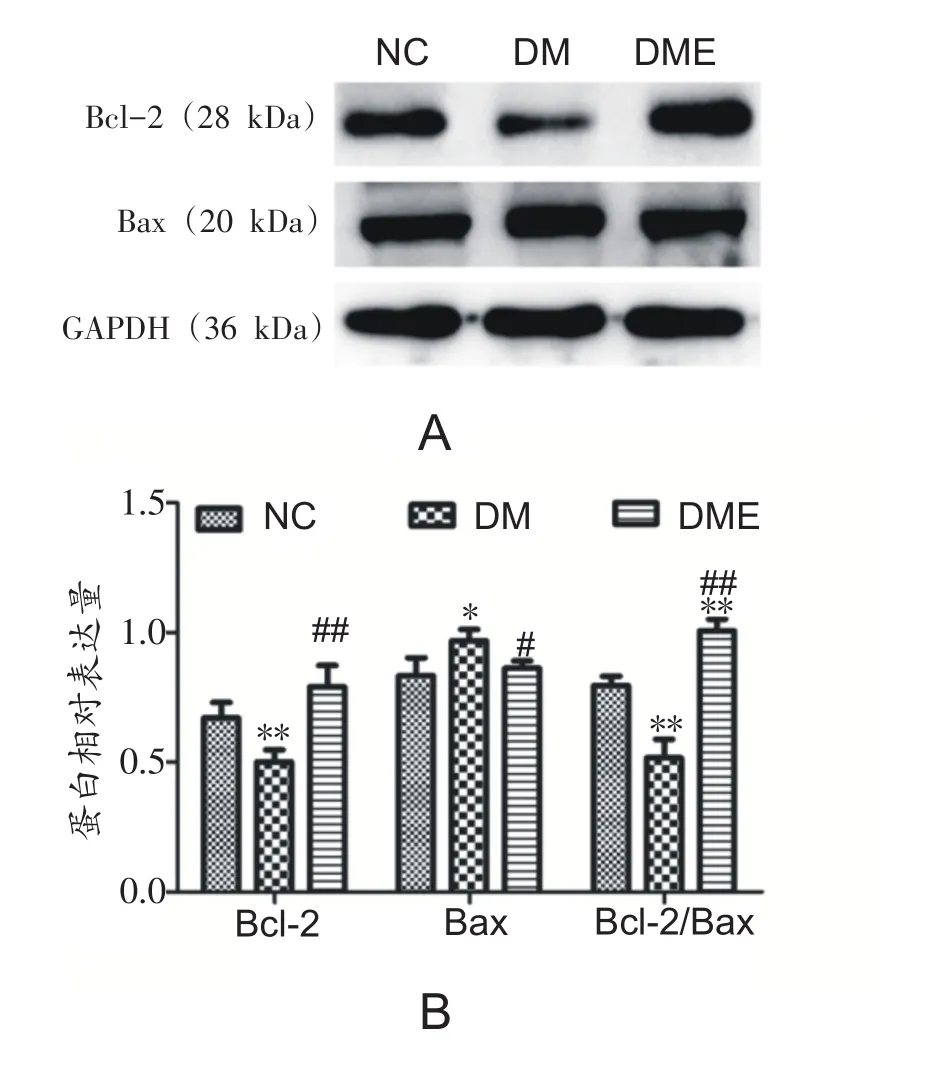
图5 各组大鼠腓肠肌凋亡相关蛋白表达的变化
3.1 游泳运动对骨骼肌葡萄糖代谢和胰岛素抵抗的改善作用
骨骼肌作为机体葡萄糖代谢的主要场所,其葡萄糖的摄取与胰岛素信号传导通路功能密切相关。胰岛素受体底物1(insulin receptor substrate 1,IRS-1)是一种具有高度保守性的磷酸酪氨酸酰基蛋白,在肝脏、骨骼肌和胰岛β细胞等与葡萄糖代谢密切相关的组织中广泛表达。IRS-1参与多种胰岛素生物调节过程,在胰岛素信号胞内转导过程中发挥重要作用。当胰岛素与其受体α亚单位结合后,诱发β亚单位酪氨酸残基磷酸化,激活胰岛素受体中的酪氨酸激酶,已激活的酪氨酸激酶使IRS-1酪氨酸快速磷酸化,并激活磷脂酰肌醇3-激酶(phosphatidylinositiol 3-kinase,PI3K),诱导葡萄糖转运蛋白4(glucose transporter 4,GLUT4)向质膜转移,促进葡萄糖转运至细胞,参与葡萄糖代谢调节[14]。Stuart等发现,胰岛素敏感性受损的肥胖及胰岛素抵抗患者骨骼肌IRS-1磷酸化(phospho-IRS-1,p-IRS-1)水平和GLUT4蛋白活性降低,规律性运动后骨骼肌p-IRS-1水平和GLUT4蛋白活性增加,骨骼肌胰岛素敏感性改善[15]。本研究中,8周游泳运动提高了T2DM大鼠腓肠肌p-IRS-1和GLUT4蛋白表达,结合空腹血糖、HOMA-IR水平和口服糖耐量测试结果,再次证明规律性运动对于改善T2DM患者机体葡萄糖代谢和胰岛素抵抗起到重要作用[1]。
3.2 游泳运动对骨骼肌AMPK/SIRT/SIRT1 1/PGC-/PGC-1 1α 信号通路的影响
AMPK、SIRT1和PGC-1α构成机体能量感知系统参与机体能量调控,在改善骨骼肌胰岛素抵抗中发挥重要作用[3]。Goh等发现,T2DM个体骨骼肌中AMPK、SIRT1和PGC-1α表达下降,而口服白藜芦醇后上述蛋白活性增加,骨骼肌胰岛素抵抗得到显著改善[16]。运动或肌肉收缩会导致AMP/ATP比值增加激活AMPK,激活后的AMPK可通过磷酸化激活SIRT1,直接或间接对胰岛素信号通路进行调控,在改善机体糖脂代谢和外周胰岛素抵抗、维持β细胞质量中发挥重要作用[17]。PGC-1α作为一种辅助因子,在心脏、骨骼肌和肝脏等能量需求高的组织中高度表达,广泛参与糖脂代谢、细胞能量代谢、氧化应激和炎症等多种生理活动调控[18]。研究发现,糖尿病患者骨骼肌中PGC-1α表达降低,提示骨骼肌葡萄糖抵抗可能与PGC-1α调控的能量代谢紊乱有关[19]。而运动可通过激活AMPK和SIRT1等多种细胞因子提高PGC-1α的转录活性,在降低体重、提高胰岛素敏感性等方面发挥重要作用[20]。在对AMPK、SIRT1和PGC-1α间的相互关系及其在骨骼肌胰岛素抵抗中的作用研究中发现,包括二甲双胍在内的多种抗糖尿病药物对骨骼肌细胞胰岛素敏感性的改善与AMPK、SIRT1和PGC-1α激活有关[21]。本研究中,8周游泳运动干预后T2DM大鼠腓肠肌p-AMPK/AMPK比值、SIRT1和PGC-1α蛋白表达显著增加,结合空腹血糖、HOMA-IR水平、口服糖耐量面积以及胰岛素作用信号通路相关蛋白表达结果来看,运动刺激具有抗糖尿病药物的相关特性,其对腓肠肌胰岛素抵抗的改善可能与运动诱导AMPK、SIRT1和PGC-1α蛋白表达密切相关,本研究结果与Oliveira NR等的研究结果一致[22]。
3.3 游泳运动对骨骼肌自噬与凋亡的影响
基础水平自噬维持细胞生存和功能,而自噬障碍则导致细胞功能紊乱和活力下降并诱发细胞凋亡,引起包括T2DM在内的多种疾病[23]。大量研究发现,肥胖和葡萄糖耐量受损患者骨骼肌自噬功能下降,而运动干预通过激活自噬,改善骨骼肌胰岛素敏感性[24]。本研究中,与NC组相比,DM组腓肠肌自噬相关蛋白7(autophagy related 7,Atg7)和Beclin1(酵母自噬基因Atg6的同源基因)表达、Ⅱ和Ⅰ型微管相关蛋白1轻链3(microtubule-associated protein lightchain,LC3)的比值(LC3-Ⅱ/Ⅰ)显著下降,p62(sequestosome 1)蛋白表达显著增加,说明DM组大鼠腓肠肌自噬水平下降,而8周运动干预后T2DM大鼠腓肠肌Atg7、Beclin 1表达和LC3-Ⅱ/Ⅰ比值显著增加,p62表达显著降低,提示运动激活T2DM大鼠腓肠肌自噬功能。自噬与凋亡相互影响和制约,两者间的平衡在维持机体稳定中发挥重要作用,因此在研究自噬对机体功能影响时,需要充分考虑凋亡水平的变化。B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和Bax均属Bcl-2蛋白家族成员,Bcl-2可阻断促凋亡蛋白进入线粒体,减弱凋亡信号通路,Bax通过与Bcl-2形成同源二聚体或异源二聚体的形式抑制Bcl-2抗凋亡作用,从而促使细胞凋亡[25]。在研究细胞抗凋亡和促凋亡两种力量对比中常用Bcl-2/Bax比值进行评价,该比值增加说明抗凋亡能力较强,促凋亡能力降低。糖尿病患者骨骼肌Bcl-2和Bax表达分别下降和上升,说明骨骼肌细胞凋亡水平增加[26]。本研究中,T2DM大鼠腓肠肌Bcl-2表达和Bcl-2/Bax比值降低,Bax表达增加,提示T2DM大鼠腓肠肌凋亡水平增加。而8周运动干预后T2DM大鼠腓肠肌抗凋亡能力显著增强。结合自噬相关蛋白检测结果,运动干预对T2DM大鼠腓肠肌抗凋亡能力的改善可能与自噬功能提高或改善有关。该研究结果与Zhang等研究结果相一致,在其研究中自噬激活后抑制了高糖诱导的血管内皮细胞凋亡[27]。
目前,已有研究发现,AMPK/SIRT1/PGC-1α信号通路对多种组织和细胞自噬功能具有激活或改善作用。AMPK激活后可通过磷酸化ULK1(unc-51-like autophagy-activating kinase 1)、负向调控哺乳动物雷帕霉素靶蛋白复合体 1(mammalian target of rapamycin complex 1,mTORC1)及调控多种转录因子表达参与自噬调节[28,29]。Lee等研究发现,SIRT1基因缺陷小鼠与Atg5基因敲除小鼠相似,具有骨骼肌内受损细胞器增多的现象,进一步研究发现SIRT1对自噬的调控是通过乙酰化激活包括Atg7等多种自噬相关蛋白实现的[30]。高糖培养的H9C2心肌肥大细胞自噬功能受损、线粒体形态和功能异常,而黄连素(100 nM/L)可通过激活AMPK/SIRT1/PGC-1α信号通路诱导线粒体生物发生并恢复自噬功能[31]。高糖培养的大鼠胰岛素瘤细胞(insulinoma cell line,INS-1)活性和葡萄糖刺激胰岛素分泌能力下降,二甲双胍(5 μmol/L)通过激活AMPK/SIRT1/PGC-1α信号通路激活和诱导自噬对上述现象具有逆转作用[32]。还有研究发现,AMPK/SIRT1/PGC-1α信号通路可提高骨骼肌自噬功能,对地塞米松诱导的骨骼肌功能紊乱具有显著改善作用[33]。此外,蛇葡萄素对D-半乳糖诱导的衰老性大鼠肌萎缩的预防机制与其诱导 AMPK、SIRT1和PGC-1α表达和自噬激活有关[34]。最近,Kwon研究指出,长期运动可激活骨骼肌自噬功能,增加骨骼肌葡萄糖摄取和胰岛素敏感性,其机制与AMPK/SIRT1/PGC-1α信号通路激活有关[35]。由此可见,运动、AMPK/SIRT1/PGC-1α信号通路、自噬与胰岛素抵抗的改善存在潜在的调控作用,然而目前其确切调控作用并未完全阐明,因此,尚需继续深入研究。
4 结论
8周高糖高脂饮食结合小剂量STZ腹腔注射诱导的T2DM大鼠具有葡萄糖代谢紊乱和胰岛素抵抗的显著特点。8周游泳运动可能通过激活AMPK/SIRT1/PGC-1α信号通路和自噬,上调骨骼肌胰岛素信号通路,从而有效改善葡萄糖代谢紊乱和骨骼肌胰岛素抵抗。
