有氧运动或抗阻运动诱导骨形态发生蛋白7调节大鼠能量代谢的研究
2020-01-01李良徐建方房国梁苏浩
李良 徐建方 房国梁 苏浩
1国家体育总局体育科学研究所(北京100061)
2北京体育大学(北京100084)
骨形态发生蛋白(bone morphogenetic protein,BMP)是由Marshal Urist从成人骨组织中提取的一种活性蛋白质,除了BMP1外,其成员均属于转化生长因子-β超基因家族成员[1]。BMP是一类多功能生长因子,除了能够诱导软骨与骨的形成外,还参与胚胎发育中的诸多过程,如神经分化、体节发育等[2]。BMP在间充质干细胞、脂肪前体细胞及胚胎干细胞的分化及脂肪生成过程中也起着重要的调控作用[3]。BMP7最初是作为骨诱导剂而被研究者发现的,因此又被称为成骨蛋白1[4]。后续研究发现,BMP7是一种多效能的蛋白质,在细胞增殖和分化、细胞凋亡、食欲调节、脂肪生成、能量消耗等方面均有重要作用[5,6]。在成年时期,肾脏、骨骼、软骨、心脏等部位均可表达BMP7[7];作为一种信号蛋白,BMP7也可由脂肪组织的基质血管细胞合成[1];另外,大脑的多个部位也可表达BMP7,包括下丘脑、海马等[8]。
脂肪是维持能量平衡的重要内分泌组织,当脂肪堆积过多时便会导致肥胖,进而诱发一些代谢性疾病。在哺乳动物体内,白色脂肪(white adipose tissue,WAT)和棕色脂肪(brownadiposetissue,BAT)是两种常见的脂肪组织,但两者有截然不同的特征和功能[9]。WAT的主要功能是将多余的能量以甘油三酯的形式储存起来,这也是导致体重增加的关键因素;BAT的主要功能是通过非战栗性产热的形式释放热量,其产热机制需要借助于棕色脂肪特异性表达的解耦联蛋白1(uncoupling protein 1,UCP1),线粒体内膜中的H+可通过UCP1在线粒体内膜上的特殊通道被传递回线粒体基质中,此过程不与任何能量消耗过程相偶联,底物氧化所生成的能量便会以产热的形式散失[10]。WAT在一些激活剂的刺激下可以转化为BAT,这个过程被称为白色脂肪棕色化,通过诱导白色脂肪棕色化可在一定程度上提高机体的能量代谢率,达到消耗脂肪、减轻体重的目的。
体重的调节是通过能量摄入与消耗的平衡来实现的,而BMP7可以增加BAT的产热能力,促进能量消耗。研究发现,BMP7可升高机体温度,促进氧化磷酸化及线粒体的生物合成,并能降低能量摄入、减少WAT[1,11]。此外,BMP7还能通过激活交感神经系统触发信号转导串联,这会导致线粒体内膜中BAT标记物UCP1表达增加,通过解偶联反应产热而消耗能量[1,11]。BMP7是胚胎期形成BAT所必需的因子,研究表明,缺失BMP7的小鼠,会直接导致BAT质量和UCP1蛋白表达水平的显著降低;相反地,将BMP7导入到BAT细胞的前体细胞,可促进其分化为BAT细胞[1]。Tseng等[11]的研究发现,敲除BMP7基因的小鼠胚胎表现出明显的BAT缺乏,甚至无法检测出UCP1的表达;在小鼠中利用腺病毒介导BMP7高表达,发现BAT显著增加,而WAT未增加,由此导致了能量消耗增加、体重降低。另一方面,BMP7还是新发现的作用于下丘脑并参与食欲调节的食欲抑制因子[12]。食欲抑制因子在中枢神经系统、下丘脑腹中和腹外侧有大量受体,且在含有神经肽Y、刺鼠相关蛋白、阿黑皮素原/可卡因和苯丙胺转录物的腹中和腹外侧弓状核中的神经元上均有表达[13]。在共聚焦显微镜下可以看出,BMP7及其受体与食欲调节神经肽共定位于大脑中[12]。有研究显示,腺病毒转染BMP7减少了瘦素缺乏(ob/ob)肥胖小鼠的食物摄入,并减轻了体重、改善了代谢综合征状况[14]。
BAT的产热能力是肝脏的数十倍,是肌肉的数倍,如果完全激活BAT的功能,50 g BAT能消耗相当于20%静息代谢的能量[15]。BAT的激活以及运动诱导白色脂肪棕色化因子的产生被认为是运动调节静息能量代谢的关键点[16]。研究发现,有氧运动训练能够促进白色脂肪棕色化的发生,进而提高机体的能量代谢水平[17],尤其对皮下WAT的诱导作用更加显著[18]。龚文辉等[19]对饮食诱导的肥胖大鼠进行了8周的有氧运动干预,实验结果发现大鼠BAT及下丘脑中BMP7的蛋白表达水平均升高,可能通过促进BAT的产热功能减轻了大鼠的体重并降低了体脂比。
综上所述,BMP7在调节白色脂肪棕色化和促进BAT产热方面有潜在的重要作用。研究发现,有氧运动在一定程度上可提高BMP7的表达进而起到减脂控体重的作用,但目前的研究证据还很有限,有关有氧运动与BMP7表达之间的关系还有待进一步研究来阐释。另一方面,抗阻运动也在逐渐成为一种流行的运动方式,它可在一定程度上提高机体的基础代谢水平,但目前关于抗阻运动对BMP7表达的影响也鲜有研究报道。因此,本研究的目的是通过观察有氧运动或抗阻运动干预对大鼠脂肪组织和下丘脑BMP7表达的影响,结合大鼠在静息状态下能量消耗的变化,探讨不同运动方式通过BMP7调控大鼠能量代谢的作用。
1 材料与方法
1.1 实验对象及分组
8周龄雄性SD大鼠,购自北京维通利华实验动物技术有限公司。大鼠在SPF级动物房中利用符合国家标准的啮齿类动物普通饲料分笼饲养,动物房温度控制在22℃ ±1℃,相对湿度40%~60%,维持12小时明暗循环。适应性喂养1周后,利用电子秤(BY-671,冰禹,上海)对所有大鼠分别称重(精确到0.1 g),然后将大鼠随机分为三组:安静对照组(CON组)、有氧运动组(AE组)、抗阻运动组(RE组),每组各10只。其中,AE组和RE组大鼠分别进行8周的有氧运动或抗阻运动训练,安静对照组不进行运动干预。在运动干预期间,大鼠维持自由进食和饮水。
1.2 运动训练方案
1.2.1 有氧运动训练方案
AE组大鼠首先进行1周的跑台适应性训练,跑台速度为10 m/min,每天训练10 min,跑台坡度为0°。适应性训练结束后进行8周的正式训练,每周训练5天,休息2天。正式训练过程中跑台坡度保持0°,跑台速度和训练时间每周递增,详细的有氧运动训练方案如表1所示。
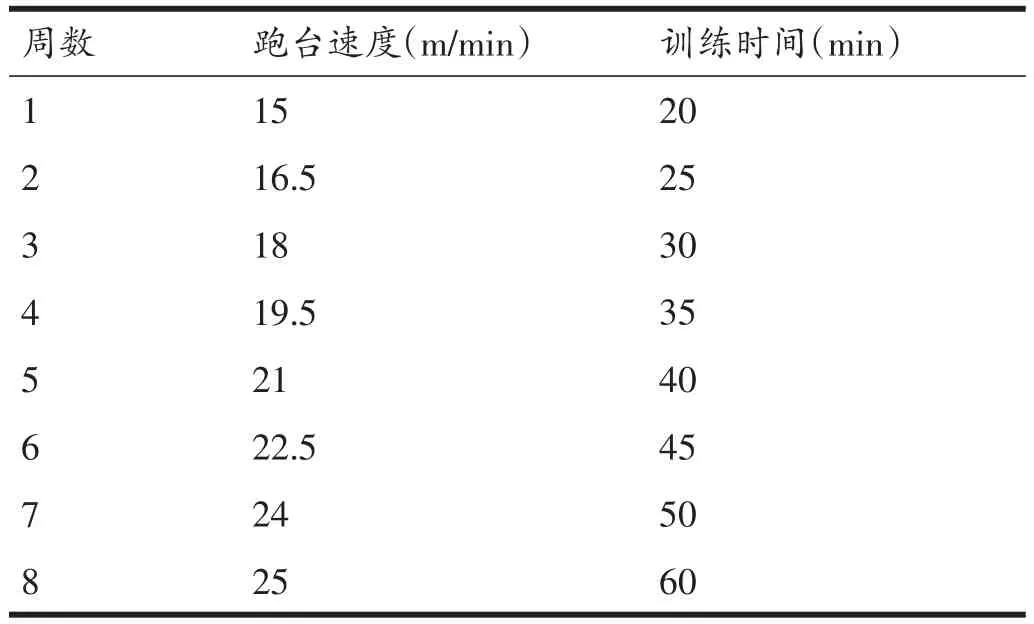
表1 有氧运动训练方案
1.2.2 抗阻运动训练方案
在参考文献研究的基础上,本实验室建立了“负重爬梯法”对大鼠进行抗阻运动训练[20]。爬梯长1.10 m,宽0.18 m,以80°倾斜放置在地面上,其顶部有设有供大鼠休息的小笼子。大鼠首先进行1周的爬梯适应性训练,由爬梯底部爬到顶部为一次完整爬梯训练,适应性训练时不负重,必要时在尾部给予刺激。
正式训练每2天训练一组,共训练8周,大鼠在每组训练中需完成8次爬梯,次间休息2 min。在第一组训练时,初始负荷为大鼠体重的50%,后续每次爬梯时递增负荷30 g,直到大鼠完成8次爬梯训练;若大鼠在训练中无法爬到顶部,则认为该次爬梯失败,并将前次爬梯的负荷定为该组训练的最大负荷以完成剩余训练。在第二组训练中,前4次爬梯的负荷分别为第一组训练最大负荷的50%、75%、90%和100%,在该组随后的爬梯训练中每次递增负荷30 g,直到大鼠完成8次爬梯训练,并确定新的最大负荷。若训练中出现大鼠爬梯失败的情况,仍以前次爬梯的负荷定为该组训练的最大负荷以完成剩余训练。在每组训练中均需确定新的最大负荷以供下组训练使用,以此类推,直到完成8周训练。
1.3 大鼠静息状态下能量消耗测量
完成最后一次训练24小时后,利用哥伦布斯动物气体代谢分析系统(Comprehensive Lab Animal Monitoring System,Columbus Instruments,Columbus,USA)测试各组大鼠在静息状态下的能量消耗情况。如图1所示,该动物气体代谢分析系统是一个间接开放回路热量计,通过已知速率的强制通风,系统在进气口和出气口处可监测单位体积内氧气(O2)和二氧化碳(CO2)浓度。再通过气体浓度差异,可以计算出O2消耗量(VO2)、CO2产生量(VCO2)及呼吸交换率(respiratory exchange ratio,RER)。该系统配备有模块化密闭小舱室,可给实验动物提供一个独立、密闭的良好空间,通过与气体代谢分析系统相连,可测量实验动物在安静状态下的VO2及VCO2。本研究在测试过程中,将大鼠放入密闭小舱室中,给予饮用水但不提供食物,在静息状态下连续监测4小时气体代谢数据。该测试在白天进行,根据大鼠饲养的“明-暗”周期,测试时间对应大鼠在夜间的活动时段。根据测得的VO2和VCO2数据按下列公式计算出大鼠在静息状态下的能量消耗水平[21,22]:静息能量消耗(kcal/hr)=(3.815+1.232×RER)×VO2(L/kg/hr)×体重(kg)

图1 哥伦布斯动物气体代谢分析系统
1.4 大鼠取材及指标测试
完成静息代谢测量后,大鼠禁食过夜。利用电子秤对大鼠称重后,向大鼠腹腔注射一定量的10%水合氯醛溶液将大鼠麻醉处死并进行取材。首先于腹主动脉取血4 mL并置于血清管中,离心后取血清并利用大鼠BMP7 ELISA检测试剂盒(Rat BMP7 ELISA Kit,Bio-Swamp,China)检测BMP7水平。取出大鼠腹股沟皮下白色脂肪及肩胛间棕色脂肪,用锡铂纸包装后置于液氮中冷冻,然后转移至-80℃冰箱中保存,用于测试BMP7、UCP1的基因及蛋白表达水平。将大鼠开颅后取出下丘脑,用锡铂纸包装后置于液氮中冷冻,然后转移至-80℃冰箱中保存,用于测试BMP7的基因和蛋白表达水平。
1.4.1 荧光定量PCRPCR检测样本中BMP7、UCP1的基因表达水平
将组织样本研磨粉碎后,利用QIAGEN总RNA提取试剂盒提取样本RNA。以提取出的RNA为模板,配制40 μL的反转录体系合成cDNA。然后,再以cDNA为模板,β-actin为内参,配制20 μL的反应体系进行基因扩增,扩增条件为:95℃ 3分钟、94℃ 20秒、60℃ 20秒、72℃ 20秒,共循环40次。利用荧光定量PCR仪(CFX 96 Conect,Bio-Rad,USA)进行荧光定量,根据荧光定量结果,利用2-△△ct法对样本中BMP7、UCP1的基因表达水平进行相对定量。实验检测中所需的所有引物均参照GeneBank数据库提供的基因序列(表2),由上海生工生物技术有限公司合成。
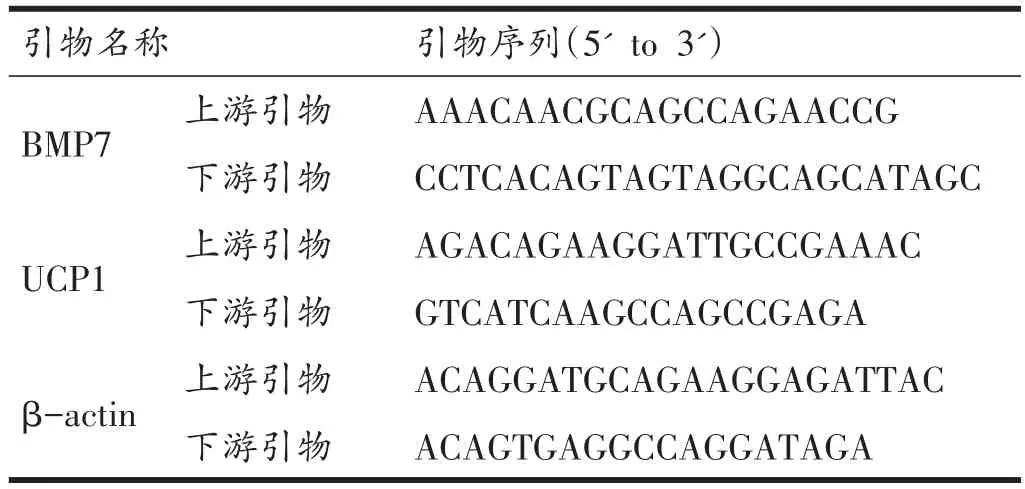
表2 目的基因的引物序列
1.4.2 Western Blot Blot法检测样本中BMP7、UCP1的蛋白表达水平
提取组织样本中的总蛋白,配制BCA工作液并检测蛋白浓度,再利用RIPA裂解液对蛋白浓度进行调整。然后,以蛋白量20 μg为一次上样量(根据测定的蛋白浓度计算蛋白上样量),配制上样使用的蛋白液。上样完毕后,利用10%的SDS-PAGE凝胶电泳分离蛋白,200 mA恒流转膜,转膜时间1 h,然后放入3%BSA-TBST中封闭30 min。然后将膜与稀释好的一抗(BMP7与UCP1的稀释比均为1∶3000)室温孵育10 min,放4℃过夜。次日拿出膜后室温孵育30 min,用TBST洗膜3次,每次5 min,洗去残留一抗。加入HRP标记的山羊抗兔二抗(稀释比1∶5000),室温摇床孵育90 min,然后用TBST洗膜4次,每次5 min。最后加入ECL化学发光试剂反应3~5 min,曝光10 s~5 min,显影2 min后定影。用UVP凝胶图象处理系统Labworks4.6软件分析目的条带的灰度值,将每个条带与相应样品的内参条带灰度值进行比较,计算出BMP7和UCP1的相对蛋白表达量。
1.5 数据处理与分析
所有数据利用SPSS 20.0软件进行统计和分析,统计结果以平均值 ±标准差(x±s)表示。三组间的数据利用单因素方差分析(One-Way ANOVA)进行统计分析和比较,根据分析结果再利用最小显著差异法(LSD)进行组间两两比较。以P<0.05为差异具有统计学意义。
2 结果
2.1 运动干预对大鼠体重的影响
如图2所示,三组大鼠的体重在运动干预前无显著差异(CON vs.AE vs.RE:357.10 ± 20.38 g vs.350.36 ± 18.22 g vs.352.08 ± 19.78 g,P>0.05)。运动干预期间,CON组大鼠体重增长较快,而AE组和RE组大鼠体重增长相对缓慢。8周运动干预结束后,CON组大鼠体重为542.80±44.18 g,显著高于AE组(467.06 ± 40.56 g,P<0.01)和RE组(478.94 ± 30.39 g,P<0.01),AE组和RE组大鼠体重无显著差异。
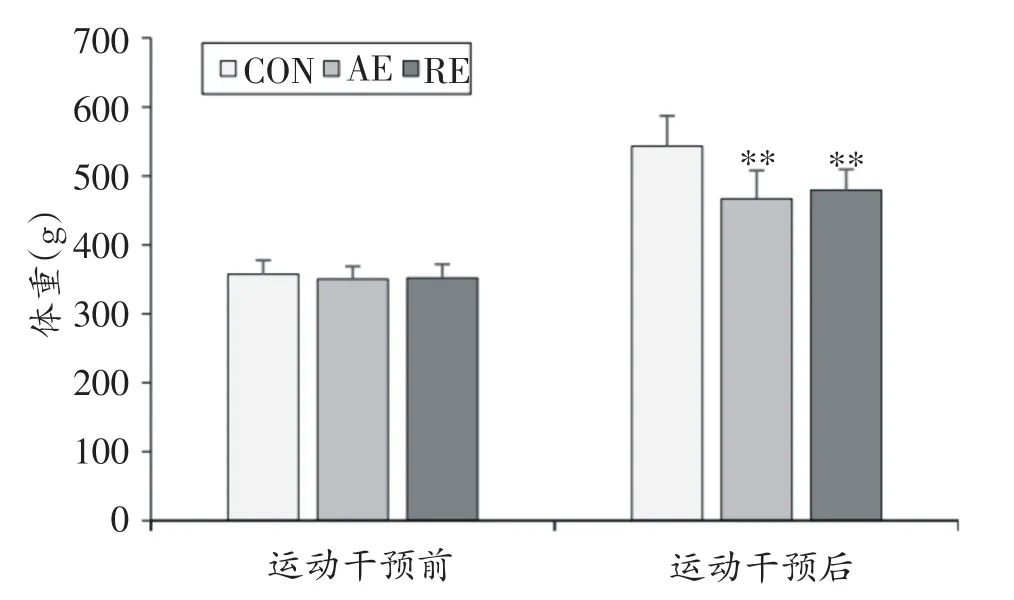
图2 各组大鼠在运动干预前后的体重变化
2.2 运动干预对大鼠血清BMP7水平的影响
8周运动干预后,CON组大鼠血清BMP7水平为501.62±36.78 pg/mL,显著低于AE组的540.47±33.45 pg/mL(P<0.05),但与 RE 组的 499.22 ± 30.53 pg/mL无显著差异。另外,AE组的血清BMP7水平显著高于RE组(P<0.05)。
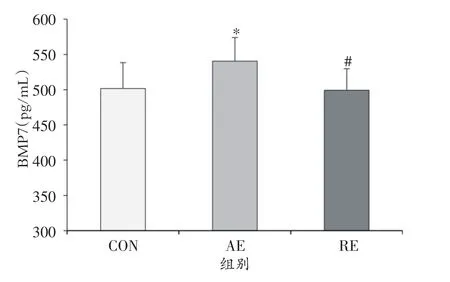
图3 运动干预对大鼠血清BMP7水平的影响
2.3 运动干预对BMP7和UCP1基因及蛋白表达的影响
2.3.1 运动干预对大鼠WATWAT中BMP7基因及蛋白表达的影响
8周运动干预后,大鼠WAT中BMP7基因及蛋白表达情况如图4所示。CON组BMP7基因相对表达量为1.05 ± 0.34,显著低于AE组的2.12 ± 0.84(P<0.01),而与RE组(1.41±0.45)无显著差异。在蛋白表达水平中,CON组的BMP7蛋白相对表达量显著低于AE组和RE组(CON vs.AE vs.RE:1.00 vs.1.50 ± 0.32 vs.1.59 ± 0.38,P<0.05),但AE组和RE组间无显著差异。
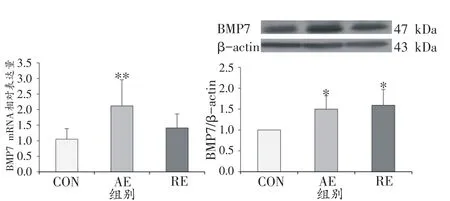
图4 运动干预对大鼠WAT中BMP7基因及蛋白表达的影响
2.3.2 运动干预对大鼠BATBAT中BMP7基因及蛋白表达的影响
8周运动干预后,大鼠BAT中BMP7基因及蛋白表达情况如图5所示。CON组BMP7基因相对表达量为1.03 ± 0.35,显著低于AE组的1.45 ± 0.71(P<0.05)和RE组的1.64 ± 0.51(P<0.05),AE组与RE组无显著差异。在蛋白表达水平中,三组大鼠BMP7的蛋白相对表达量均无显著差异(CON vs.AE vs.RE:1.00 vs.1.03 ± 0.05 vs.0.99 ± 0.05,P>0.05)。
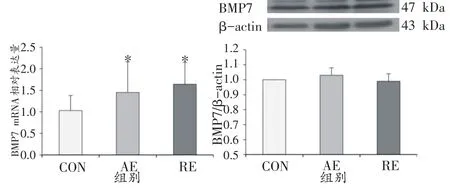
图5 运动干预对大鼠BAT中BMP7基因及蛋白表达的影响
2.3.3 运动干预对大鼠BATBAT中UCP1基因及蛋白表达的影响
8周运动干预后,大鼠BAT中UCP1基因及蛋白表达情况如图6所示。CON组UCP1基因相对表达量为1.02 ± 0.26,显著低于AE组的6.78 ± 1.95(P<0.01)及RE组的7.28 ± 1.83(P<0.01),AE组与RE组无显著差异。在蛋白表达水平中,三个组的UCP1蛋白相对表达量均无显著差异(CON vs.AE vs.RE:1.00 vs.0.73± 0.22 vs.0.88 ± 0.23,P>0.05)。
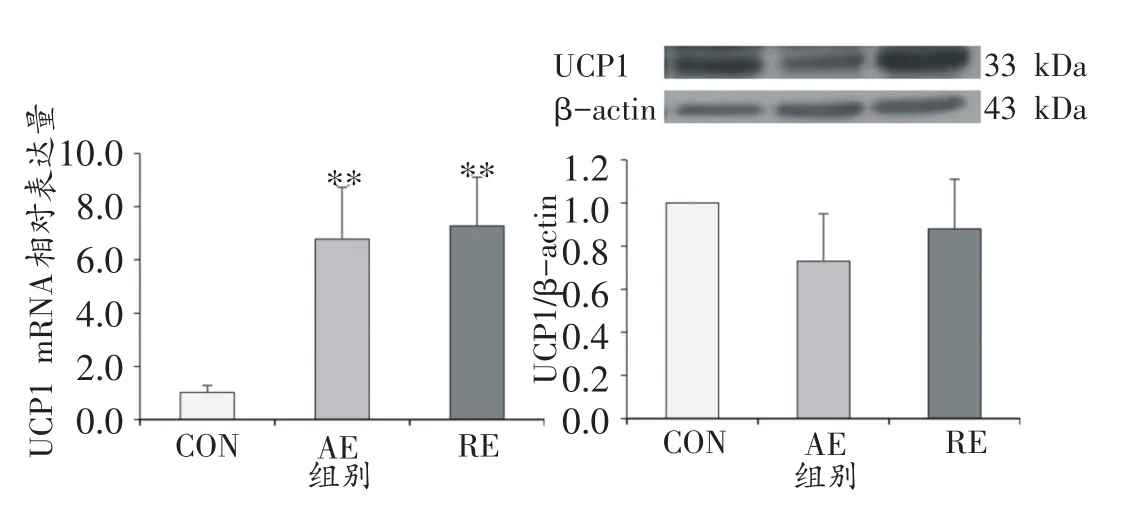
图6 运动干预对大鼠BAT中UCP1基因及蛋白表达的影响
2.3.4 运动干预对大鼠下丘脑组织BMP7基因及蛋白表达影响
8周运动干预后,大鼠下丘脑组织BMP7基因及蛋白表达情况如图7所示。CON组BMP7基因相对表达量为1.04±0.33,显著低于AE组的1.70±0.41(P<0.05);CON组的BMP7基因相对表达量低于RE组(1.55±0.60),但无显著差异;AE组与RE组的BMP7基因表达量无显著差异。在蛋白表达水平中,CON组的BMP7蛋白相对表达量显著低于AE组(CON vs.AE:1.00 vs.1.22 ± 0.26,P<0.05),但与RE组(1.13±0.18)无显著差异。

图7 运动干预对大鼠下丘脑组织中BMP7基因及蛋白表达的影响
2.4 运动干预对大鼠静息状态能量消耗的影响
8周运动干预后,利用动物气体代谢分析仪对大鼠在静息状态下的能量消耗情况进行了测定,各组大鼠的静息氧耗量及静息能量消耗如图8所示。CON组大鼠在静息状态下的VO2为1.00±0.25 L/kg/hr,显著低于AE 组的1.15 ± 0.32 L/kg/hr(P<0.01)及RE 组的1.14 ± 0.30 L/kg/hr(P<0.01),AE组与RE组无显著差异。根据测算,CON组大鼠在静息状态下的能量消耗为2.53±0.54 kcal/hr,显著低于AE组的2.83±0.62 kcal/hr(P<0.01)及 RE 组的 2.73 ± 0.57 kcal/hr(P<0.05),AE组与RE组无显著差异。

图8 运动干预对大鼠静息状态的氧耗量及能量消耗的影响
3 讨论
诸多研究已证实,合理的运动锻炼可减少脂肪堆积、促进能量代谢,达到控制体重、提高身体素质的目的。任华等[23]在实验中对肥胖大鼠进行了8周的有氧运动干预,发现有氧运动显著降低了大鼠体重和腹腔脂肪量并改善了血脂水平。除有氧运动外,抗阻运动在减控体重中的作用也逐渐被研究者关注。研究发现,抗阻运动可以显著减少代谢综合征的危险因素,如减轻体重、降低糖化血红蛋白和收缩压水平等[24]。本研究发现,大鼠经过8周的有氧运动或抗阻运动干预后,其体重均显著低于未经运动干预的对照组大鼠。杨星雅等[18]在研究中同样对大鼠进行了有氧运动或抗阻运动干预,发现有氧运动训练使大鼠的体重增量仅为对照组的52%;在抗阻运动干预下,大鼠体重增量也仅为对照组的70%。以上研究结果说明,无论是有氧运动还是抗阻运动训练,都能在一定程度上减少大鼠的体重增长幅度,其原因可能与能量消耗增加、脂肪堆积减少等因素有关。
van Marken Lichtenbelt等[25]在研究中发现,肥胖个体中的BAT总量偏少、活性降低,BAT活性与身体质量指数及体脂率成反比,较低的BAT活性可能是造成肥胖的内在机制之一。Dulloo等[26]在实验中将小鼠肩胛下的BAT切除后,机体WAT总量出现异常增加,进一步佐证了这种假设。以上研究结果提示,通过提高BAT总量及活性可促进机体的能量消耗,减少脂肪堆积。杨星雅等[18]在研究中发现,有氧运动干预可提高大鼠皮下WAT中锌指蛋白PRDM16(PR-domain-containing 16)、过氧化物酶体增生物激活受体γ(peroxisome proliferators-activated receptors γ,PPARγ)和过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferators-activated receptorsγ coactivator-1α,PGC-1α)等因子的表达,对白色脂肪棕色化有促进作用;同时,有氧运动还可以减小大鼠BAT细胞的脂滴面积,提高BAT的代谢活性,对其产热水平有一定的促进作用,进而减少脂肪堆积、减轻大鼠体重[27]。
BAT可由不同的前体细胞分化而来,其中,来源于间充质干细胞的Myf5+和Myf5-是形成BAT的两种重要前体细胞。Myf5+前体细胞既可以分化为BAT,也可以分化为肌细胞,PRDM16被证实是Myf5+前体细胞分化成为BAT的“开关”,它在BAT形成过程中起着正向调控作用,能促进BAT的形成[28]。BMP7是BAT形成的第二个“开关”,它除了能协同PRDM16促进Myf5+前体细胞向BAT分化以外,还可以直接诱导Myf5-前体细胞向BAT分化[29]。在调节脂肪生成方面,BMP主要通过Smad依赖途径和p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)信号通路发挥作用[30]。而在BAT生成方面,BMP7主要通过p38MAPK信号通路发挥作用。BMP7通过抑制早期脂肪生成抑制因子以及诱导BAT定向的关键因子(如PRDM16、PGC-1α)的表达,从而生成可以特异性表达UCP1和含有大量线粒体的BAT[31]。BMP7能通过p38MAPK和PGC-1依赖的信号通路完成整个BAT细胞分化程序,包括调控PRDM16和PGC-1α表达,提高BAT特异性蛋白UCP1、脂肪转录因子PPARγ、C/EBPs的表达和线粒体生物合成[32]。Tseng等[11]在研究中揭示了BMP7对于BAT生成的重要意义,他们在研究中利用敲除BMP7基因的小鼠为研究对象,经繁殖生产后,新生小鼠肩胛下BAT总量比野生型小鼠减少50%~70%,并且UCP1的蛋白表达水平显著降低,甚至无法检测到UCP1的表达。目前有关运动诱导BMP7进而调控脂肪分化的研究鲜有报道,本研究观察到,相对于对照组大鼠,8周有氧运动干预提高了大鼠WAT中BMP7的基因及蛋白表达,抗阻运动干预也提高了WAT中BMP7的蛋白表达。作为BAT形成过程中的重要“开关”,BMP7表达水平的上升可能在一定程度上促进了WAT向BAT的转化。
此外,本研究也发现有氧运动或抗阻运动干预均提高了大鼠BAT中BMP7及UCP1的基因表达,而UCP1是反映BAT产热能力的重要指标之一。在Rocha-Rodrigues等[33]研究中,分别对正常大鼠及高脂饲料喂养的肥胖大鼠进行了8周的有氧运动干预,结果发现,有氧运动减少了正常大鼠及肥胖大鼠的体重增长幅度;相对于正常对照组大鼠,有氧运动提高了正常大鼠米色和棕色脂肪组织中BMP7的基因及蛋白表达水平,同时也提高了UCP1的蛋白表达水平;相对于肥胖对照组大鼠,有氧运动也提高了肥胖大鼠米色和棕色脂肪BMP7的基因表达水平。但是,本研究并未观察到有氧运动干预对大鼠BAT中BMP7及UCP1的蛋白表达水平有显著影响,这可能与本研究中有氧运动的强度相对偏低有关。在本研究中,有氧运动训练采用的是跑步速度及时间每周递增的方案,其初始的速度较慢、时间较短,这与其它实验中维持相对恒定的跑速和运动时间的方案有所不同[33],较低的运动强度可能影响了BAT中BMP7和UCP1的蛋白表达水平。
综上所述,本研究中8周的有氧运动或抗阻运动干预都提高了WAT中BMP7的表达水平,这对白色脂肪棕色化的发生有潜在的促进作用;另外,这两种运动干预方式均促进了BAT中BMP7和UCP1的基因表达。龚文辉等[19]在研究中发现,有氧运动干预提高了肥胖大鼠BAT中BMP7及环氧合酶2的表达水平,同时有氧运动组大鼠的静息代谢率和非颤抖性产热水平均高于对照组,该研究认为有氧运动能够通过上调肥胖大鼠BMP7的表达,促进BAT产热,进而影响全身能量代谢。本研究也检测了大鼠在静息状态下的能量消耗水平,结果发现AE组和RE组大鼠的静息氧耗量及静息能量消耗水平均显著高于CON组大鼠,这说明两种运动干预方式均增强了大鼠的静息能量消耗水平,这也是AE组和RE组大鼠体重增长幅度显著低于CON组的原因之一,其作用机制可能与运动诱导了脂肪组织中BMP7的高表达有关。
另一方面,研究发现在大脑的不同区域中都有BMP配体的表达;其中,具有生物活性的BMP7已在脑脊液中发现[8],BMP7在大脑中的表达部位包括下丘脑和脉络丛。此外,在大脑中(包括下丘脑)也发现了不同类型的BMP受体,表明BMP信号可能参与下丘脑的一些调节功能[34]。下丘脑是调节食欲及能量摄入的主要部位[35],虽然BMP7在调控能量摄入方面的作用还未得到完全证实,但已有研究发现BMP7水平对食欲调节有显著影响。Townsend等[14]在研究中通过腺病毒向饮食诱导的肥胖小鼠转染BMP7后发现,实验组小鼠摄食量比正常小鼠减少30%,而氧耗量增加了10%;实验组小鼠体重明显降低,其中75%的体重减少量源于BMP7导致的摄食量减少,另25%则源于BMP7导致的能量消耗增加。但也有研究报道了相反的结果,Boon等[36]通过腹腔注射的方式向C57Bl/6J小鼠注入重组BMP7,共持续4周,结果发现小鼠的摄食量显著增加。以上研究结果不一致的原因可能有两个方面:一是实验中所作用的BMP7剂量不同,Townsend等的研究中腺病毒转染的BMP7剂量为每克体重2.5×1010个病毒颗粒[14],而Boon等通过腹腔注射的BMP7量为33 μg/kg/day或100 μg/kg/day[36];二是在持续性的实验过程中,伴随着BMP7导致的能量消耗增加,反过来可能增加了小鼠对能量的需求并刺激了对食物的摄入。
虽然现有研究的结果并不一致,但都揭示出BMP7在调节能量摄入方面有一定的作用。本研究观察到,经过8周有氧运动干预后,大鼠下丘脑组织中BMP7的基因和蛋白表达水平均显著高于CON组大鼠,并且血液循环中的BMP7水平也高于CON组和RE组,较高的BMP7水平可能通过下丘脑的食欲调节功能调控大鼠的摄食行为,而这种调节作用很可能就是通过经典的mTOR信号通路发挥作用的。在Townsend等[14]的研究中,利用ob/ob肥胖小鼠为研究对象,通过BMP7处理发现,肥胖小鼠的体重和摄食量均出现降低,说明BMP7可不依赖于瘦素发挥作用。该研究进一步通过在C57BL/6小鼠侧脑室注射重组BMP7后发现,小鼠摄食量减少了44.4%;Smad信号通路中Smad 1/5/8的磷酸化程度有所增强,mTOR信号通路下游因子p70S6K的磷酸化程度显著增加,并且该作用甚至先于Smad信号通路的激活。在本研究中,有氧运动干预引起的下丘脑BMP7高表达可能对大鼠的能量摄入有一定的调控作用。但是,本研究在实施过程中存在一定的局限性,未能监测大鼠在运动干预期间的饮食摄入情况,因此无法确定BMP7在下丘脑的高表达对大鼠摄食行为存在正向还是负向的调节作用,这也是需要后续研究进行探索和阐释的问题之一。
4 结论
8周有氧运动或抗阻运动干预均提高了大鼠静息能量消耗水平并减缓了体重增长幅度,这可能与运动诱导脂肪组织高表达BMP7进而促进了白色脂肪棕色化并提高了BAT产热水平有关。相对于抗阻运动,有氧运动提高了大鼠下丘脑组织中BMP7的表达水平,可能通过下丘脑影响了大鼠的摄食行为,但还需更多研究阐释BMP7在调节能量摄入中的作用及机制。
