血清同型半胱氨酸和胃蛋白酶原对早期胃癌的诊断价值
2020-01-01马艳萍,周英发,贾萌萌
胃癌的发生是一个从正常胃粘膜到慢性胃炎、慢性萎缩性胃炎、肠上皮化生再到异型增生、癌的连续发展过程,萎缩性胃炎、肠上皮化生及异型增生被认为是癌前病变[1]。早期胃癌定义为局限于粘膜及粘膜下层的胃癌,而无论有无淋巴结转移,早期胃癌术后生存率达90%[2],因而早期胃癌及癌前病变的筛查及诊断显得尤为重要。
同型半胱氨酸(homocysteine,Hcy)是一种含硫氨基酸,是氨基酸、甲硫氨酸、半胱氨酸生物合成中的中间产物[3],其在心血管疾病方面得到了广泛研究,近年来,研究发现血清同型半胱氨酸与恶性肿瘤密切相关[4,5]。有荟萃分析表明,血清同型半胱氨酸与胃癌发病风险之间存在因果关系[6]。胃蛋白酶原(pepsinogen,PG)是胃蛋白酶的无活性前体,血清中PG水平可反映胃黏膜组织的病变情况。血清PG作为初筛手段在胃癌筛查中的应用受到越来越多的关注[7]。本研究拟评估血清同型半胱氨酸及胃蛋白酶原对早期胃癌的诊断价值。
1 材料与方法
1.1 一般资料从2018年1月~2019年6月于我院行胃镜检查的门诊及住院患者中选取符合纳入标准的患者。纳入标准:①符合中华医学会《中国慢性胃炎共识意见》[8]胃黏膜病变的诊断标准;②由2名经验丰富的胃镜操作医师联合认证及组织病理学确诊;③入选前1周内无特殊用药史(包括质子泵抑制剂、H2受体拮抗剂等),胃癌患者术前未接受化疗等其他相关治疗;④无高血压、冠心病、心肌梗死、脑卒中等心脑血管病史;⑤无肝肾功能不全、甲状腺功能减退、糖尿病等;⑥未服用过抗癫痫药、利尿药等影响Hcy水平的药物。
按照以上纳入标准筛选出研究对象196例,其中男106例,女90例,年龄24~78岁,平均(50.98±11.83)岁。根据组织病理学检查结果将受检者分为5组:①对照组:胃粘膜正常或轻度非萎缩性胃炎45例(1组);②单纯萎缩性胃炎39例(2组);③慢性萎缩性胃炎伴肠上皮化生36例(3组);④异型增生41例(4组);⑤早期胃癌35例(5组)。
1.2 方法
1.2.1 血样标本采集和处理 所有研究对象均于组织病理结果确诊后、手术前采集空腹血(前一日晚22时起禁饮食),惰性分离胶促凝管采血5ml,3 000 r/min离心10min,留取血清待检测。
1.2.2 血清同型半胱氨酸检测 采用循环酶法测定血清Hcy浓度,检测仪器为罗氏C8000生化仪,测定试剂盒购于北京九强生物技术股份有限公司。具体检测步骤根据仪器及试剂说明书操作。
1.2.3 血清胃蛋白酶原测定 采集空腹静脉血,分离血清约5ml,用乳胶增强免疫比浊法定量测定血清PGⅠ、PGⅡ,计算PGR(PGⅠ/PGⅡ)。采用7600生化分析仪(日本日立公司),试剂盒购自北京世纪沃德生物有限公司,操作严格按照说明书进行。
1.3 统计学分析采用SPSS 23.0软件处理数据。以均数±标准差(±s)表示符合正态分布的计量资料;计数资料比较使用χ2检验,校正检验。多组数据比较采用单因素方差分析(ANOVA),对于方差分析结果有统计学意义的采用LSD法进行两两比较;组间率或构成比比较采用χ2检验。采用Spearman相关系数检验分析血清Hcy、PGⅠ、PGR水平与胃粘膜病变分期的相关性,以接受者操作特征曲线(receive operating characteristic curve,ROC曲线)计算Hcy、PGⅠ及PGR诊断早期胃癌的最佳临界值,并计算敏感度与特异度。P<0.05表示差异有统计学意义。
2 结果
2.1 各组间一般资料及相关指标比较5组患者年龄和性别分布差异无统计学意义。比较5组间的Hcy、PG水平发现,各组间Hcy、PGⅠ和PGR差异有统计学意义(P<0.001),且在胃粘膜癌变过程中,血清Hcy升高,PGⅠ和PGR下降。而PGⅡ在各组间差异无统计学意义(P>0.05),见表1。
和PGR水平与胃粘膜癌变程度的相关性分析 Hcy与胃粘膜癌变程度呈正相关(r=0.602),PGⅠ、PGR水平与胃粘膜癌变程度呈负相关(r=-0.745、-0.806),而 PGⅡ与胃粘膜癌变程度无明显相关性(P>0.05),见表2。
Hcy、PGⅠ和PGR作为筛选早期胃癌的指标,其AUC值分别为0.814、0.852和0.865,三者都具有较好的诊断价值。三者的最佳临界值及其对应的敏感度和特异度见表3,三者的ROC曲线见图1、2。Hcy联合PGR诊断早期胃癌的ROC曲线见图3,AUC为0.918,95%置信区间为(0.873,0.963)。
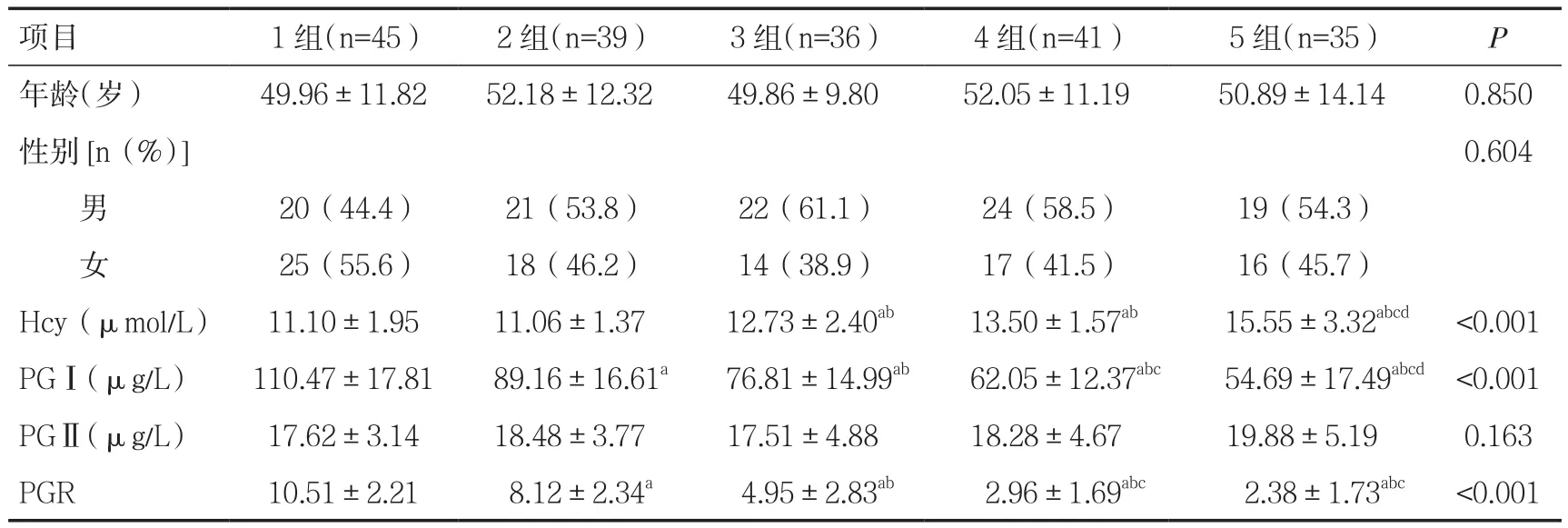
表1 各组间一般资料及Hcy、PGⅠ、PGⅡ和PGR检测值比较
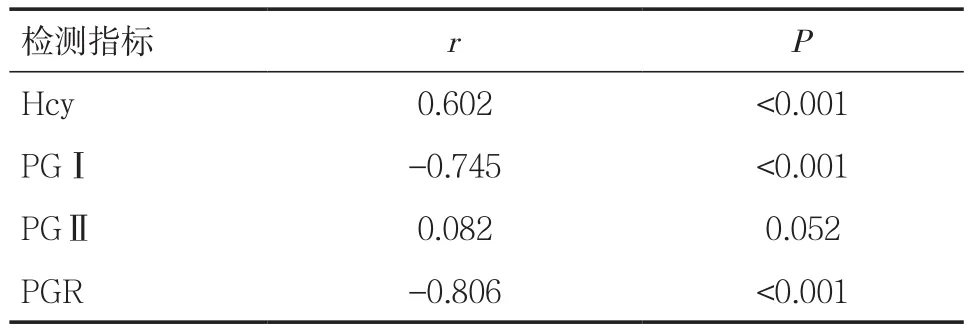
表2 Hcy、PGⅠ、PGⅡ及PGR与胃粘膜癌变程度相关性分析
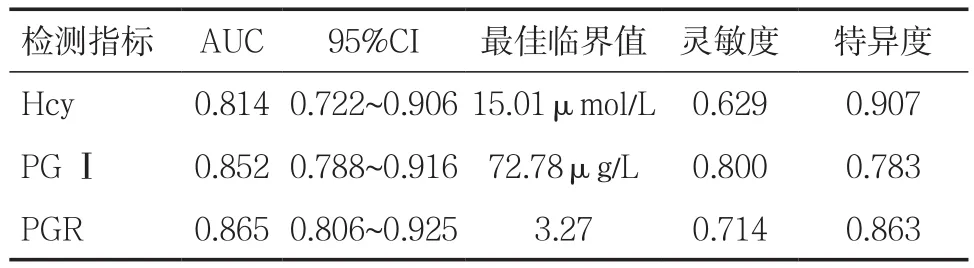
表3 Hcy、PGⅠ和PGR的ROC分析
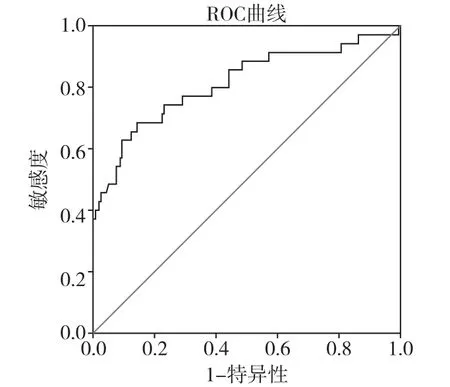
图1 Hcy诊断早期胃癌的ROC
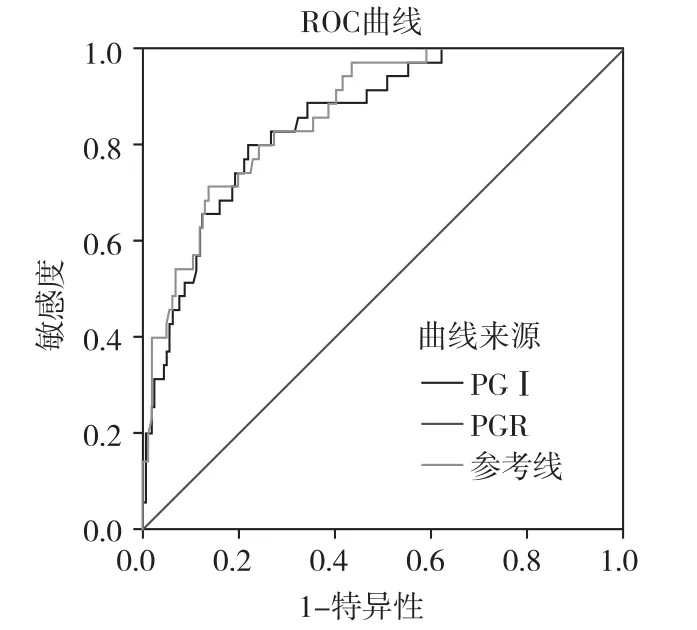
图2 PGⅠ和PGR诊断早期胃癌的ROC
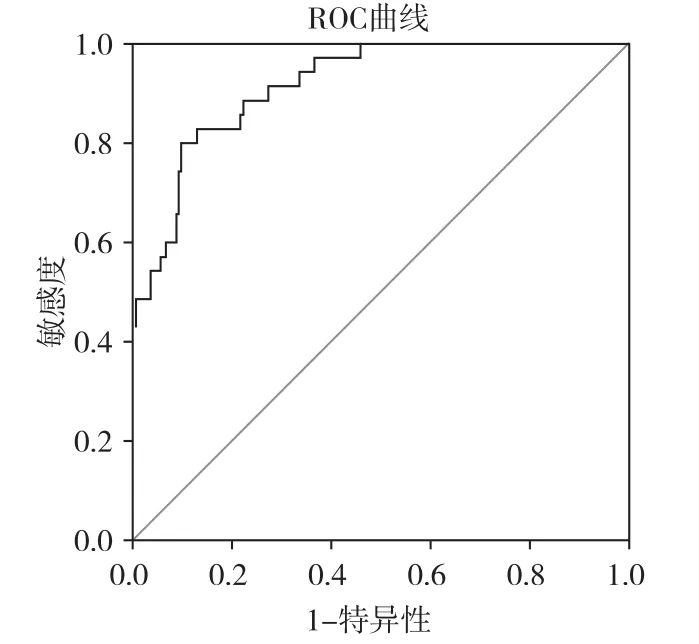
图3 Hcy联合PGR诊断早期胃癌的ROC
3 讨论
同型半胱氨酸(Hcy)被认为是卒中、冠状动脉疾病、缺血性心脏病等血管闭塞性疾病的潜在危险因素[9,10],进一步研究还发现,血浆Hcy水平升高是导致神经退行性变、糖尿病、唐氏综合征、神经管缺陷和巨幼细胞性贫血的关键因素之一[4]。近年来研究发现,Hcy可作为一种代谢性生物标志物用于癌变的诊断及预后评估[11]。Hcy是一种含硫氨基酸,它本身不能从食物中获得,也不用于合成蛋白质,只能从甲硫氨酸脱甲基化生成。Hcy的代谢途径主要有两条[12]:①再甲基化途径:由5-甲基四氢叶酸提供甲基,维生素B12和叶酸作为辅因子,在甲硫氨酸合成酶的催化下,Hcy再甲基化生成甲硫氨酸。5-甲基四氢叶酸是四氢叶酸在5,10-亚甲基四氢叶酸还原酶(MTHFR)的催化下生成的,在肝脏中存在可以提供甲基的甜菜碱,使Hcy再甲基化生成甲硫氨酸;②转硫途径:Hcy在胱硫醚合成酶(CBS)的作用下以维生素B6为辅因子转化成胱硫醚及半胱氨酸,最终分解为丙酮酸、硫酸和水。叶酸、VitB6、VitB12缺乏或CBS基因、MTHFR基因突变,均可导致Hcy代谢和清除障碍,引起高Hcy血症。研究发现这些变化可能与癌症发生有关。具体机制可能为:体内Hcy水平升高常伴有叶酸水平下降,而叶酸水平过低会干扰脱氧尿苷酸向胸苷酸的转化,导致大量尿嘧啶混入DNA,引起染色体的断裂破坏[13]。同时叶酸或甲硫氨酸不足,导致中间产物S-腺苷甲硫氨酸(SAM)生成减少,干扰体内的甲基化反应。DNA的低甲基化可激活癌基因,抑制抑癌基因表达,启动并加速肿瘤发展[14]。
在本研究中,随着胃粘膜病变程度的进展,Hcy水平逐渐增高,在早期胃癌组最高。朱向超[15]的研究将研究对象分为良性胃病组(包括胃炎组、胃溃疡组和胃息肉组)及胃癌组(分为Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期),得出Hcy与胃癌临床病理分期密切相关,可作为肿瘤标志物用于胃癌检测。本研究分析Hcy水平与胃粘膜病变程度的关系,结果显示在胃粘膜癌变过程中Hcy水平呈动态变化,因此可以考虑将Hcy作为诊断早期胃癌的一种血清标志物。
胃蛋白酶原(PG)根据生物活性及免疫活性的不同可分为PGⅠ、PGⅡ,二者的比值为PGR,PGⅠ主要由胃底腺的主细胞和颈粘液细胞分泌,PGⅡ除来源于上述细胞还来源于幽门腺及十二指肠腺[16]。本研究结果显示,在胃粘膜癌变过程中血清PGⅠ和PGR水平逐渐下降,而血清PGⅡ水平无明显变化。这是因为在胃粘膜萎缩病变时,胃底主细胞、颈粘液细胞减少,导致PGⅠ水平明显降低;而PGⅡ由多种细胞分泌,因此其水平无明显变化,血清PGⅠ和PGR水平降低提示胃黏膜萎缩甚至恶变[17],被认为是胃癌危险度及胃粘膜状态的标志物之一[18]。
相关性分析显示,血清Hcy、PGⅠ和PGR水平与胃粘膜病变严重程度有相关性,可以考虑将Hcy联合PG用于早期胃癌的筛查与诊断。为探讨血清Hcy、PG水平在早期胃癌及癌前病变筛查及诊断中的价值,本研究运用ROC分析Hcy、PGⅠ及PGR水平对早期胃癌的诊断价值,结果显示Hcy(AUC=0.814)、PGⅠ(AUC=0.852)、PGR(AUC=0.865)对早期胃癌诊断有较高的准确性,而血清Hcy联合PGR诊断早期胃癌的准确性更高(AUC=0.918)。
综上所述,在胃粘膜癌变过程中血清Hcy水平升高,PGⅠ及PGR水平下降。血清Hcy、PGⅠ及PGR水平与胃粘膜病变程度相关,三者可以用于早期胃癌的筛查,可提高早期胃癌的检出率。
