PD-L1 表达对术后接受氟尿嘧啶用药方案为基础辅助化疗的结直肠癌患者预后影响
2020-01-01张德志刘猛朱少功梅家转季节
张德志 刘猛 朱少功 梅家转 季节
结直肠癌(Colorectal cancer,CRC)是全球常见的恶性肿瘤之一[1]。美国2000~2003年发病率增加22%[2],上个世纪我国仍属于结直肠癌发病率较低的国家,但随着社会经济的发展、人民生活水平的提高和饮食结构的改变,近年我国结直肠癌发病率逐年上升,且发病年龄也呈年轻化的趋势[3]。结直肠癌的预防和治疗仍面临很大的挑战[4]。目前,手术和化疗是结直肠癌治疗的主要手段,IDEA研究表明低危的Ⅲ期结直肠癌患者使用3个月的卡培他滨联合奥沙利铂辅助化疗方案可明显获益[5]。相关研究也已证实氟尿嘧啶为主的辅助化疗方案可显著降低结直肠癌患者的术后复发风险[6]。然而,尚有很多影响该方案疗效的因素需要进一步探索。
近年肿瘤的免疫治疗已成为该领域的热点话题之一,程序性死亡因子1(programmed cell death 1,PD-1)及其配体程序性死亡蛋白配体1(programmed death-ligand 1,PD-L1,也称为B7-H1或 CD274)具有抑制免疫细胞的功能,两者广泛表达于活化的T细胞、B细胞、NK细胞、单核细胞及树突状细胞[7]。多种PD-1抑制剂,如派姆单抗、尼沃单抗正在被评估是否可以为消化道肿瘤患者带来临床获益。PD-L1作为近年来研究最热门的基因,成为目前免疫治疗药物重要的生物标志物之一[8]。PD-1和PD-L1的结合可导致肿瘤微环境中T细胞衰竭及发生免疫逃逸,促进肿瘤细胞生长[9]。
目前研究发现PD-L1在多种肿瘤细胞中呈现高表达[10]。且有研究表明,相对于癌旁正常组织,PD-L1在结直肠癌中高表达,而且相较于高分化状态和分期较早的肿瘤细胞,低分化和分期较晚的肿瘤细胞PD-L1表达水平显著增高,提示PD-L1的表达可能与结直肠癌进展和预后有关[11]。随着免疫治疗药物在我国上市,免疫治疗的疗效逐渐被公认。此外,PD-L1的表达目前已经明确基本可以作为免疫治疗药物的疗效预测因子。然而,PD-L1表达和术后接受氟尿嘧啶用药方案为基础辅助化疗的结直肠癌患者的预后关系尚不清楚。因此,本研究旨在探讨PD-L1表达对接受氟尿嘧啶用药方案为基础辅助化疗的结直肠癌患者预后的影响,为结直肠癌的早期诊断、免疫治疗及预后评估奠定基础。
1 材料与方法
1.1 一般资料本研究回顾性分析2012年1月~2018年12月在我院普外科接受手术切除治疗的结直肠癌患者。本研究入组患者年龄18~80岁,中位年龄49岁。男48例(53.93%),女41例(46.07%)。ECOG评分中0分患者69例(77.53%)。结肠癌和直肠癌分别45例和44例。肿瘤分化方面,分化较好、分化中等、分化较差患者分别为10例、69例和8例。肿瘤分期方面,其中Ⅱ期患者25例,Ⅲ期患者64例。接受氟尿嘧啶为基础辅助化疗患者27例,接受卡培他滨为基础辅助化疗患者62例。见表1。2015年以前患者以接受5-氟尿嘧啶为基础的辅助化疗,术后3~4周,第1天静脉滴注奥沙利铂85mg/m2超过2h,静脉滴注亚叶酸钙400mg/m2超过2h,静脉推注氟尿嘧啶400mg/m2,然后每天1 200mg/m2,共计两天持续静脉滴注,每2周为1个周期。2015年以后患者以接受卡培他滨为基础的辅助化疗,术后3~4周,口服卡培他滨,1000mg/m2,第1~14天2次/d,每21天为1个周期。奥沙利铂,80~130mg/m2,静脉滴注,第1天。辅助化疗结合患者情况给予6~8个周期治疗。本研究最后一次随访时间为2018年6月,所有患者从纳入研究到最后一次随访的中位随访时间为5.45年(0.60~7.50 年)。
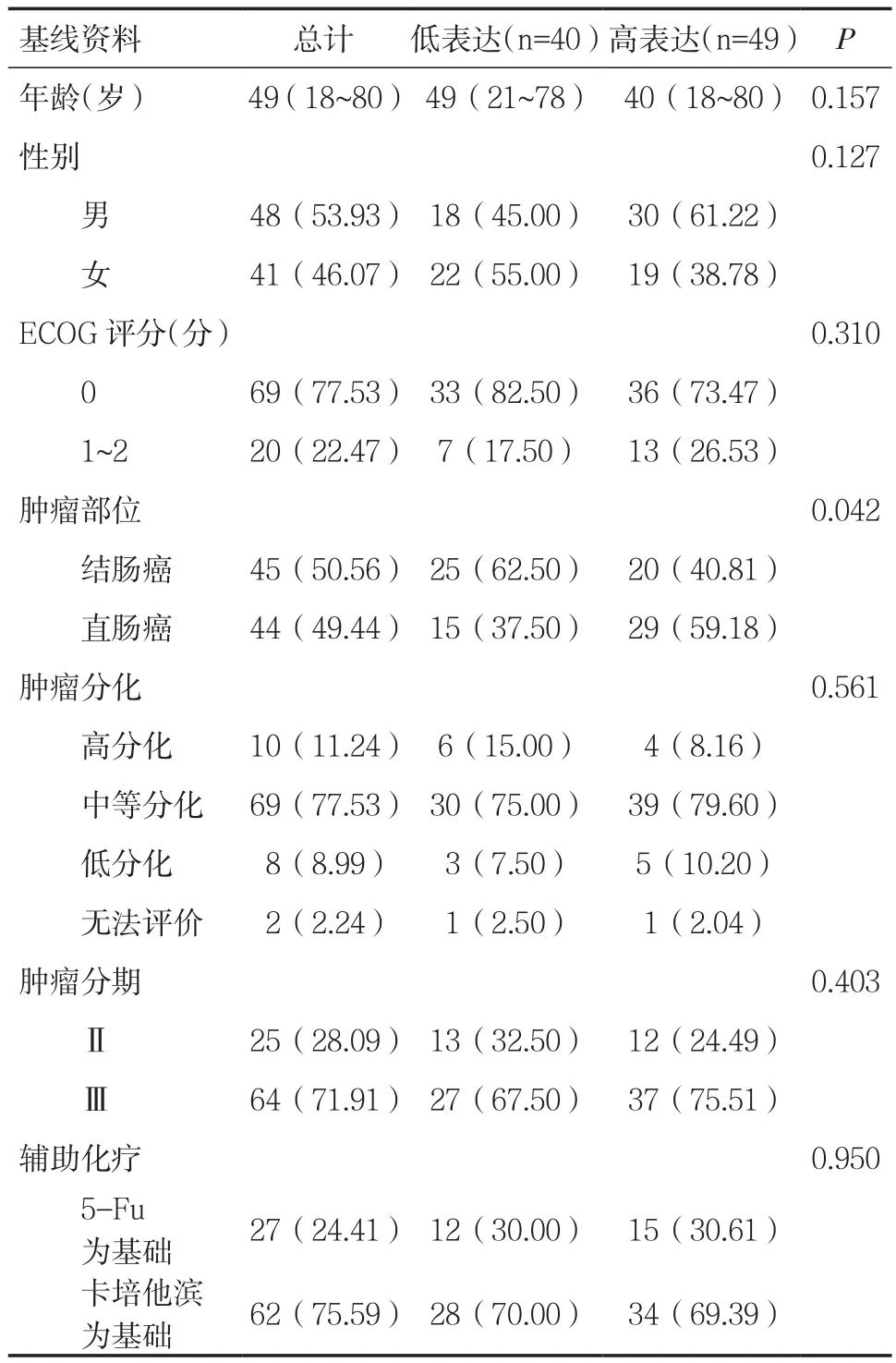
表1 肿瘤组织中PD-L1的表达情况[n(%)]
入选标准:①年龄18~80岁,ECOG评分0~2分者;②既往未接受过系统性治疗者;③主要器官功能在治疗前7天内符合标准者;④经病理确诊为结直肠癌患者;⑤预期生存期至少3个月者。排除标准:①未接受氟尿嘧啶为基础辅助化疗的患者;②遗传性结直肠癌综合征患者。本研究得到我院伦理委员会的批准。在治疗过程中依据NCI毒性分级进行相应的剂量调整,若出现Ⅳ级肾损害、神经毒性、心脏毒性、肝毒性等危及生命的不良反应,立即终止治疗。
1.2 免疫组织化学(ICH)法采用免疫组织化学SP法进行检测,按照SP试剂盒说明书进行操作,其中抗PD-L1(1∶100)4℃孵育过夜。鼠抗人PD-L1抗体购自美国Abcam公司;免疫组化SP-9000试剂盒购自北京中杉金桥生物科技有限公司。PD-L1的表达采用二级计分法,染色强度按颜色由浅入深依次为:0分(阴性),1分(弱阳性),2分(中度阳性),3分(强阳性);按阳性细胞占计数肿瘤细胞的百分比评分:1分(0~25%),2分(26%~50%),3分(51%~75%),4分(76%~100%)。两者计分相乘,低表达组为0~4分,高表达组为6~12分[12]。
1.3 统计学方法采用SPSS 19.0进行统计分析,绘制Kaplan-Meier曲线比较PD-L1低表达组和高表达组OS的差异。计数资料采用率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。总生存期(OS)的计算为从开始做手术的时间到患者因为各种原因出现死亡的日期或最后一次随访结束的日期。采用Cox风险比例模型对OS构建多因素分析,P<0.05为差异有统计学意义。
2 结果
影响OS的风险因素如年龄、性别、ECOG评分、病理分期以及PD-L1表达纳入该模型。Cox模型当中具有统计学差异的变量为ECOG评分(OR=2.85,P=0.006)、肿瘤分期(OR=3.11,P<0.001)和PD-L1表达(OR=1.77,P=0.010),见表2。
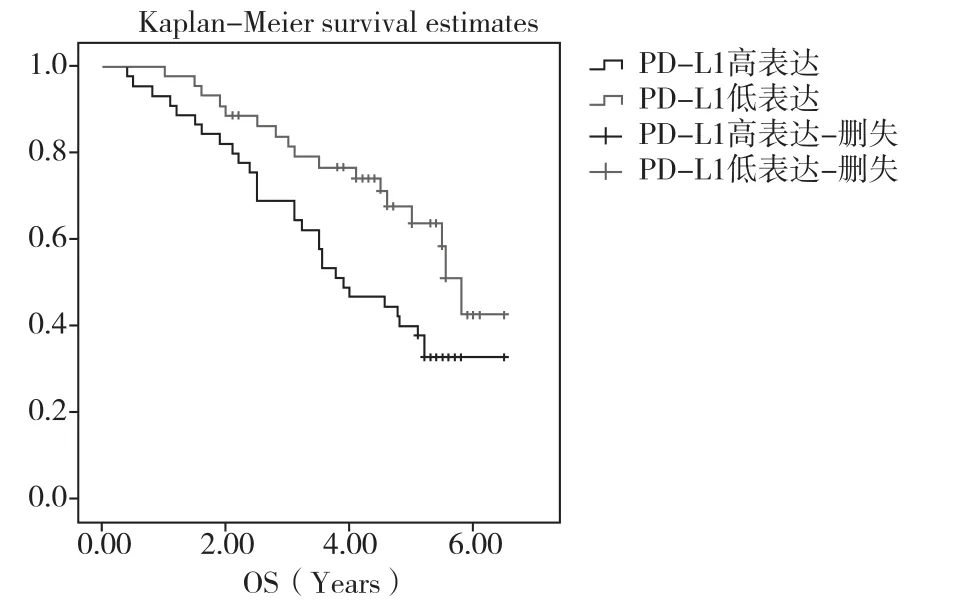
图1 不同PD-L1表达水平的总生存期曲线对比
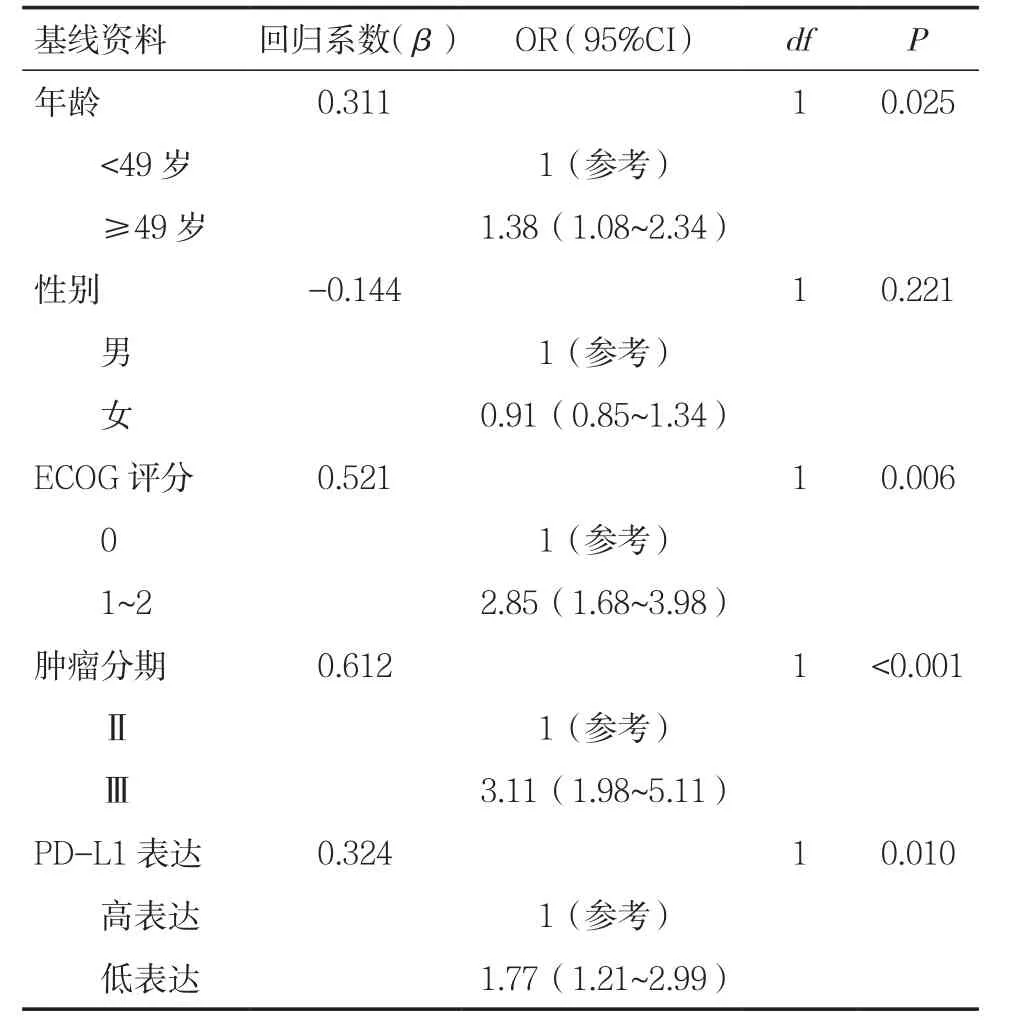
表2 对OS构建校正其他变量的多变量Cox风险比例模型
3 讨论
2.1 PD-L1在结直肠癌患者中的表达情况结直肠癌组织中PD-L1的表达较正常组织明显上调。
2.2 PD-L1表达对接受氟尿嘧啶为基础辅助化疗的结直肠癌患者预后的影响在总生存期(OS)方面,PD-L1高表达组和低表达组的中位总生存期(mOS)分别为3.90年和5.80年,具有显著的统计学差异(P=0.032),见图1。为了进一步校正其他混杂因素的影响,本研究构建了Cox风险比例模型,将可能
本研究共纳入89例术后接受氟尿嘧啶用药方案为基础辅助化疗的结直肠癌患者,研究发现结直肠癌组织中PD-L1的表达较正常组织明显上调,PD-L1低表达组的生存时间高于PD-L1高表达组,提示PD-L1高表达的结直肠癌患者倾向于较差的预后。Cox风险比例模型也证实了PD-L1是影响临床预后的独立预测因素。研究结果与李海青等[12]对PD-L1在结直肠癌的表达及预后研究分析结果具有一致性。结合以上内容可推断PD-L1可能参与了肿瘤细胞的免疫逃逸过程,促进了肿瘤细胞的侵袭和迁移,在一定程度上解释了PD-L1高表达会影响结直肠癌患者的预后。
多项研究表明PD-L1在结直肠癌中呈现高表达,但一项纳入454例CRC受试者的研究报道了只有12%的患者表达了PD-L1[13],可能与肿瘤细胞的分化状态有关。有学者对具有微卫星不稳定性和突变状态的结直肠癌进行PD-L1免疫组织化学检测,并将PD-L1的表达与临床预后相关联,研究结果表明PD-L1阳性不能作为生存率预测的指标,微卫星不稳定性较高的患者与较低的生存率有相关性,研究结果解释了PD-1或PD-L1抑制剂对微卫星不稳定性结直肠癌患者的作用机制,并提出PD-L1可能会作为结直肠癌患者的潜在预测及预后指标之一[14]。以上研究提示了PD-L1的表达与结直肠癌患者的预后关系尚不清楚。本研究探索了术后接受氟尿嘧啶用药方案为基础辅助化疗的结直肠癌患者PD-L1表达与预后的关系,但缺少了进一步深入探讨PD-L1在结直肠癌患者中的表达与微卫星不稳定性之间的关系,在后期研究中可做深入探索。
本研究结果表明肿瘤发病部位可能与PD-L1的表达具有相关性,与李甜甜[15]研究结果一致,结肠和直肠由于胚胎生长来源的不同周围淋巴结数目也不同,结肠淋巴结数目要多于直肠,因此PD-L1表达在不同发病部位具有差异性。Cox风险比例模型中影响总生存OS的因素除了PD-L1表达外,还有ECOG评分和肿瘤分期,通常ECOG评分越高,患者预后越差,Ⅲ期患者的OS生存时间要低于Ⅱ期患者。本研究中27例患者氟尿嘧啶用药方案以5-氟尿嘧啶为主,62例患者氟尿嘧啶用药方案以卡培他滨为主,有报道5-氟尿嘧啶与卡培他滨两种给药方式存在差异,两者疗效无差异[16]。有报道在晚期结直肠癌研究中,奥沙利铂联合氟尿嘧啶类药物时,患者可选择使用5-氟尿嘧啶或卡培他滨或替吉奥胶囊[17]。
综上所述,术后接受氟尿嘧啶为基础辅助化疗的结直肠癌患者肿瘤细胞中PD-L1的表达明显高于正常组织,PD-L1高表达患者生存时间短,并提示PD-L1可能会成为术后接受氟尿嘧啶为基础辅助化疗的结直肠癌患者预后的重要预测指标之一。此项研究属于回顾性研究,观察的样本量有限,检测方法单一,存在一定的局限性,但本研究为后续关于PD-L1的表达对术后接受氟尿嘧啶为基础辅助化疗的结直肠癌患者预后影响的相关研究提供了一定的参考价值。
