多基因阵列表达谱检测在乳腺癌中的应用
2020-01-01陈小松沈坤炜
陈小松,沈坤炜
(上海交通大学医学院附属瑞金医院外科 乳腺疾病诊治中心,上海 200025)
早期诊断和辅助治疗可显著提高乳腺癌病人的预后。乳腺癌辅助治疗方案的制定,既往大多依据病人的复发风险和治疗反应。常规临床病理指标包括肿瘤大小、淋巴结转移数和组织学分级,可反映疾病负荷,预测病人预后。关于治疗的反应性,既往主要依据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)的表达情况来判别。ER或PR阳性病人需行内分泌治疗;HER2+病人需考虑抗HER2靶向治疗;而对于三阴型乳腺癌病人,则需化疗。由于乳腺癌存在异质性,上述临床病理指标对乳腺癌病人预后和疗效的预测存在不足,故需进一步寻找有效指标,指导乳腺癌个体化辅助治疗。随着人类基因组计划的完成和基因芯片的应用,可采用多基因阵列表达谱将乳腺癌病人进一步分型,指导制定个体化辅助治疗方案。本文就目前临床应用的乳腺癌多基因阵列表达谱,结合临床诊疗进展,评述其在乳腺癌个体化治疗中的作用。
乳腺癌多基因阵列表达谱概述
乳腺癌多基因阵列表达谱包括乳腺癌固有分子分型、21基因复发分数(recurrence score,RS)、70基因预后分型、乳腺癌指数(breast cancer index,BCI)、整合临床病理指标的EPclin和PAM50 ROR,以及针对三阴型乳腺癌的三阴型分子分型(见表1)[1]。2000年,Perou等[2]最早报道乳腺癌的固有分子分型,其分为Luminal A、Luminal B、HER2-E、Basal-like及Normal-like 5个类型,具有不同的预后和生物学特征。临床可根据乳腺癌ER、PR、HER2及Ki67的表达水平,行乳腺癌固有分子分型。21基因RS是美国FDA最早批准用于临床检测和应用的乳腺癌多基因阵列表达谱,可采用10%甲醛包埋标本进行检测[3]。笔者单位从2014年常规开展21基因RS检测应用至今,目前已累计超过2 000例病人,可预测ER+/HER2-、淋巴结阴性病人的预后,并减少约5%Luminal B型乳腺癌病人辅助化疗的应用。70基因预后分型可预测病人预后。最初使用新鲜标本检测,限制其临床应用,技术改进后,可在10%甲醛包埋标本进行检测,促进临床推广[4]。EPclin[5]和PAM50 ROR[6]均是多基因阵列表达谱整合临床病理指标。回顾性数据显示,多基因较单一指标更好地预测预后,但目前尚缺乏高等级循证医学证据证实其对化疗效果的预测,临床应用较少[5-6]。
21基因RS在ER+/HER2-乳腺癌中的应用
ER+/HER2-乳腺癌存在较大的异质性,在内分泌治疗基础上是否需化疗有争议。21基因RS通过在NSABP B14临床研究进行检测和验证,分为低、中、高危3组,预测病人10年的远处转移发生率分别为6.8%、14.3%和30.5%[3]。NSABP B20临床研究进一步评估21基因RS对化疗疗效的预测价值:辅助化疗可降低高危组病人27.6%远处转移率;而对于低危组的病人,辅助化疗不提高其预后,提示可豁免化疗[7]。前瞻性TAILORx临床研究针对ER+/HER2-、淋巴结阴性的乳腺癌病人。根据21基因RS结果,病人划分为低危(<11分)、中危(11~25分)和高危(>25分)3组,共10 273例病人。对于低危病人,单独接受内分泌治疗;中危组病人在内分泌治疗基础上,随机接受化疗或不化疗;而高危组病人接受内分泌治疗+化疗。中位5年随访结果显示,低危组单独内分泌治疗乳腺癌病人,其5年无远处转移生存率(distant metastasis free survival,DMFS)为99.3%,提示其无需化疗[8]。进一步随访显示,中危组病人单独内分泌治疗和内分泌+化疗的9年DMFS分别为94.5%和95%,提示辅助化疗不改善病人预后。亚组分析发现,年龄、RS分值与辅助化疗获益存在交互作用:年龄>50岁组中,辅助化疗不改善病人预后;但年龄≤50岁且RS>15分的病人,辅助化疗可提高9年6%~9%的绝对无浸润癌生存率[9]。之后该研究评估临床风险和21基因RS是否能预测预后和化疗疗效(见表2)。发现临床危险度分类可预测各RS组病人的预后。临床高危组病人预后差;在中危RS组人群中,临床危险度不能预测化疗疗效;对于年龄≤50岁、RS 16~20且临床低危的病人,辅助化疗不提高DMFS,余结论类似9年随访结果[10]。

表1 乳腺癌多基因阵列表达谱
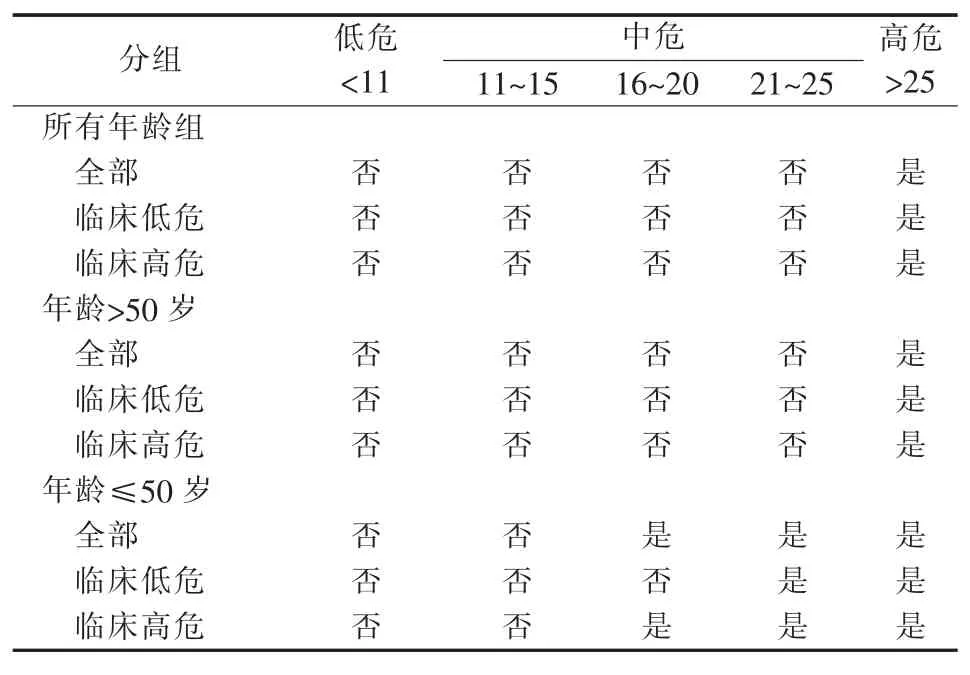
表2 TAILORx临床研究结果概括:21基因RS和化疗获益之间的关系
基于TAILORx的结果,NCCN和ASCO指南均更新了对于ER+/HER2-乳腺癌病人的临床诊疗路径。除T1a和部分T1b病人外,都推荐ER+/HER2-、淋巴结阴性病人行21基因RS检测,并依据其结果,指导是否需辅助化疗。但笔者认为尚不能仅凭21基因RS结果,就决定临床是否需化疗。对于21基因RS为26~30的病人,是否可根据TAILORx临床研究均给予辅助化疗,尤其是年龄>50岁的病人,尚存较多争议。另外,老年乳腺癌病人是否可根据21基因RS结果进行临床辅助化疗决策,尚缺依据。在黏液癌、浸润性小叶癌和小管癌等特殊类型乳腺癌病人中,21基因RS对预后和化疗疗效的预测价值,是否等同于浸润性导管癌病人,目前尚无临床研究支持。最后,在TAILORx临床研究的中危组病人中,年龄<50岁且RS 16~25分者,辅助化疗获益是否来自化疗诱导的闭经作用?如果是,则临床应用卵巢功能抑制是否可起到类似化疗的作用,从而进一步降低化疗比例,尚待临床研究验证[10]。
在ER+/HER2-、淋巴结阴性乳腺癌病人中,21基因RS目前有Ⅰ类证据支持临床应用。但对于淋巴结阳性的病人,21基因RS是否可预测预后和化疗获益?SWOG 8814试验入组绝经后淋巴结阳性的乳腺癌病人,发现21基因RS低危病人在他莫昔芬治疗基础上,环磷酰胺+多柔比星+氟尿嘧啶(cyclophosphamide+adriamycin+fluorouracil,CAF)辅助化疗不提高病人预后。但该研究入组病人数较少(低危组146例),使用的是CAF方案,低危组病人亦有30%以上的复发率,故不能根据该结果指导临床实践[11]。PlanB研究入组ER+/HER2-、N1病人。RS≤11的病人未行辅助化疗,3年无病生存率高达97.9%,提示对该部分人群可豁免化疗[12]。该结果尚待RxPONDER临床研究证实。在RxPONDER研究结果公布之前,尚不能推荐所有ER+/HER2-、N1病人行21基因RS检测。在笔者单位,对于ER+/HER2-、N1但已绝经的乳腺癌病人,推荐行21基因RS检测,根据检测结果行多学科讨论,决定辅助治疗方案。
70基因预后分型在乳腺癌中的应用
70基因预后分型(MammaPrint)可将乳腺癌病人分为预后好和预后差信号组,比常规临床病理指标能更好预测预后。前瞻性MINDACT临床研究评估MammaPrint对化疗疗效的预测价值。根据临床风险(C)和MammaPrint(G)结果,将病人分为:G/C均高危(1 806例)、G高危/C低危(592例)、G低危/C高危(1 550例)和G/C均低危(2 745例)。在该研究中,G/C均高危的病人,推荐化疗;对G/C均低危的病人,则无需化疗;在G和C危险度不符的病人中,随机接受化疗或不化疗,G高危/C低危和G低危/C高危两组病人5年DMFS分别为94.8%和95.1%,提示辅助化疗不改善病人的预后。同时,对G低危/C高危未接受辅助化疗的人群分析发现,其5年DMFS为94.7%,高于原先统计学设定的92%,提示MammaPrint能更好划分临床高危病人,可使46%临床高危病人豁免化疗[13]。MINDACT研究入组了部分N1、三阴型和HER2+的病人,但ER-病人只有5%为G低危,88%三阴型病人为G和C均高危。同时,对于淋巴结2~3枚转移病人是否可与1枚转移具有相似的预测价值尚存争议。故在临床上,MammaPrint主要应用于ER+/HER2-、N阴性或1枚转移的乳腺癌病人,三阴型或HER2+病人尚不推荐[14]。
多基因阵列表达谱与ER+病人延长内分泌治疗
ER+乳腺癌病人在5年内分泌治疗后,存在10%~40%的远期复发风险。延长内分泌治疗可降低ER+病人的远期复发风险,但绝对获益较小。需寻找有效指标预测其远期复发风险,从而为高危的病人选择延长内分泌治疗。EBCTCG荟萃分析显示,常规的临床病理指标(T、N、组织学分级和Ki67)可预测远期复发风险。多基因阵列表达谱是否可更好预测远期复发风险[15]?Ma等[16]采用HXOB13/IL17BR比值,构建乳腺癌指数(breast cancer index,BCI),将病人分为低、中和高危组,并与乳腺癌病人远期复发风险相关。在TransATAC临床研究中,发现BCI较21基因RS以及IHC4能更好地预测ER+乳腺癌病人的远期复发风险,提示BCI可指导后续强化内分泌治疗方案的选择[17]。除BCI外,EPclin以及ROR等多基因阵列表达谱也可预测远期复发风险,在TransATAC的再次研究中发现,BCI、EPclin和ROR(C-index分别为0.75、0.77和0.79)多基因阵列表达谱较CTS、IHC4以及21基因RS能更好地预测ER+、淋巴结阴性乳腺癌病人的远期复发风险;但在淋巴结阳性病人中,其预测效能较低(C-index均<0.70),提示在ER+、淋巴结阴性病人中,多基因阵列可帮助挑选合适的高危人群接受强化内分泌治疗,增加强化内分泌治疗的临床获益率[18]。
多基因阵列表达谱与HER2+乳腺癌预后和疗效预测
HER2+乳腺癌曲妥珠单抗辅助治疗可显著降低复发和死亡风险,但其绝对获益率为6%~12%,需寻找HER2外能预测其疗效的分子标志物,从而有助于更合理地选择抗HER2靶向药物。CALGB 40601研究显示,HER2-富集型(HER2-enrichment,HER2-E)组病人接受紫杉醇联合曲妥珠单抗/拉帕替尼新辅助治疗的病理完全缓解(pathologic complete response,pCR)率达70%,显著高于Luminal A型的34%和Luminal B型的36%[19]。在曲妥珠单抗辅助治疗临床研究中,NCCTG 9831临床研究亚组分析发现,HER2-E病人可更多地从曲妥珠单抗治疗中获益,但Basal-like型病人获益较少[20]。分子分型是否与曲妥珠单抗疗效相关,需待HERA、NSABP B31等曲妥珠单抗辅助治疗临床研究证实。
HER2+早期乳腺癌病人在曲妥珠单抗治疗基础上,联合帕妥珠单抗可进一步降低疾病复发风险,但其绝对获益率低[21]。FDA批准帕妥珠单抗可用于HR-或淋巴结阳性等高危HER2+乳腺癌病人的辅助治疗,是否还有其他指标预测病人的治疗获益?2019年ASCO公布的APHINITY临床研究分子标志物分析发现,Basal-like型较Luminal A型病人预后差,但不能预测帕妥珠单抗治疗获益。针对T细胞免疫信号通路的分析发现,3基因免疫信号可预测HER2+病人预后,但亦不能预测帕妥珠单抗疗效[22]。故需寻找其他分子标志物,如肿瘤浸润淋巴结细胞,并整合临床病理指标、基因突变、HER2拷贝数和基因表达谱模型,帮助临床筛选高危人群,提高抗HER2靶向药物的疗效。
三阴型乳腺癌的多基因阵列表达谱
三阴型乳腺癌病人存在异质性。新辅助治疗后达到pCR的病人,预后与非三阴型乳腺癌相似,但未达到pCR病人,预后显著差于非三阴型乳腺癌病人;腺样囊腺癌、髓样癌等特殊类型乳腺癌,常不表达ER、PR和HER2,但其预后较好。Lehmann等[23]整合21个基因表达谱数据库中的587例三阴型乳腺癌病人行聚类分析发现,三阴型乳腺癌包含Basal-like 1型、Basal-like 2型、Luminal雄激素受体型、间质干细胞型、间质型以及免疫调节型。在体外对治疗反应不尽相同:Basal-like型对铂类药物敏感;而间质干细胞型对PI3K信号通路抑制剂较敏感;雄激素受体抑制剂对Luminal雄激素受体型病人有效。在此基础上,根据基因表达谱的不同,可将三阴型乳腺癌分为不同的4~5型,指导后续临床研究设计和开展[24]。但上述三阴型分子分型在早期乳腺癌病人中,缺乏前瞻性临床研究,评估其对预后及疗效的预测作用,目前仅处于研究阶段。
多基因阵列表达谱检测有助于更好了解乳腺癌异质性,预测病人的预后和疗效,推动乳腺癌个体化治疗的进展。21基因RS和MammaPrint已批准在ER+/HER2-、淋巴结阴性乳腺癌病人中应用,但针对HER2+和三阴型乳腺癌,尚缺有效多基因阵列表达谱指导临床诊治。可整合相关多基因阵列表达谱、基因突变指标、免疫和临床病理等相关指标,提高预后和疗效预测的准确性,从而实现乳腺癌的个体化治疗。
