壳寡糖与干酪乳杆菌对断奶仔猪生长性能、血清抗氧化酶活性及肠道微生物菌群结构的影响
2019-12-31刘媛媛解林奇陈浩天宋维平
刘媛媛 解林奇 吴 栋 李 康 陈浩天 宋维平 闫 雪*
(1.北京大北农科技集团股份有限公司饲用微生物工程国家重点实验室,北京100192;2.山东卫康生物医药科技有限公司,山东临沂276016;3.沈阳科技学院,辽宁沈阳110167)
2017 年6 月22 日,农业部印发了《全国遏制动物源细菌耐药行动计划(2017-2020年)》提出,推进兽用抗生素药物减量化使用,在2020年底以前,将退出所有促生长类抗菌药物添加剂品种,饲料端“禁抗”,养殖端减抗、降抗为必然!幼龄动物是抗生素使用量最多的阶段,饲用抗生素作为生长促进剂对缓解仔猪早期断奶应激具有良好的作用效果,因此寻找有效的饲用抗生素替代品成为当前研究热点。目前饲用抗生素替代品主要包括微生态制剂、低聚糖、酶制剂、植物提取物等[1]。乳杆菌可以黏附、定植于动物肠黏膜表面,对宿主肠道黏膜免疫系统具有调控作用,进而改善仔猪肠道健康[2]。壳寡糖是由2~10个氨基葡萄糖通过β-1,4-糖苷键连接而成的寡糖,水溶性好,可提高断奶仔猪生长性能,提高血清抗氧化指标,增加有益菌数量[3]。但目前尚未有关于饲料中共同添加壳寡糖和乳杆菌对断奶仔猪应用效果的研究报道,本试验通过研究壳寡糖和干酪乳杆菌对断奶仔猪生长性能、血清中抗氧化酶活性以及肠道微生物菌群结构的影响,旨在为益生菌与益生元在畜禽饲料中科学配伍使用提供理论支持。
1 材料与方法
1.1 试验材料
壳寡糖由山东卫康生物医药科技有限公司提供,聚合度为2~10,相对分子量≤2 000 Da,脱乙酰度90%,纯度80%。干酪乳杆菌(Lactobacillus casei)粉剂由北京大北农科技集团股份有限公司饲用微生物工程国家重点实验室提供,粉剂活菌含量为1×1011CFU/g,制备成活菌含量为1×1010CFU/kg,备用。
1.2 试验动物与日粮
试验动物选用“杜×长×大”三元杂交断奶仔猪,基础日粮配方及营养水平见表1。
1.3 试验设计与饲养管理
试验在唐山大北农猪育种科技有限责任公司动物试验场进行,采用312头30日龄体重为(7.06±0.02) kg杜×长×大三元杂交断奶仔猪,根据“体重相近、公母各半”的原则随机分成4个处理,每个处理设置6个重复,每个重复13头猪。分组情况为:饲喂玉米-豆粕型基础日粮的对照组(A)、每千克饲料添加0.5 g壳寡糖的试验组(B)、每千克饲料添加1010CFU 干酪乳杆菌的试验组(C)以及同时添加壳寡糖与干酪乳杆菌的试验组(D),见表2。猪只自由采食和饮水,试验进行32 d。

表1 基础日粮配方与营养水平[4]

表2 不同添加剂试验分组
1.4 样品采集与检测
1.4.1 生长性能的测定
试验第0 d、第14 d 和第32 d 分别对猪进行空腹称重,试验期间准确记录每天采食量,计算平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G),并统计腹泻率。
1.4.2 血清抗氧化酶活性测定
试验中期第14 d 和结束时(第32 d),采集猪前腔静脉血液,分离血清,于-80 ℃冷冻保存。采用南京建成生物科技有限公司试剂盒检测血清中相关抗氧化酶活性,如总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等。
1.4.3 粪便微生物的测定
采集第0、14 d 和第32 d 断奶仔猪粪便,使用天根生化科技(北京)有限公司粪便基因组DNA 提取试剂盒,提取基因组DNA,-20 ℃保存待测。结合变性梯度凝胶电泳(DGGE)与16S rDNA测序技术,分析断奶仔猪粪便微生物种群结构与多样性。试验操作参照曾燕等[5]方法,图谱分析采用Quantity One(Bio-Rad)凝胶定量软件。测序结果使用BLAST 在GenBank 数据库中进行相似性分析。
1.5 数据统计分析
数据采用SAS 软件8.0 版GLM 程序进行统计分析,多重比较采用邓肯氏法(Duncan's 法),以P<0.05为显著水平,P<0.01为差异极显著。
2 结果与分析
2.1 壳寡糖与干酪乳杆菌对断奶仔猪生长性能的影响(见表3)
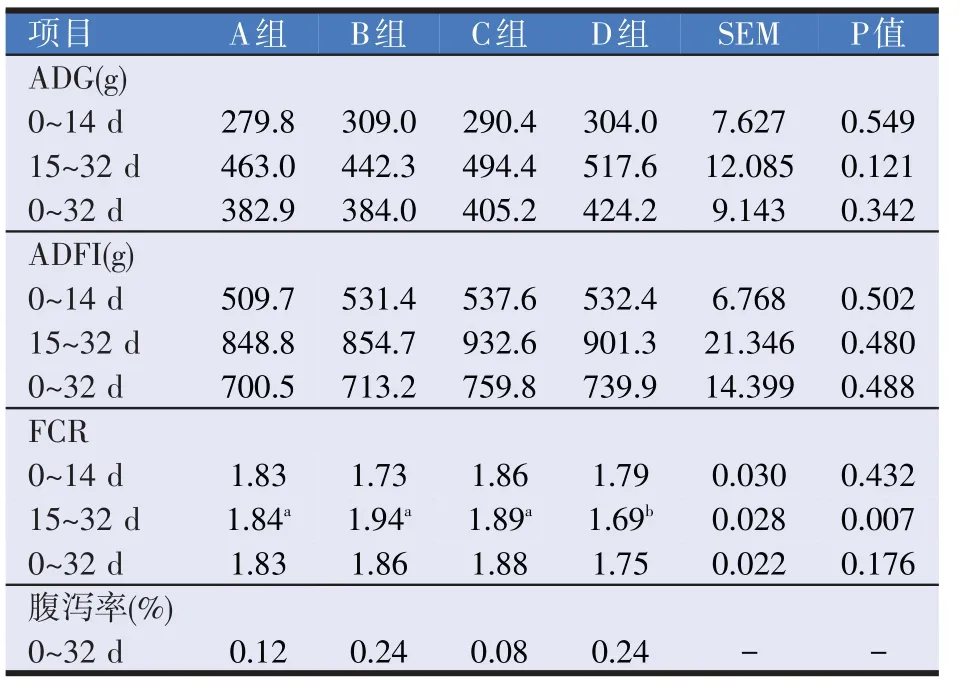
表3 壳寡糖与干酪乳杆菌对断奶仔猪生长性能的影响
2.2 壳寡糖与干酪乳杆菌对断奶仔猪血清抗氧化酶活性的影响(见表4)
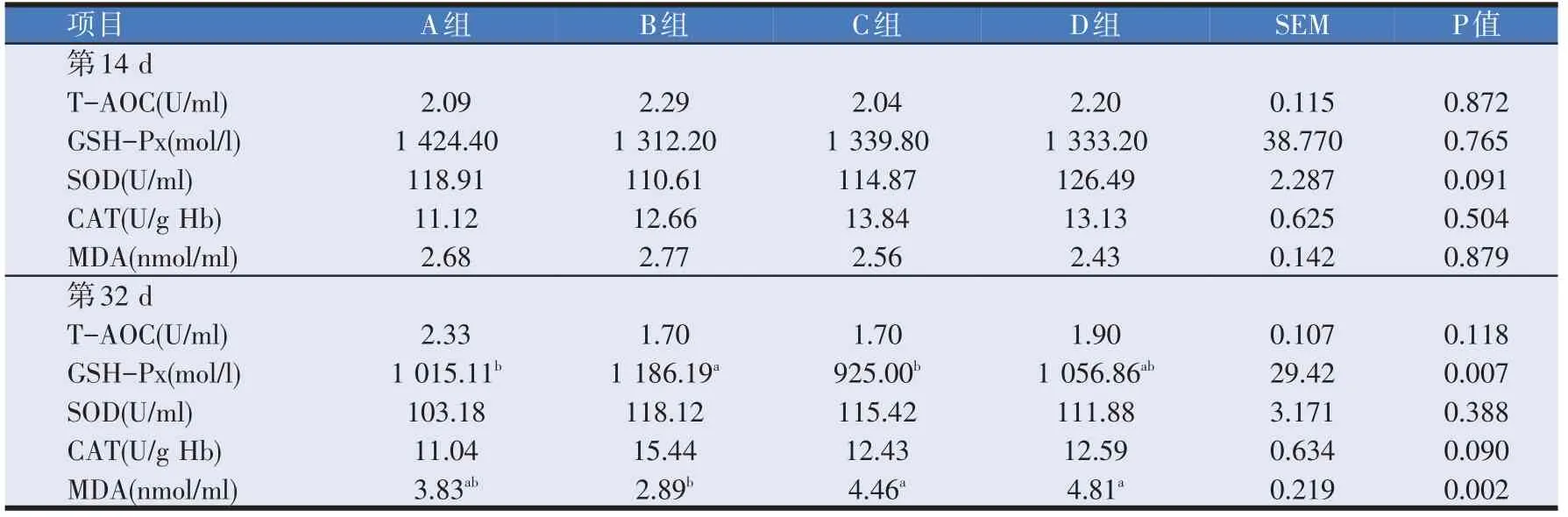
表4 壳寡糖与干酪乳杆菌对断奶仔猪血清中抗氧化酶活性的影响
由表4可知,与A组相比,在第14 d阶段B组有提高血清中总抗氧化能力(T-AOC)与过氧化氢酶(CAT)活力的微弱趋势,但同时也使血清中丙二醛(MDA)含量稍有升高;C组有增加血清中过氧化氢酶(CAT)活力并降低丙二醛(MDA)含量的趋势;D 组则同时提高了血清中总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力,且降低丙二醛(MDA)含量;但是各组差异均不显著(P>0.05)。与A组相比,第32 d阶段,B组显著提高了谷胱甘肽过氧化物酶(GSH-Px)的活力(P<0.05),并降低丙二醛(MDA)的含量(P>0.05);B、C、D组均提高了血清中超氧化物歧化酶(SOD)与过氧化氢酶(CAT)的活力,但差异不显著(P>0.05);C、D 组使丙二醛(MDA)含量稍有升高,但差异不显著(P>0.05)。
2.3 壳寡糖与干酪乳杆菌对断奶仔猪粪便微生物多样性的影响
2.3.1 饲喂壳寡糖与干酪乳杆菌14 d 断奶仔猪的粪便DGGE检测结果
通过标记条带测序结果分析可见,仔猪饲喂各组产品14 d后44日龄仔猪粪便中的1号弗林氏丁酸杆菌(Flintibacter butyricus)菌属的某些菌株在C、D组中较A、B组明显增多;2号卷曲乳杆菌(Lactobacillus crispatusDSM 20584)菌属中的某些菌株在D组中较其他组明显增多(图1、表5)。图谱聚类分析与样品相似度结果显示:仔猪饲喂各组日粮14 d后44日龄仔猪粪便微生物的聚类现象明显,说明各组日粮在断奶仔猪前期对仔猪粪便的微生物组成有明显影响(图2、图3)。

图1 试验14 d各组仔猪的粪便DGGE图谱

表5 试验14 d各组断奶仔猪粪便DGGE图谱中标记条带测序结果

图2 试验14 d各组仔猪粪便DGGE图谱聚类分析结果
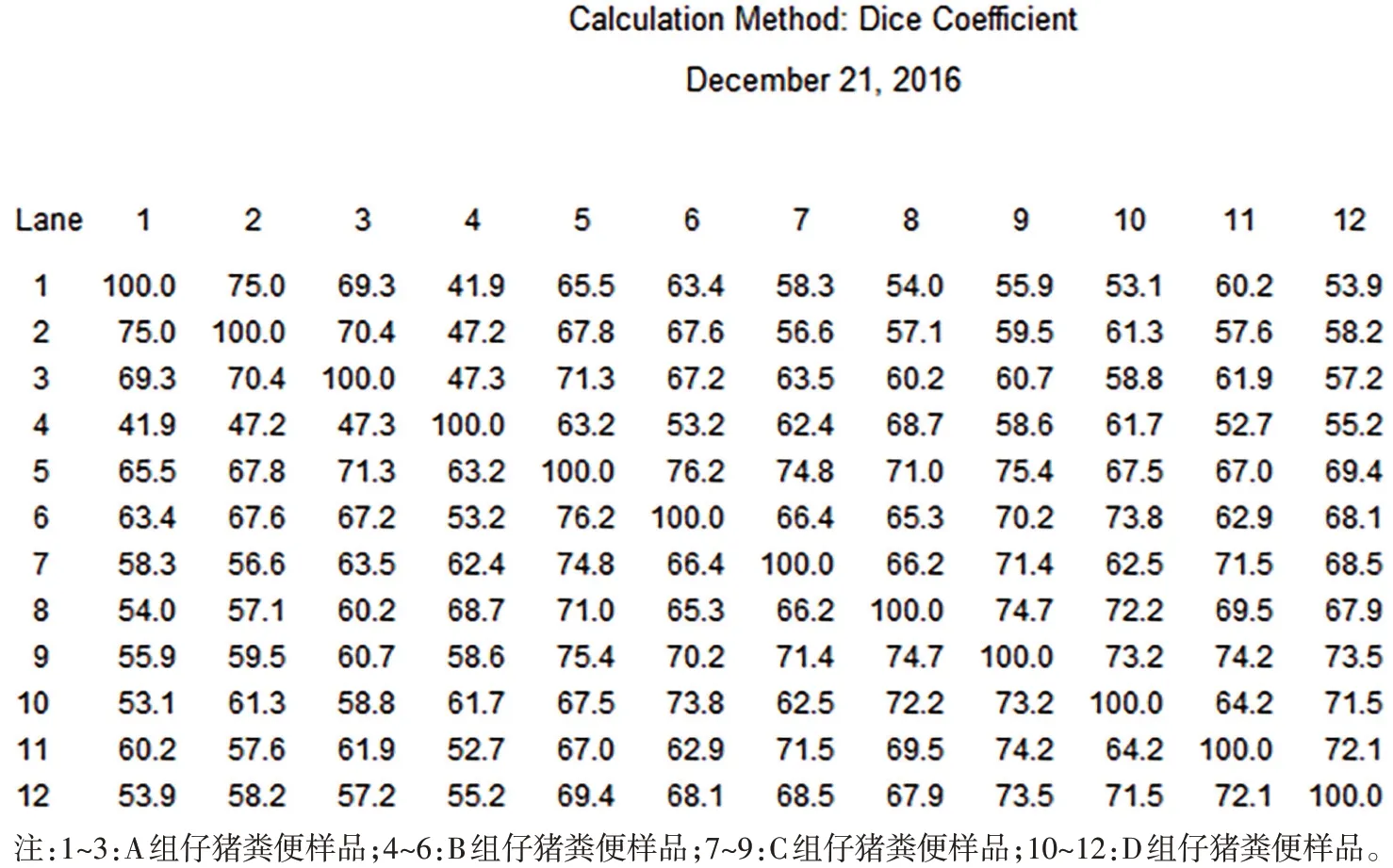
图3 试验14 d各组仔猪粪便DGGE图谱样品相似度结果
2.3.2 饲喂壳寡糖与干酪乳杆菌32 d 仔猪断奶的粪便DGGE检测结果
仔猪饲喂各组日粮32 d的62日龄仔猪粪便中的1号真杆菌属(Eubacterium coprostanoligenesHL)中的某些菌株在A、D两组中较其他组多;2号布氏瘤胃球菌(Ruminococcus bromiiATCC 27255)菌属中的某些菌株和3 号罗氏弧菌(Roseburia intestinalisDSM 14610)菌属中的某些菌株在C、D 组中的数量明显高于A、B 组(见图4、表6)。仔猪饲喂各组日粮32 d 的62日龄仔猪粪便的微生物组成没有明显聚类现象,说明随着仔猪的成长,个体差异占据主要作用,微生物组成也随个体差异而聚类分散(图5、图6)。
综上所述,仔猪饲喂各组日粮14 d 后44 日龄仔猪粪便微生物组成区别较明显。试验各组聚类明显,C、D 组对仔猪粪便的微生物组成中某些菌株的影响一致。
3 讨论
同时添加壳寡糖与干酪乳杆菌(D 组)对断奶仔猪在15~32 d 阶段生长性能的影响效果显著,料肉比下降了0.15。刘媛媛等[3]在基础日粮中添加0.5 g/kg壳寡糖可提高28 日龄断奶仔猪15~35 d 和0~35 d 这两个阶段的平均日增重并显著降低料重比。刘伟学等[6]在基础日粮中添加干酪乳杆菌能够提高仔猪生长性能。由此可见复合添加D组效果优于单独使用B组、C组。这与徐晨希等[7]研究壳寡糖和丁酸梭菌对肉仔鸡生长性能的影响结果不一致,复合添加并未优于单独使用的结果。C组降低了断奶仔猪腹泻率,本次试验周期内断奶仔猪腹泻并不明显。张魏伟等[8]研究指出饲喂干酪乳杆菌能有效保护肠道组织结构的生长和发育,可预防断奶仔猪肠道疾病,但在已出现炎症时,直接饲喂干酪乳杆菌不会起到明显的保护和治疗作用。县怡涵等[9]也指出灌喂干酪乳杆菌对断奶前仔猪ADFI、ADG 和F/G 均无显著影响,但能显著降低仔猪腹泻率,提高断奶后仔猪ADFI 和ADG,显著降低F/G,但对断奶后腹泻率无显著影响。

图4 试验32 d各组仔猪的粪便DGGE图谱

表6 试验32 d各组断奶仔猪粪便DGGE图谱中标记条带测序结果

图5 试验32 d各组仔猪粪便DGGE图谱聚类分析结果
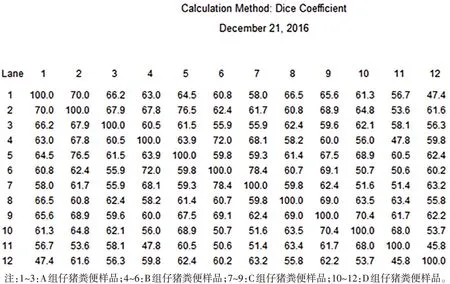
图6 试验32 d各组仔猪粪便DGGE图谱样品相似度结果
试验14 d B、C、D组均对提高血清中各抗氧化指标有一定作用,但效果并不显著(P>0.05);试验32 d B 组显著提高了血清中谷胱甘肽过氧化物酶(GSHPx)的含量(P<0.05),并降低了丙二醛(MDA)的含量(P>0.05)。这与刘媛媛等[3]研究结果基本一致,0~35 d阶段,基础日粮中添加0.5 g/kg 壳寡糖显著提高了血清中超氧化物歧化酶(SOD)的含量。本次研究结果再次证明,使用该剂量壳寡糖可以提高血清中超氧化物歧化酶(SOD)与过氧化氢酶(CAT)的活性,但差异不显著。说明壳寡糖作为饲料添加剂单独使用,在提高动物机体抗氧化酶活性方面有很好的功效。饲粮中同时添加壳寡糖和干酪乳杆菌对因断奶导致的氧化应激也具有一定的作用效果,D组14 d与32 d血清中超氧化物歧化酶(SOD)与过氧化氢酶(CAT)的活性与A组相比有所提高,但差异不显著。由此可推测壳寡糖与干酪乳杆菌之间存在协同效果,这与李阳等[10]研究肉鸡饲粮中添加壳寡糖和干酪乳杆菌可显著改善动物机体抗氧化性能结果一致。
试验14 d,C、D 组中弗林氏丁酸杆菌(Flintibacter butyricum)与卷曲乳杆菌(Lactobacillus crispatus)较A、B 组明显增多。前一种细菌具有利用糖类和蛋白生产丁酸的能力[11],而丁酸是肠道菌群的主要代谢产物,具有抗炎、抗氧化、抗肿瘤等生理功能,对肠道疾病具有有益影响;同时可减少不耐酸的致病菌数量,如大肠杆菌、沙门氏菌和弯曲杆菌,并能促进肠道有益微生物的生长[12],丁酸还能通过影响肠道pH值而影响消化酶的活性[13]。后一种乳酸菌是可产生双氧水的益生菌,常用于预防与治疗细菌性阴道炎[14],可降低因致病菌引起的促炎因子的表达预防腹泻[15]。饲喂干酪乳杆菌或与壳寡糖配伍可有效增加仔猪肠道抗炎性与产丁酸的益生菌数量。试验32 d,A、D两组中真杆菌属(Eubacterium coprostanoligenes)较其他组多;C、D 组中布氏瘤胃球菌(Ruminococcus bromii)和罗氏弧菌(Roseburia intestinalis)的数量明显高于A、B组。以上三种菌均为有益菌:Eubacterium coprostanoligenes可使胆固醇降解为能被肠道吸收的粪醇并排出体外,布氏瘤胃球菌(Ruminococcus bromii)通过消化食物释放能量[16],罗氏弧菌(Roseburia intestinalis)通过分解糖产生丁酸[17]。
综合以上分析结果,壳寡糖作为饲料添加剂有显著的抗氧化效果;干酪乳杆菌则可提高肠道益生菌数量改善断奶仔猪腹泻率;同时添加壳寡糖和干酪乳杆菌可以有效提高断奶仔猪的饲料转化率,并提高肠道有益微生物数量,使仔猪肠道更健康。
