新疆棉田土壤黄萎病菌致病类型和微菌核定量分析
2019-12-31徐灿刘启蔡梦杭高峰黄家风
徐灿,刘启,蔡梦杭,高峰,黄家风
(石河子大学农学院/新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室,新疆 石河子 832003)
新疆是我国最大的棉花种植区,据新疆维吾尔自治区统计局统计,2018年新疆棉花种植面积达到247万hm2,占全国棉花种植面积的80%,在国家棉花产业中占有重要的战略地位。棉花黄萎病是一种土传维管束病害,在发病严重的地区可造成棉花减产30%以上,是影响我国棉花生产的主要病害[1]。由于缺乏有效的防治药剂和抗病品种,加之新疆棉花长期处于连作状态,棉花黄萎病在新疆棉区的发生逐年加重。引起我国棉花黄萎病的病原菌为大丽轮枝菌(VerticilliumdahliaeKleb.)[2],根据不同菌系对棉花致病的严重程度和症状类型,将其分为落叶型和非落叶型2种致病型[3],一般认为落叶型菌系的致病性强于非落叶型菌系[3-4],落叶型菌系引发的黄萎病病情发展迅速,严重时常导致棉花大面积光杆,对棉花生产危害很大[5]。近年新疆棉田病株的鉴定结果[6-7]显示,落叶型菌系所占比例不断增加,从39%到53.2%,但是棉田土壤中落叶型和非落叶型菌系所占比例是否与病株中分离的比例一致,以及不同致病型黄萎病菌在新疆棉田土壤中的发生与分布如何目前并不清楚。
大丽轮枝菌侵染寄主时,在植物体内产生大量微菌核。当病株解体时微菌核释放到土壤中,以休眠体的形式在土壤中存活10年以上[8]。微菌核作为大丽轮枝菌的休眠结构,表皮厚而坚硬,表面附着黑色素,抗逆境能力极强,是黄萎病的主要初侵染来源,因此土壤中大丽轮枝菌数量的多少与黄萎病的发生、发展及危害程度密切相关[9-11]。已有研究表明,只有当土壤中微菌核的数量积累到一定量时才能引起典型的棉花黄萎病[12],感病和抗病棉花品种的发病阈值分别是每克土壤4个和7个微菌核[13]。土壤中微菌核的数量与棉花的生长季节有一定相关性,苗期土壤中微菌核数量相对较低,从蕾期开始逐渐增加,到花铃期和吐絮期数量达到最高值,并且土壤中微菌核的季节变化与田间棉花黄萎病发生趋势高度一致[14]。因此,明确落叶型和非落叶型黄萎病菌在棉田土壤中的分布状况和快速准确地定量测定土壤中黄萎病菌的微菌核密度,对深入研究棉花黄萎病流行规律及制定防治措施具有重要意义。
由于土壤理化性质和生态系统的复杂性,土壤中的棉花黄萎病菌所占比例很低,常规PCR方法很难检测到,高峰[15]和张昕[5]等先后建立了针对落叶型巢式PCR和非落叶型巢氏PCR检测方法,可分别对土壤中的落叶型和非落叶型菌系进行检测。由于巢式PCR利用2套PCR引物对同一片段进行2次特异性扩增,降低了扩增多个靶点的可能性,因而具有较高的灵敏度和特异性,在低模板量样本检测中具有应用价值。但是当检测样品数量较大时,对每个土样分别进行2次巢氏PCR检测才能确定落叶型和非落叶型菌系的方法会消耗双倍时间和试剂,因此并不适合大量样品的检测。对于定量土壤中黄萎病菌种群密度,普遍应用的是选择性培养基法,即将土样均匀涂布在选择性培养基上培养7 d,用流水冲洗去除表面的土壤颗粒后,在显微镜下对平板上微菌核进行计数[14]。该法准确性低、耗时长,不适用于大量样品的检测。魏锋等[13]基于大丽轮枝菌IGS区设计特异引物建立的水筛微菌核和qPCR相结合的方法具有特异性强、灵敏度高的优点,且检测效率得到明显提高。
为此,本研究将2个巢氏PCR进行结合建立了双重巢氏PCR,可同时检测土壤中棉花黄萎病菌的落叶型和非落叶型菌系,通过对棉田土壤中的棉花黄萎病菌进行检测,初步明确落叶型和非落叶型菌系在田间的发生与分布。另外,基于qPCR建立大丽轮枝菌拷贝数(y)与微菌核(x)之间的线性关系,并对棉田土壤中黄萎病菌的种群密度进行定量检测,为深入研究病害流行规律及制定防治措施奠定了基础。
1 材料与方法
1.1 供试菌株
棉花黄萎病菌落叶型菌株V592和非落叶型菌株I6,棉花枯萎病菌菌株SF1,均由本实验室分离、鉴定并保存。
1.2 供试土壤的采集和处理
2018年在全疆26个植棉区采集了208份土壤样品,其中新疆南部阿克苏地区3、8、10、11、12、16团采集37份,新疆北部伊犁地区64团采集20份,奎屯地区123、124、125、126、127、128、130团采集51份,石河子地区121、133、143、144、147、148、149、150团采集64份,五家渠地区106团、芳草湖农场、新湖农场采集30份,塔城地区184团采集6份。在每个条田随机选取3个采样点,在每个采样点以“W”形选取10个取样点,每个取样点在地表0~20 cm耕作层采集30~50 g病土,将10个取样点采集的总量为300~500 g的土样作为1个样品装入1个透气牛皮纸袋,在室内阴凉处自然风干,以地区分类保存备用。
1.3 供试菌株的培养及DNA提取
将棉花黄萎病菌V592菌株、I6菌株和棉花枯萎病菌菌株SF1在PDA固体培养基上活化[16],再转至PDA平板培养基上,置于26 ℃恒温培养箱中,暗培养7 d,用灭菌载玻片轻轻刮取培养基表面的菌丝和分生孢子,按照真菌基因组DNA提取试剂盒(BioFlux)操作说明提取3个菌株的基因组DNA,-20 ℃保存备用。
1.4 双重巢式PCR反应及灵敏性测定
选用Perez-Artes等[17]和Mercodo-Blanco等[18]设计的落叶型黄萎病菌特异性引物D1/D2和INTD1/INTD2,及Mercado-Blanco等[19]设计的非落叶型黄萎病菌特异引物ND1/ND2和INTND1/INTND2,进行样本检测:以引物D1和D2、引物ND1和ND2作为双重巢氏PCR第1轮引物,PCR反应体系为20 μL:2×PCR Mix 10 μL,10 μmol·L-1引物各0.5 μL,10 mg·L-1模板1.0 μL,ddH2O7 μL;扩增产物的大小分别为539、1400 bp。再以引物INTD1和INTD2、引物INTND1和INTND2作为双重巢氏PCR第2轮引物,为了避免第2轮反应因扩增产物浓度过高导致凝胶电泳检测时发生拖带现象、影响实验效果,故降低第2轮PCR反应的引物和模板的终浓度,PCR反应体系为20 μL:2×PCR Mix 10 μL,10 μmol·L-1引物各0.05 μL,第1轮PCR产物0.5 μL,ddH2O 9.3 μL;扩增产物的大小分别为462、824 bp。引物由安徽通用生物公司合成,所用引物序列见表1。

表1 棉花黄萎病菌巢式PCR检测所用引物Tab.1 The primers used for nested PCR detection of V.dahliaefrom cotton
对保存的棉花黄萎病菌落叶型菌株V592和非落叶型菌株I6的DNA进行浓度测定,将相同浓度的2个菌株的DNA等体积混合,使混合液中V592和I6的DNA浓度依次为10-1、10-2、10-3、10-4、10-5、10-6mg·L-1,分别以不同浓度混合液为模板,以无菌水作为阴性对照,按照上述双重巢氏PCR反应进行第1轮和第2轮扩增,对双重巢氏PCR灵敏度进行检测。
1.5 土壤总DNA的提取及棉田土壤黄萎病菌致病类型的检测
将晾干的每份土壤样品称重前充分混匀,称取0.5 g置于研钵中,加入液氮研磨至粉末,按照土壤基因组DNA提取试剂盒(北京索莱宝科技公司)说明提取土壤基因组DNA,于-20 ℃冰箱保存备用。然后按照上述双重巢氏PCR反应体系对所有土壤DNA进行检测,以确定棉田土壤中黄萎病菌的致病类型,记录电泳结果,采用Excel 2010软件进行试验数据统计分析。
1.6 大丽轮枝菌IGS区目标片段标准曲线的建立
以棉花黄萎病菌V592的基因组DNA为模板,利用根据大丽轮枝菌Intergenic Spacer(IGS)区设计的特异性引物Vd-F929-947(5'-CGTTTCCCGTTACTCTTC-3')和Vd-R1076-1094(5'-GGATTTCGGCCCAGAAACT-3')[20],将扩增到的160 bp PCR产物克隆到PMD19-T上,然后提取质粒。测定质粒浓度后按照拷贝数公式:(6.02×1023×质粒浓度)/(基因全长×660)[21],转化为拷贝数,再按梯度稀释成10~1010拷贝/μL的标准质粒样品。将不同拷贝数的标准质粒分别作为模板进行qPCR反应,样品添加按照PowerUp SYBR Green Master Mix(Life Technologies)试剂盒说明进行。qPCR反应体系为20 μL:2×SuperReal PreMix plus 10 μL,Vd-F929-947(10 μmol·L-1)0.6 μL,Vd-R1076-1094(10 μmol·L-1)0.6 μL,模板4 μL,50×ROX Refernce Dye 0.8 μL,RNase-freeddH2O 4 μL。扩增条件:95 ℃ 15 min,95 ℃ 10 s,62 ℃ 20 s,72 ℃ 30 s,40个循环。PCR反应结束后按照7500 Real Time PCR System(Life Technologies)软件分析并建立Ct(threshold cycle)值与拷贝数相关性的标准曲线。
1.7 微菌核数量与大丽轮枝菌IGS基因拷贝数的关系
取V592菌株的分生孢子将浓度调整至为1.0×106cfu/mL,取100 μL分生孢子均匀涂布到覆盖有灭菌玻璃纸的改良基础培养基(BMM)平板上,24 ℃黑暗培养14 d,将玻璃纸上的微菌核刮下,收集到烧杯中,用研磨棒捣碎,加入蒸馏水分别过80目和100目筛子,收集100目筛子上的残留物到1.5 mL离心管中,加入100 μL ddH2O混匀后涂布在水琼脂平板,在倒置显微镜下,用注射针头分别挑取40、50、60、70、80个微菌核,每个数量的微菌核设3次重复。按步骤1.3提取微菌核的DNA,再按照上述qPCR反应体系和扩增条件对棉花黄萎病菌IGS区160 bp进行扩增,建立Ct值与微菌核的标准曲线,再结合Ct值与IGS拷贝数相关性的标准曲线,建立微菌核个数与IGS基因拷贝数的关系。
1.8 棉田土壤黄萎病菌种群密度的定量分析
分别从阿克苏、五家渠、石河子、奎屯、伊犁和塔城地区的每个采样团场随机抽取1份病土样品,以土壤基因组DNA为模板,按照上述qPCR反应体系和扩增条件对棉花黄萎病菌IGS区160 bp进行扩增,通过测定Ct值,按照上述建立的标准曲线计算土壤中棉花黄萎病菌的DNA拷贝数,再通过微菌核个数与IGS基因拷贝数的关系计算微菌核密度,并通过SPSS 17.0软件分析数据进行统计分析。
2 结果与分析
2.1 双重巢式PCR特异性及灵敏性测定
如图1A所示,第1轮PCR反应只有以落叶型菌株V592和非落叶型菌株I6的混合DNA为模板才能同时扩增到预期的目标片段,分别为539、1400 bp(泳道1),以V592或I6的DNA单独为模板,都只能扩增到1条目标条带(泳道5和泳道9);同样第2轮PCR反应也是只有V592和I6的混合DNA才同时扩增到预期的目标片段,分别为462、824 bp(泳道2),以V592或I6的DNA单独为模板,都分别扩增到1条目标条带(泳道6和泳道10)。阴性对照和棉花枯萎病菌均未扩增到任何条带,表明所用4对引物特异,能同时对大丽轮枝菌落叶型和非落叶型2种致病类型进行检测。
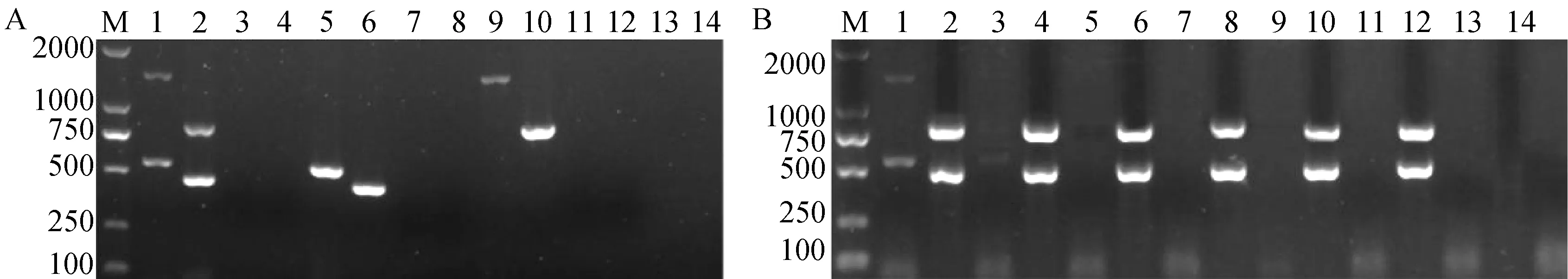
A—引物特异性测定,奇数泳道对应第1轮PCR产物,偶数泳道对应第2轮PCR产物,1、2为V592和I6菌株的混合样品,5、6为V592菌株,9、10为I6菌株,13、14为棉花枯萎病菌菌株SF1,3、4、7、8、11和12为阴性对照;B—双重巢氏PCR灵敏性测定,奇数泳道对应第1轮PCR产物,偶数泳道对应第2轮PCR产物;基因组浓度,1、2为10-1 mg·L-1,3、4为10-2 mg·L-1,5、6为10-3 mg·L-1,7、8为10-4 mg·L-1,9、10为10-5 mg·L-1,11、12为10-6 mg·L-1,13、14为阴性对照,M为marker 2000。图1 棉花黄萎病菌落叶型和非落叶型菌系双重巢氏PCR特异性和灵敏度检测Fig.1 The specific and the sensitivity of duplex nested PCR for detection of defoliating and non-defoliating strain of V.dahliae
分别以不同浓度的2个菌株的混合DNA为模板,对双重巢氏PCR灵敏度进行检测,结果如图1B所示,只有模板浓度为10-1mg·L-1时,第1轮PCR能扩增到较明显的2条目标条带;当模板浓度为10-2mg·L-1时,第1轮PCR只能扩增到微弱的2条目标条带;当模板浓度低于10-2mg·L-1时,第1轮PCR几乎扩增不到任何条带;而第2轮PCR扩增的2条目标条带始终清晰,即使模板稀释至浓度为10-6mg·L-1时,2条目标条带依然清晰(图1B),表明通过第2轮PCR反应提高了检测灵敏度,并且灵敏度至少比第1轮PCR提高了4个数量级,即检测灵敏度比普通PCR至少提高了104倍。
2.2 田间土壤样品的检测
随机选取10个棉田土壤样品,先对其土壤DNA进行落叶型单重巢氏PCR检测,结果显示,10个土壤样品中都能扩增到落叶型菌系预期大小的462 bp目标条带(图2A);再对土壤DNA进行非落叶型单重巢氏PCR检测,只有5个样品能扩增到非落叶型菌系预期大小的824 bp目标条带(图2B)。结果表明,10个土壤样品中都有落叶型黄萎病菌,其中5个土壤样品中还含有非落叶型黄萎病菌,为落叶型和非落叶型菌系混合感染的样品。
再将10个土壤样品用上述建立的双重巢式PCR进行检测,结果如图2C所示,所有样品经过第1轮PCR扩增都扩增不到任何条带,当经过第2轮PCR扩增后,10个样品都能扩增到落叶型菌系特异的462 bp的目标条带,同时从含有非落叶型菌系的5个土壤样品中也扩增到了非落叶型菌系特异的目标条带(824 bp),与落叶型单重巢氏PCR和非落叶型单重巢氏PCR分别检测的结果一致,说明双重巢式PCR同样可以提高土壤黄萎病菌的检测灵敏度,并能快速、有效地检测土壤中黄萎病菌的致病类型。
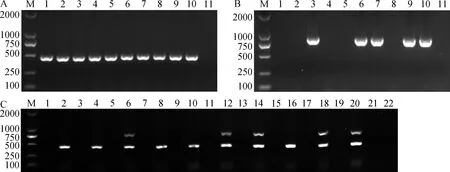
A—巢式PCR检测落叶型菌系;B—巢式PCR检测非落叶型菌系,1~10为棉田自然土样,11为阴性对照,M为marker 2000;C—双重巢式PCR同时检测落叶型和非落叶型菌系,奇数泳道对应第1轮PCR产物,偶数泳道对应第2轮PCR产物。图2 单重巢式PCR和双重巢式PCR检测棉田土壤中黄萎病菌的致病类型Fig.2 Pathotypes detection of V.dahliaein natural soils from cotton fields by nested PCR and duplex nested PCR
2.3 新疆各棉区土壤中黄萎病菌致病类型的鉴定
用双重巢氏PCR对208份棉田土壤中的黄萎病菌进行致病类型检测。结果如表2所示,205份土壤样品检测到落叶型菌系,占样品总量的98.6%;81份土壤样品检测到非落叶型菌系,占样品总量的38.9%;其中78份土壤样品同时检测到落叶型和非落叶型菌系,占样品总量的37.5%;只检测到落叶型菌系的土样为127份,占样品总量的61.1%,只检测到非落叶型菌系的土样只有3份,占样品总量的1.4%。表明棉田土壤中黄萎病菌以落叶型菌系为优势致病类型,非落叶型菌系单独发生的棉田所占比例很少,几乎都与落叶型菌系混合发生。

表2 棉花黄萎病菌落叶型和非落叶型菌系在新疆棉田土壤中的比例Tab.2 The proportion of defoliating and non-defoliating strains of V.dahliaein cotton field soil in Xinjiang
从土壤样品的地区来源来看,从阿克苏、伊犁、五家渠和石河子地区采集的棉田土壤,其落叶型黄萎病菌的检出率都为100%,非落叶型菌系的检出率为33.3%~37.0%;非落叶型菌系都是与落叶型菌系以混合发生的方式存在,没有检测到非落叶型菌系单独存在的土样。塔城地区的土样没有检测到非落叶型菌系,都是以落叶型菌系单独存在。只有奎屯地区检测到3份以非落叶型菌系单独存在的土样,并且非落叶型菌系的检出率明显比其它地区都高,为49%。
2.4 大丽轮枝菌IGS区目标片段标准曲线的建立
将不同拷贝数的质粒样品通过qPCR扩增大丽轮枝菌IGS区目标片段,荧光定量PCR测定系统自动生成Ct值与IGS区目标片段拷贝数(10~1010拷贝/μL)对数的标准曲线(图3 A),曲线的决定系数R2=0.9837,说明在质粒稀释拷贝数范围内二者具有良好的线性关系。线性方程为y=-3.311x+38.945,扩增效率E=100.4%,表明建立的标准曲线能准确地反映目标片段的扩增。以不同数量微菌核的DNA为模板,经过同样的qPCR扩增,荧光定量PCR测定系统自动生成Ct值与微菌核数对数的标准曲线(图3B),曲线的决定系数R2=0.984,扩增效率E=97.7%,表明微菌核数对数与Ct值也呈现良好的线性关系。基于2个标准曲线得出大丽轮枝菌拷贝数(y)与微菌核密度(x)的换算公式为:y=11.54x,为检测田间土壤微菌核密度奠定基础。
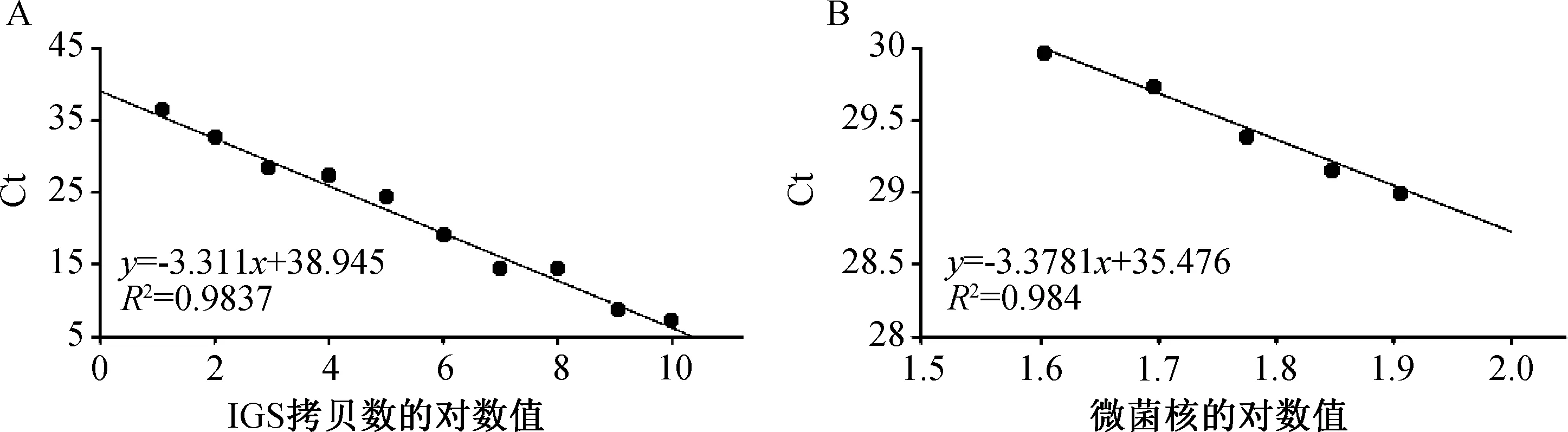
A—质粒样品IGS拷贝数的对数值与Ct值的标准曲线;B—不同数量微菌核的对数值与Ct值的标准曲线。图3 Ct值与大丽轮枝菌IGS目标片段拷贝数相关性和Ct值与微菌核对数相关性的标准曲线Fig.3 Standard curves relating Ct to the copy number of IGS fragment and to number of microsclerotia of V.dahliae
2.5 棉田土壤黄萎病菌微菌核的定量检测
对棉田自然土中黄萎病菌的IGS拷贝数进行定量检测,再将其换算为微菌核密度,结果如图4所示。棉田土壤的微菌核密度按照每克土微菌核数量计算,分别为:阿克苏98~751个,石河子3~262个,奎屯0.5~375个,五家渠38~102个、伊犁0.7~45个,塔城1.6~9个。对每个棉区而言,土样之间的菌核量都存在显著差异,表明不同地块的土壤带菌量存在差异。
为了明确不同棉区的土壤带菌量是否存在差异,对各棉区土壤的最高微菌核密度和平均微菌核密度进行比较,结果如图4G和图4H所示,阿克苏的棉田土壤,其最高微菌核密度和平均微菌核密度都最高,分别为每克土751和351个微菌核;其次是石河子和奎屯,它们之间的最高微菌核密度和平均微菌核密度都没有显著差异,石河子棉田土壤最高微菌核密度和平均微菌核密度分别为每克土262和141个微菌核,奎屯棉田土壤其最高微菌核密度和平均微菌核密度分别为每克土375和113个微菌核;然后是五家渠棉田土壤,其最高微菌核密度和平均微菌核密度分别为每克土102和74个微菌核;伊犁和塔城的棉田土壤,其最高微菌核密度和平均微菌核密度明显低于其他棉区,伊犁的最高微菌核密度和平均微菌核密度分别为每克土45和25个微菌核;塔城的最高微菌核密度和平均微菌核密度分别为每克土9和5个微菌核。结果表明各棉区土壤带菌量也存在差异,阿克苏的土壤带菌量最高,塔城的土壤带菌量最低。

不同小写字母表示Waller-Duncan检验差异极显著(P<0.05)图4 棉田土壤黄萎病菌微菌核的定量检测Fig.4 Quantitative detection of microsclerotial density of V.dahliaein cotton field soil
3 结论与讨论
(1)本研究建立的双重巢氏PCR,可同时对棉花黄萎病菌落叶型和非落叶型菌系进行检测。待测样品经过2轮PCR扩增,目标条带清晰、特异,与落叶型单重巢氏PCR和非落叶型单重巢氏PCR扩增的效果一致,表明经过整合后的双重巢氏PCR不影响检测目标的特异性。巢氏PCR第1轮反应的检测灵敏度最高达到10-2mg·L-1,与普通PCR法对大丽轮枝菌基因组DNA检测灵敏度达到10-2mg·L-1一致[22],但该灵敏度很难对田间自然土中的黄萎病菌进行检测,本研究发现仅通过第1轮PCR从田间自然土中几乎扩增不到任何条带(图2C),但通过双重巢氏PCR第2轮扩增,将检测灵敏度提高了104倍,与落叶型单重巢氏PCR提高的灵敏度一致[5]。
(2)从田间病株检测结果来看,1999年以前,新疆没有发现落叶型菌株,完全是非落叶型菌株;2003—2004年检测,落叶型菌株占供测菌株的4%~5.9%;2008年检测时,南、北疆的落叶型菌株分别占供测菌株的33.3%和39%;2015年落叶型菌株比例已达53.2%[6-7,23-24]。本研究对棉田土壤黄萎病菌的鉴定结果显示,落叶型菌系占供试土样的98.6%,非落叶型菌系占供试土样的38.9%,因此土壤中落叶型菌系所占比例远高于病株中的比例;并且除奎屯检测到3个以非落叶型菌系单独存在的土样外,非落叶型菌系几乎都与落叶型菌系混合发生。在不到20年的时间内田间致病类型迅速演变的原因普遍认为与新疆大量从内地引种和缺乏抗病品种有关[25],但是是否与落叶型菌系和非落叶型菌系对寄主的侵染能力有关也需要进行深入研究。
(3)本研究以qPCR为基础建立了Ct值与大丽轮枝菌IGS目标片段拷贝数相关性的标准曲线,及Ct值与微菌核密度相关性的标准曲线,然后基于2个标准曲线推导出大丽轮枝菌IGS拷贝数和菌核数之间的关系,对棉田土壤中黄萎病菌的微菌核密度进行了定量测定。检测结果显示,该方法可对棉田自然土中的微菌核进行定量检测,检测灵敏度达到每克土0.5个微菌核,这与Wei等[13]检测灵敏度相当。Wei等将土壤水筛提纯微菌核和qPCR技术相结合建立了土壤大丽轮枝菌微菌核的快速定量方法,检测下限为每克土0.5个微菌核,但该方法需对待测土样进行过筛水洗处理,虽然检测特异性强、灵敏度高,但是样品处理耗时长,不利于大量样品的定量检测。本研究建立的微菌核定量检测方法可直接针对土壤DNA进行定量检测,且能达到相同的灵敏度。
(4)刘海洋等[7]2015年对新疆主要植棉区发病棉田的调查显示,阿克苏发病棉田平均病指最高,为12.9;其次是石河子棉田,平均病指是9.6;然后是奎屯棉田,平均病指为6.2。本研究通过对不同植棉区棉田土壤中的微菌核进行定量测定,结果表明,阿克苏棉田土壤中微菌核密度最高,其次是石河子和奎屯地区,塔城棉田土壤微菌核密度最低,这与不同棉区田间棉花发病程度相一致。另外,对同一地区不同地块的微菌核进行定量测定,结果显示,地块之间微菌核含量也存在显著差异。由于感病和抗病棉花品种的发病阈值不同[13],田间发病程度相对一致的不同地块,其微菌核含量可能存在很大差异,因此选择地块进行轮作或者在研究病害流行规律时以病田土壤中的实际带菌量为依据尤为重要。
