液相色谱-串联质谱测定鸡蛋中4种硝基呋喃类代谢物残留
2019-12-30李艳徐欣然吕晓峰侯莉莉陈梦静
李艳 徐欣然 吕晓峰 侯莉莉 陈梦静
摘要 [目的]建立一种测定鸡蛋中硝基呋喃类代谢物残留的液相色谱-串联质谱法。[方法]样品经在酸性条件下水解,加入衍生试剂2-硝基苯甲醛,37 ℃避光孵育16 h,Na2EDTA-McⅡ-vaine缓冲溶液和乙酸乙酯共同提取,经固相萃取去除基质中的干扰物,液相色谱-串联质谱进行检测。[结果]4种兽药残留采用同位素内标法定量,在0.1~20.0 μg/kg线性关系良好,相关系数均大于0.99,方法回收率为79.85%~102.17%,相对标准偏差(RSD)为1.64%~9.16%,定量限为0.5 μg/kg。[结论]该方法前处理相对简单、准确且灵敏度高,适用于鸡蛋中4种硝基呋喃类代谢物药物残留检测。
关键词 鸡蛋;硝基呋喃类代谢物;液相色谱-串联质谱;残留
中图分类号 S859.84 文献标识码 A
文章编号 0517-6611(2019)24-0199-03
doi:10.3969/j.issn.0517-6611.2019.24.060
Determination of Four Metabolite Residues of Nitrofuran Antibiotics in Eggs by Liquid Chromatography-tande mmol/Lass Spectrometry
LI Yan1,XU Xin-ran2,Lu Xiao-feng1 et al (1.Supervision and Testing Center for Agricultural Product Quality of Yancheng City,Yancheng,Jiangsu 224002;2.College of Veterinary,Yangzhou University,Yangzhou,Jiangsu 225009)
Abstract [Objective]The research aimed to establish a liquid chromatography-tandem mass spectrometry method for the determination of nitrofuran metabolite residues in eggs.[Method]The sample was hydrolyzed under acidic conditions,and the derivatizing reagent 2-nitrobenzaldehyde was added.The mixture was incubated at 37 ℃ for 16 h in the dark.The Na2EDTA-McII-vaine buffer solution and ethyl acetate were co-extracted,the interfering substances in the matrix were removed by solid phase extraction and detected by liquid chromatography-tandem mass spectrometry.[Result]The residues of the four veterinary drugs were quantified by isotope internal standard method.The linear relationship was good at 0.1-20.0 μg/kg,the correlation coefficient was greater than 0.99,the recovery rate was 79.85%-102.17%,and the relative standard deviation (RSD) was 1.64%-9.16%.The limit of quantification is 0.5 μg/kg.[Conclusion]The method is relatively simple,accurate and sensitive,and is suitable for the detection of four nitrofuran metabolites in eggs.
Key words Eggs;Nitrofuran metabolites;Liquid chromatography-tandem mass spectrometry (LC-MS/MS);Residue
作者简介
李艳(1984—),女,江苏滨海人,畜牧师,硕士,从事农畜产品药物残留检测及方法研究。
收稿日期 2019-06-05
硝基呋喃類药物主要包含呋喃唑酮、呋喃它酮、呋喃妥因、呋喃西林,因硝基呋喃类原型药在生物体内代谢迅速,故常用检测代谢物药物来反映硝基呋喃类药物的残留状况,其代谢产物分别为AOZ(3-氨基-2-恶唑烷酮)、AMOZ(5-甲基吗啉-3-氨基-2-唑烷基酮)、AHD(1-氨基-2-乙内酰)、SEM(氨基脲)。它是一类广谱的抗菌药物,对常见的革兰氏阴性菌和阳性菌有抑制作用,常用于预防或治疗禽、猪、牛胃肠道疾病,有时也会作为饲料添加剂使用[1-2]。但是动物大剂量或长期使用硝基呋喃类药物会引起中毒性反应,且由于硝基呋喃类抗生素的代谢物在动物组织中代谢降解慢,并容易在体内蓄积,一旦被人类长期食用,甚至可能会引起致癌、致畸、致突变[3-5]。FDA已于2002年禁止了硝基呋喃类在动物性食品中的使用;农业部也于第235号公告将呋喃唑酮列为禁止使用的药物,不得在动物性食品中检出[6]。所以对硝基呋喃类及其代谢物的药物残留检测显得非常有必要。目前检测畜禽肉、水产品中硝基呋喃类代谢物已有报道[7-10],方法主要是胶体金免疫法、酶联免疫吸附法、高效液相色谱法、液相色谱-串联质谱法等[11-14],但是由于鸡蛋中蛋白和脂肪含量非常高且基质复杂,关于鸡蛋中检测硝基呋喃类代谢物鲜少有报道[15-16],行业标准主要是参考动物源性食品检测标准[17]。因此,建立专门针对鸡蛋中硝基呋喃类代谢物残留的液相色谱-串联质谱分析法显得很有必要。
1 材料与方法
1.1 材料
1.1.1 仪器。Agilent 1290 液相色谱仪,Agilent 6460C 三重四极杆质谱仪(配电喷雾离子源);离心机(ST 16R,赛默飞);旋涡混合器(MS 3BS25,IKA公司);固相萃取装置(HHE-12B,天津恒奥);天平(HCB602H,艾德姆);真空泵(HPD-25,天津恒奥);氮吹仪(TTL-DCII,北京同泰联);0.45 μm微孔滤膜(SCAA-104,上海安谱);固相萃取小柱(200 mg/6cc,Oasis PRIME HLB,Waters)。
1.1.2 药品试剂。4种兽药为呋喃唑酮(AOZ)、呋喃它酮(AMOZ)、呋喃妥因(AHD)、呋喃西林(SEM),对应的内标标准品分别为AOZ-D4、AMOZ-D5、AHD-13C3、SEM-[1,2-15N2;13C],均为德国Dr.公司,标准品纯度均不低于99%;甲醇为色谱纯(天地),2-硝基苯甲醛、浓盐酸、甲酸、乙酸铵均为优级纯,二甲基亚砜、乙酸乙酯、乙二胺四乙酸二纳、磷酸氢二钠、柠檬酸均为国药分析纯。
1.1.3 标准溶液配制。分别精密称取适量的4种兽药AOZ、AMOZ、AHD、SEM标准品,用甲醇分别溶解配制成浓度为1 000 μg/mL的各药物标准储备液;准确吸取100 μL的各药物标准储备液用甲醇稀释定容至10 mL,配制成浓度为10 μg/mL的混标储备液,再准确吸取50 μL的各药物标准储备液用甲醇稀释定容至10 mL,配制成浓度为50 μg/mL的混标工作液;内标按同样步骤配制50 μg/mL的混标内标工作液。
1.1.4 Na2EDTA-McⅡ-vaine缓冲溶液配制。准确称取37.2 g乙二胺四乙酸二纳(Na2EDTA·2H2O)、10.9 g磷酸氢二钠和12.9 g柠檬酸于烧杯内,定容至1 000 mL,调节pH至4.0,混合均匀,即可。
1.2 试验设计
该试验通过加标回收验证检验检测方法,思路为设3个浓度梯度,从低到高分别为0.5、1.0、2.0 μg/kg,每个浓度设3个平行样,另设空白样品同时比对。
1.3 样品前处理过程
准确称取(2.00±0.02)g均质鸡蛋试样,加入适量内标,加入5 mL 0.12 mol/L盐酸溶液,再加入200 μmL 50 mmol/L 2-硝基苯甲醛的DMSO溶液,涡旋混匀后,37 ℃水浴避光孵育16 h衍生化,冷却至室温,加入8 mL Na2EDTA-McⅡ-vaine缓冲溶液,涡旋混匀30 s,再加入8.00 mL乙酸乙酯,涡旋混匀, 8 000 r/min离心5 min,取上层清液备用;Prime固相萃取小柱无需活化,取上清液4.00 mL直接过柱,挤干,滤液于45 ℃下氮吹干,用1 mL甲醇-0.1%甲酸溶液(1∶9,V/V)复溶,涡旋混匀,过0.45 μm有机系微孔滤膜,供上机待测。
1.4 标准曲线溶液的配制 精密量取混合标准工作液浓度为5、10、25、50、100、200 μg/kg各100 μL置6个不同离心管中,再精密量取混合内标标准工作液浓度为50 μg/kg各100 μL置上述6个离心管中,按“1.3”前处理过程操作,最终制得标准曲线溶液浓度分别为0.5、1.0、2.5、5.0、10.0、20.0 μg/kg,最终内标浓度均为5.0 μg/kg。
1.5 色谱条件
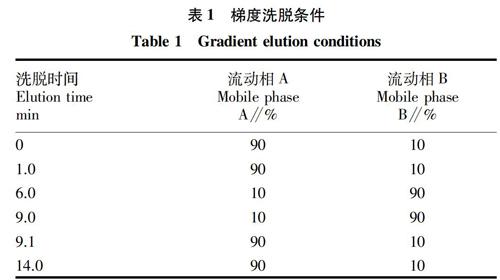
色谱柱:Agilent C18 柱 (Rapid Resolution HD 2.1 mm×100 mm,1.8-Micron);流 动 相:A相为0.1% (V/V,下同)甲酸水(含5 mmol/L的乙酸铵),B相为0.1% 甲酸甲醇(含5 mmol/L的乙酸铵);流速0.3 mL/min;进样量20.0 μL;时间14 min;柱温30 ℃;梯度洗脱程序见表1。
1.6 质谱条件
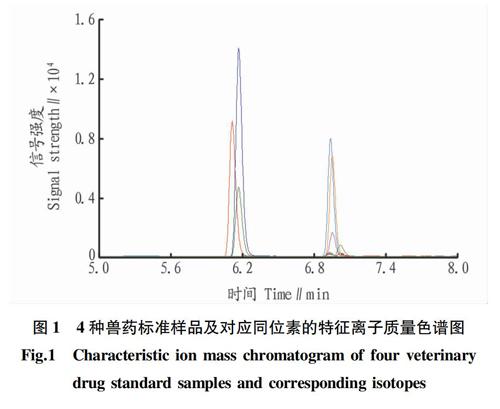
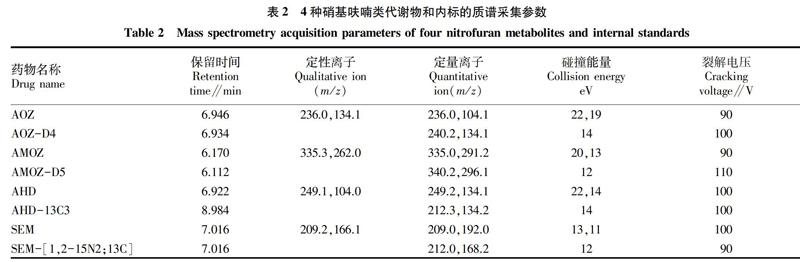
电离模式:电喷雾正离子(ESI+);毛细管电压40 kV;离子源温度350 ℃;干燥气流速11 L/min,雾化器压力310.26 kPa;采集方式:多反应监测扫描模式(MRM);增加电压(+):100 V。质谱采集参数见表2以及硝基呋喃类代谢物的MRM图见图1。
2 結果与分析
2.1 色谱、质谱条件的选择
流动相采用0.2%甲酸水-甲醇和0.1%甲酸水(含5 mmol/L的乙酸铵)-甲酸甲醇(含5 mmol/L的乙酸铵)2种体系进行比较,结果发现,0.1%甲酸水(含5 mmol/L的乙酸铵)-甲酸甲醇(含5 mmol/L的乙酸铵)对4种目标物响应较灵敏,尤其是4种目标物的内标物响应提高较明显,可能是流动相体系引入乙酸铵与甲酸形成缓冲体系,这样流动相体系pH相对恒定,有利于目标物的离子化效果。
该试验中的4种代谢物以及相对应的内标物在正离子模式下,采用手动优化软件对4种标准品单标浓度为100 ng/mL 进行二级子离子质谱扫描,该研究中的4 种目标化合物以及内标物详细的碰撞能量和定性定量子离子信息见表2。
2.2 提取、净化条件的选择
现有的硝基呋喃类代谢物残留的前处理几乎都是用磷酸氢二钾进行提取的,再采用有机溶剂乙酸乙酯进行液液萃取。该试验分别进行磷酸氢二钾、EDTA缓冲盐提取后结合乙酸乙酯,试验结果发现EDTA缓冲盐结合乙酸乙酯提取结果响应比磷酸氢二钾结合乙酸乙酯高。可能是因为硝基呋喃类代谢和蛋白质结合相当稳定,酸性条件下可能更有利于结合态的药物提取出来。
因鸡蛋样品含有较多的脂溶性杂质,若按肉类样品方法提取,不进行净化处理,样品会很浑浊,如白色奶样,直接上机不仅会污染仪器,而且基质较复杂,被检药物残留响应很低。也有报道在衍生提取前对鸡蛋样品采取有机溶剂洗涤[17],这样不仅需要较大量的有机试剂,而且一般的甲醇、乙醇试剂洗涤效果较差,需要采用甲醇、乙醇联合乙醚依次洗涤才会有效果,乙醚有特殊的刺激性气味、极易挥发,属于易制毒管制试剂,对操作人员伤害较大。该试验采用HLB固相萃取小柱净化,不仅净化效果好,基质干扰小,而且无需进行样品洗涤。
2.3 标准曲线和检出限
从表3可以看出,4种硝基呋喃类代谢物标准曲线在0.1~20.0 μg/kg线性关系良好,相关系数(r)均大于0.99。试验采用加标回收的方法,以大于3倍的信噪比为检测限,大于10的信噪比为定量限。计算得出4种硝基呋喃类代谢物各药物残留检出限(LOD)为0.1 μg/kg,定量限(LOQ)为0.5 μg/kg。
2.4 加标回收试验
在鸡蛋空白基质中通过添加0.5、1.0、2.0 μg/kg浓度的4种硝基呋喃类代谢物药物进行加标回收试验,每个浓度水平进行3次平行试验,根据检测结果计算回收率以及RSD。从表4可以看出,4种硝基呋喃类代谢物药物回收率为79.85%~102.17%,RSD为1.64%~9.16%,均比较满意,且RSD均小于15%,符合相关检测技术规范要求。
2.5 实际样品检测 用该试验建立的方法对市场随机采购的20份鸡蛋样品进行筛选测定,尚未检测出阳性样品。
3 结论
该研究通过对鸡蛋样品前处理条件的充分优化改进,建立了鸡蛋中硝基呋喃类代谢物残留的高效液相色谱-串联质谱检测方法,样品经EDTA缓冲盐结合乙酸乙酯提取、PRIME HLB净化,用液相色谱-串联质谱检测,该方法前处理过程相对简便、基质干扰较小、重复性好、检出限低,适用于鸡蛋中4种硝基呋喃类代谢物的快速定性筛选和定量检测分析。
参考文献
[1]COOPER K M,CADDELL A,ELLIOTT C T,et al.Production and characterisation of polyclonal antibodies to a derivative of 3-amino-2-oxazolidinone,a metabolite of the nitrofuran furazolidone[J].Analytica chimica acta,2004,520(1/2):79-86.
[2]MCCRACKEN R J,BLANCHFLOWER W J,ROWAN C,et al.Determination of furazolidone in porcine tissue using thermospray liquid chromatography-mass spectrometry and a study of the pharmacokinetics and stability of its residues[J].The analyst,1995,120 (9):2347-2351.
[3]KAUFMANN A,BUTCHER P,MADEN K,et al.Determination of nitrofuran and chloramphenicol residues by high resolution mass spectrometry versus tandem quadrupole mass spectrometry[J].Anal Chim Acta,2015,862:41-52.
[4]CHIU S H,SU Y L,LE A V T,et al.Nanocarbon material-supported conducting poly(melamine) nanoparticle-modified screen-printed carbon electrodes for highly sensitive determination of nitrofuran drugs by adsorptive stripping voltammetry[J].Anal Bioanal Chem,2018,410(25):6573-6583.
[5]VERDON E,COUEDOR P,SANDERS P.Multi-residue monitoring for the simultaneous determination of five nitrofurans(furazolidone,furaltadone,nitrofurazone,nitrofurantoine,nifursol) in poultry muscle tissue through the detection of their five major metabolites (AOZ,AMOZ,SEM,AHD,DNSAH) by liquid chromatography coupled to electrospray tandem mass spectrometry in house validation in line with commission decision[J].Analytica chimica acta,2007,586(1/2):336-347.
[6]农业部兽医局.中华人民共和国农业部公告第235号:动物性食品中兽药最高残留限量[A].2020.
[7]桂文龙,苏治国,徐婷婷.HPLC-MS/MS 检测猪肉中4 种硝基呋喃类代谢物残留[J].江苏农业科学,2018,46(23):212-215.
[8]宋兴兴.LC-MS/MS法检测鸡肉中硝基呋喃类代谢物的残留[J].食品工业,2019,40(1):308-310.
[9]王传现,黄帆,王敏,等.液相色谱-串联质谱法检测水产品中残留的硝基呋喃类药物的代谢物[J].色谱,2013,31(3):206-210.
[10]邢丽红,孙伟红,彭吉星,等.液相色谱-串联质谱法测定贝类组织中硝基呋喃类代谢物残留[J].环境化学,2019,38(2):287-296.
[11]赵正苗,罗晓琴,汪善良,等.应用胶体金免疫层析法检测动物组织中呋喃西林代谢物的残留[J].上海畜牧兽医通讯,2012(5):4-5.
[12]罗杰,李健.呋喃唑酮间接竞争ELISA(ciELISA)检测法的建立[J].中国海洋大学学报,2005,35(2):213-218.
[13]王媛,蔡友琼,贾东芬,等.高效液相色谱法检测水产品中硝基呋喃类代谢物残留量[J].分析试验室,2009,28(12):86-90.
[14]李丹妮,严凤,张文刚,等.超高效液相色谱-串联质谱法检测鸡肌肉组织中硝基呋喃类代谢物残留[J].分析测试学报,2007,26(S1):218-221.
[15]杨婷婷,易路遥,熊雯,等.QuEChERS-四极杆飞行时间串联质谱法测定7种蛋及蛋制品中硝基呋喃代谢物残留的基质效應[J].肉类工业,2018(4):45-50.
[16]尹晖,孙雷,叶妮,等.鸡蛋中硝基呋喃类代谢物残留的UPLC-MS/MS检测方法研究[J].中国兽药杂志,2015,49(12):42-46.
[17]中国兽医药品监察所.农业部 781号公告-4—2006:动物源食品中硝基呋喃类代谢物残留量的测定 高效液相色谱-串联质谱法[S].北京:中国农业出版社,2016.
