黄曲霉毒素检测在线固相萃取柱的研究
2019-12-30顾风云,郭迎迎,李桂杰等
黄曲霉毒素(Aflatoxin,AFT)是由黄曲霉和寄生曲霉等产生的一类结构相似的有毒化合物,基本结构为二呋喃环和香豆素。目前已分离鉴定的黄曲霉毒素达20多种,主要是黄曲霉毒素B1、B2、G1、G2、M1和M2[1],因其具有致癌、致畸、致突变的危害,在1993年被世界卫生组织的癌症研究机构划定为I类致癌物[2]。AFB1和AFM1是最受关注的两个指标,化学结构如图1所示。

图1 AFB1(A)、AFM1 (B)的化学结构式
随着多起黄曲霉毒素污染事件的发生,世界各国相关机构和广大消费者对食品安全愈发关切。欧盟规定谷物中B1限量2.0μg/kg--8.0μg/kg,黄曲霉毒素总量4.0μg/kg-15.0μg/kg[3] 。我国规定乳及乳制品中M1含量不能超过0.5μg/kg,婴幼儿配方及辅助食品中B1含量不能超过0.5μg/kg [4]。
常见的黄曲霉毒素分析中的前处理方法有液-液萃取法、固相萃取法、凝胶渗透色谱及免疫亲和柱净化法。样品中黄曲霉毒素的提取主要是利用各种溶剂对样品中的目标物质进行萃取。常用的前处理净化方法包括: 超临界流体萃取法、加压流体萃取法、固相萃取法、免疫亲和层析和分析印迹技术等。
国内最常用的检测方法为免疫亲和层析净化高效液相色谱法,免疫亲和柱价格昂贵、储存条件苛刻、稳定性较差、保存期短等,使成本增加,因此开发稳定性好、价格合理、萃取效率高的固相萃取方法对于黄曲霉毒素的分析具有重要的意义。
固相萃取(solid phase extraction,SPE)是一项由液固萃取和色谱分离相结合的样品前处理技术。主要用于样品的分离、净化和富集,达到降低样品基质干扰,提高检测灵敏度的目的[5-7]。黄曲霉毒素检测前处理过程复杂繁琐和困难,对检验人员的操作技术要求高,需大量使用有机溶剂,且有检测结果再现性不好、出现假阳性结果等问题。为此希望通过试验证明该方法可实现与免疫亲和柱法相当的高精度、高回收率结果,找到新的可替代方法,从而使检验成本大大降低。
材料和方法
材料与试剂。黄曲霉毒素B 1标准品(纯度99%)Romer公司;乙腈(色谱纯)国药集团化学试剂有限公司;超纯水(电阻率为18.2MΩ·cm,25℃) 美国Millipore公司;固相萃取柱填料H、 D、 L、M分别购买不同国内厂家。
仪器和设备。双三元液相高效液相色谱仪(配有DFD荧光检测器、六通阀) 赛默飞公司;510蠕动泵、7725i手动进样器、200μL定量环美国Waters公司;Milli-Q纯水器美国Millipore公司。
色谱条件。色 谱 柱:C 18 Kromasil柱(4.6mm×150mm,5μm);固相萃取富集柱:L填料柱(20mm×21μm,5μm);柱温30℃;在线富集流动相:甲醇-水(40:60,V/V),分析测定流动相:甲醇-水(40:60,V/V)。
结果与分析
SPE柱填料的优化。比较了不同填料的在线固相萃取柱的加标回收率,SPE柱填料类型分别为聚硅胶(H)、季铵盐(D)、白炭黑(L)、中性氧化铝(M)。回收率如图2所示。

柱加标回收率分别为48.20%、38.2%、85.0%、54.0%,可以看出L填料效果更好,且色谱峰分离度好、信噪比高、对称性好,优先选择L填料。
在线SPE萃取方法研究。在线处理过程包括三个过程:
1.样品组分由进样器与左泵流动相引入到富集上进行富集(或纯化),干扰物(或基质)则从柱上流出并排至废液收集器,分析柱处于清洗与平衡的过程。
2.目标组分由富集(或纯化)柱上转移至分析柱的过程。
3.目标组分在分析柱上进行在线分离与定性(或定量)分析,富集(或纯化)柱则进行离线清洗和平衡的过程,如图3所示。
展望
采用在线固相萃取液相色谱-荧光检测法准确地测定了黄曲霉毒素含量,几分钟即可完成一次实际样品测定。样品无须经过繁琐的前处理过程,过滤后即可进样,样品的萃取和浓缩完全由液相色谱系统自动完成。与传统的离线固相萃取相比,在线固相萃取技术不仅具有样品需求量小,试剂消耗量少,还具有操作简单,样品分析成本低廉,回收率高等特点。
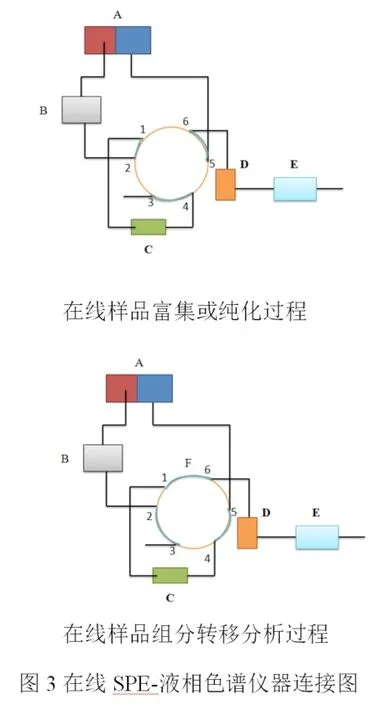
A 双三元泵 B 自动进样器 C 在线SPE柱D 分析柱 E 检测器 F 柱切换阀
