超声波提取-气相色谱法测定油田区土壤中21种酚类化合物
2019-12-27王玉功李玉泽余志峰
马 亮,王玉功,李玉泽,余志峰
(国土资源部 兰州矿产资源监督检测中心,甘肃 兰州 730050)
酚类化合物是当前重要的环境污染物之一,大多数具有致癌、致畸、致突变的潜在毒性. 环境中酚类污染物主要来源于石油化工、焦化、印染、制药和农药等厂家排放的水、气和废渣. 土壤及水体被酚类污染后可长期残留,难以降解. 这些酚类污染物,最终通过食物链的富集,影响到人体健康. 美、日等国都将其列入优先监测物黑名单,制订了标准分析方法,严格控制排放. 我国水质和土壤质量控制标准中也把苯酚、2,4-二氯酚、2,4,6-三氯酚、五氯酚和对硝基酚也作为常规的必检项目.
目前酚类化合物的分析方法主要有气相色谱法[1-4]、液相色谱法[5]和气相色谱-质谱联法[6-7],但是大多偏重于对水中苯酚、2,4-二氯酚、2,4,6-三氯酚和五氯酚等的测定,对土壤中其他酚类化合物的分析较少. 土壤中酚类化合物由于性质活泼,提取和分析均比较困难. 土壤中酚类化合物的提取方法主要有索氏提取法[8-9]、微波提取法和加压流体萃取法[10]. 索氏提取法虽然效率高、重现性好,但溶剂消耗量较大,提取时间较长. 加压流体萃取和微波提取方法快速、节能、操作方便、回收率较高、溶剂用量较少,但设备昂贵. 超声波提取法[11]以其操作简便、提取率高、提取时间短等优势,越来越多地应用于各种固体样品的前处理中. 目前,对于油田区成分复杂、各种有机物含量普遍较高的土壤,采用超声波提取酚类化合物的报道并不多见. 本文采用超声波提取油田区土壤中21种酚类化合物,气相色谱准确定量. 结果表明提取效率高,方法准确、实用,特别是对于2,4-二硝基酚和4-硝基酚两种化合物,本法回收率明显高于加压流体萃取法.
1 试验部分
1.1 仪器和试剂
GC-7890B气相色谱仪,配备FID检测器(美国Agilent公司). 超声波处理器(新芝SB-2400DT,宁波新芝生物科技股份有限公司). 加速溶剂萃取仪(赛默飞-AES350). 定量浓缩仪:(LabTech-MV5,北京莱伯泰科仪器股份有限公司).
酚类化合物混合标准溶液:ρ=1 000 mg/L,市售有证标准溶液(包括苯酚、2-氯酚、邻-甲酚、对-甲酚、间-甲酚、2-硝基酚、2,4-二甲酚、2,4-二氯酚、2,6-二氯酚、4-氯-3-甲酚、2,4,6-三氯酚、2,4,5-三氯酚、2,4-二硝基酚、4-硝基酚、2,3,4,6-四氯酚、2,3,4,5-四氯酚、2,3,5,6-四氯酚、2-甲基-4,6,-二硝基酚、五氯酚、地乐酚、2-环己基-4,6-二硝基酚).
酚类化合物标准工作溶液:ρ=50.0 mg/L .
二氯甲烷:色谱纯(德国默克). 正己烷:色谱纯(德国默克). 乙酸乙酯:色谱纯(德国默克). 二氯甲烷/正己烷混合溶剂:2∶1(体积比). 二氯甲烷/乙酸乙酯混合溶剂:4∶1(体积比). 无水硫酸钠(分析纯,500 ℃马弗炉中烘烤4 h后冷却备用). 盐酸、氢氧化钠均为分析纯试剂. 试验室用水为二次蒸馏水.
1.2 仪器工作条件
毛细管柱:HP-5(30 m×0.32 mm,0.25 μm). 升温程序:初始温度50 ℃,以8 ℃/min速率升至250 ℃,保持5 min. 其他参数如表1所列.

表1 仪器工作条件Table 1 Working parameters of GC
1.3 试验方法
1.3.1 样品采集与处理
采集5~20 cm深度的土壤样品,除去石子、树叶等杂物,充分混匀,装入棕色磨口玻璃瓶,避光、4 ℃冷藏保存. 分别用加压流体萃取法和超声波提取法进行前处理,同时做水分校正试验.
超声波提取法:准确称取10.0 g(精确至0.01 g)混匀的土壤样品,加入适量无水硫酸钠,研磨搅拌均匀,倒入100 mL锥形瓶中,加入20 mL二氯甲烷/正己烷(体积比为2∶1)混合溶剂,以锡箔纸封口,超声提取3次,每次5 min,提取时控制温度不超过40 ℃,合并提取液.
加压流体萃取法:准确称取10.0 g(精确至0.01 g)混匀的土壤样品,加入适量硅藻土,研磨搅拌均匀后,装入萃取池中,以二氯甲烷/正己烷(体积比为2∶1)混合溶剂为萃取溶剂,萃取条件:萃取温度100 ℃,萃取压力10.3 MPa,静态萃取时间5 min,淋洗体积为60%池体积,萃取循环次数为3次,合并萃取液.
1.3.2 样品净化
将上述两种方法得到的萃取液分别置于250 mL分液漏斗中,向分液漏斗中加入120 mL的NaOH溶液(pH>12,0.02 mol/L),充分振荡、静置,分层后弃去下层有机相,保留水相部分. 若有机相颜色较深,可适当增加净化次数.
将得到的水相部分用HCl溶液(5 mol/L)调节pH低于2,加入30 mL二氯甲烷/乙酸乙酯混合溶剂(体积比为4∶1),充分振荡、静置萃取2次,弃去水相,收集下层有机相,有机相经装有无水硫酸钠的漏斗脱水,用二氯甲烷/乙酸乙酯混合溶剂充分淋洗无水硫酸钠,合并全部有机相,氮吹、浓缩,定容至1.0 mL,待测.
2 结果与讨论
2.1 超声提取时间的选择
按照试验方法,分别采用5、10、15、20、25、30 min的超声时间进行回收率试验. 根据回收率统计结果,21种酚类化合物回收率随萃取时间的增加而明显提高. 在超声时间为15~25 min时,回收率基本稳定在80%~110%之间. 在15 min时,大部分化合物的回收率达到90%左右. 随着萃取时间的增加,个别酚类化合物的回收率有所下降,这是由于油田区土壤基质复杂,各种化合物相互作用且性质活泼易于发生化学变化所导致. 因此,试验选择超声提取时间为15 min.
2.2 净化时间的选择
由于油田区土壤基质复杂,样品净化过程需要充分振荡,将酚转化成盐类,净化时间对酚类化合物的回收率具有一定影响,如图1所示. 由图1可见,净化时间太短,水相与有机相分层效果差,净化效果较差,酚类化合物回收率偏低. 当净化时间达到5 min,回收率逐渐趋于稳定. 通过试验发现,控制水相体积为有机相体积的2倍,净化效果较好,若有机相颜色较深,可增加净化次数. 本试验净化两次,每次净化时间控制在不少于5 min.

图1 净化时间对酚类化合物回收率影响曲线Fig. 1 Effect of purification time on recovery rate of phenolic compounds
2.3 pH对净化条件的影响
油田区土壤中石油烃、多环芳烃和硝基苯等化合物含量普遍较高,测定酚类化合物时,样品若不经过碱洗净化,直接浓缩进样,将会污染进样口和色谱柱,从而影响酚类化合物的准确定量. 酚类化合物由于含有酚羟基而具有弱酸性,在碱性介质中易形成盐类而溶于水,在酸性介质中又重新形成中性分子被有机溶剂提取. 利用这种特性,对提取液进行酸碱分配净化,可以去除大多数不溶于碱性水溶液的有机化合物.
采用二氯甲烷/正己烷混合溶剂(体积比为2∶1)作为土壤中酚类化合物的提取溶剂,净化时有机相在下层,容易分离. 通过试验发现,净化时水溶液pH值对回收率影响很大. 分别在pH 8、12和高于12这3种条件下,收集净化后废弃的有机相,脱水后经气相色谱仪检测. 发现pH高于12时,废液有机相中检测不到酚类化合物. pH为8时,部分酚类化合物有检出. 所以在pH高于12条件下,可以将成盐的酚类化合物保留在碱性水相中,有机相洗去大多数石油烃、多环芳烃和硝基苯类等非酸性有机化合物,从而避免对酚类化合物测定的干扰.
2.4 pH对萃取条件的影响
净化后的样品,采用二氯甲烷/乙酸乙酯(体积比为4∶1)混合溶剂萃取水相中的酚类. 酚类化合物属于酸性化合物,需要在酸性条件下进行萃取. 试验采用pH在7、4、2和低于2这4种条件,结果如表2所列. 由表2可见,pH为7时,酚类化合物的回收率很低. 随着酸性的增强,酚类化合物回收率逐渐提高,当pH低于2时,回收率达到最高且逐渐趋于稳定. 水样pH调节好后,加入20 mL二氯甲烷/乙酸乙酯混合溶剂萃取5 min,分别萃取3次,合并萃取液. 通过充分振荡、静置,将水相中的酚类化合物萃取至有机相中. 若有机相与水相分层不好,可通过添加氯化钠,以减小水的活度,从而降低有机化合物的溶解度. 氮吹浓缩时,控制氮吹仪温度不超过35 ℃,防止温度过高,导致沸点较低的酚类化合物损失.
2.5 线性回归方程及检出限
配制21种酚类化合物混合标准系列,其质量浓度分别为0.50、1.00、2.50、5.00、10.00、20.00 mg/L,以峰面积对各组分的质量浓度作标准曲线,各组分的线性回归方程和相关系数如表3所列. 所有组分的相关系数均在0.999以上,能满足测定要求.

表2 不同pH条件下21种酚类化合物回收率Table 2 Recovery rates of 21 phenolic compounds under different pH conditions
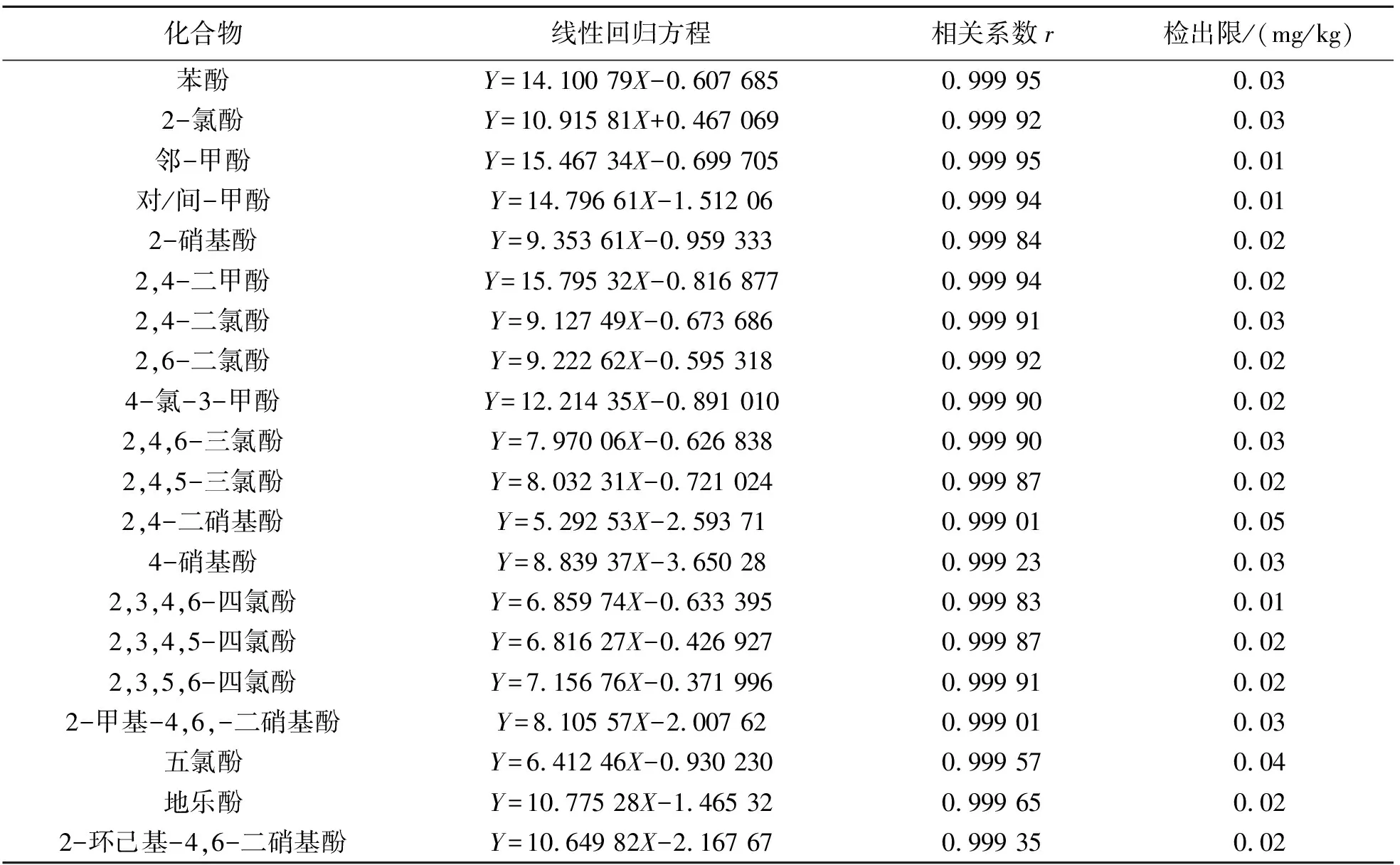
表3 21种酚类化合物的线性回归方程、相关系数及检出限Table 3 Linear regression equations, correlation coefficients and detection limits of 21 phenolic compounds
在10.0 g石英砂中加入0.10 μg酚类标准物质,平行测定11份,按照3倍的标准偏差计算出方法的检出限为0.01~0.05 mg/kg,质量浓度在0.04~80.0 mg/L内,与其对应的峰面积线性关系良好,完全能满足土壤中21种酚类化合物的测定要求.
2.6 标准色谱图
由于酚类化合物分子结构中都含有酚羟基,具有一定极性,对色谱柱的选择有一定要求. 本试验选用填料为5%二苯基-95%二甲基聚硅氧烷色谱柱,同时对柱箱升温程序进行了优化,使各化合物更好的分离. 图2为21种酚类化合物在HP-5色谱柱上的分离情况,除间甲酚和对甲酚为同分异构体无法分离,定量时可合并计算总量,其余化合物分离效果均较好.
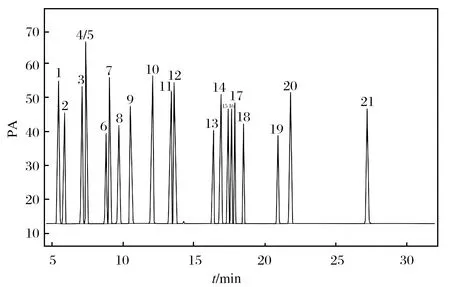
图2 HP-5毛细管色谱柱上酚类化合物标准溶液色谱图Fig. 2 Chromatogram of standard solution of phenolic compounds HP-5 capillary chromatographic column(1) 苯酚,(2) 2-氯酚,(3) 邻-甲酚,(4/5) 对/间-甲酚,(6) 2-硝基酚,(7) 2,4-二甲酚,(8) 2,4-二氯酚,(9) 2,6-二氯酚,(10) 4-氯-3-甲酚,(11) 2,4,6-三氯酚,(12) 2,4,5-三氯酚,(13) 2,4-二硝基酚, (14) 4-硝基酚,(15) 2,3,4,6-四氯酚,(16) 2,3,4,5-四氯酚,(17) 2,3,5,6-四氯酚,(18) 2-甲基-4,6,-二硝基酚,(19) 五氯酚,(20) 地乐酚,(21) 2-环己基-4,6-二硝基酚
2.7 提取方式的比较
超声波提取法是利用产生的超声波冲击力,对浸润样品进行反复冲击,在溶剂和样品之间产生声波空化作用,从而使固体样品分散,增大样品与溶剂之间的接触面积,提高目标物从固相转移到液相的传质速率.
加压流体萃取法是在加压、加热条件下对样品中有机物进行萃取. 加压的主要目的是阻止有机溶剂在高温下沸腾,使其处于液态,并和实际样品充分接触,加热可以破坏溶剂和基质之间由于范德华力、氢键等引起的强吸引力,减少溶剂的粘性和表面张力,使溶剂更好地渗透到基质里,从而达到快速、有效的萃取基质中的目标物.
称取7份样品,分别采用两种方法进行提取. 结果如表4所列. 由表4可以看出,两种萃取方式对绝大多数酚类,提取效果相当,相对偏差均低于15%,无明显系统偏差. 但2,4-二硝基酚和4-硝基酚使用超声波提取比加压流体萃取效果更好,主要由于这2种化合物稳定性差,在高温、高压条件下易分解,也可能被硅藻土吸附. 综合比较两种提取方式,超声波提取法更优.

表4 不同提取方法对土壤样品中21种酚类化合物的影响Table 4 Effect of different extraction methods on 21 phenolic compounds in soil samples
2.8 精密度及回收率
为了比较加压流体萃取和超声波提取方式的精密度和准确度,按照1.3的试验条件,分别称取7份平行样品,采用两种方式提取,每份加入4.0 μg酚类标准物质,进行加标回收试验. 结果如表5所列.
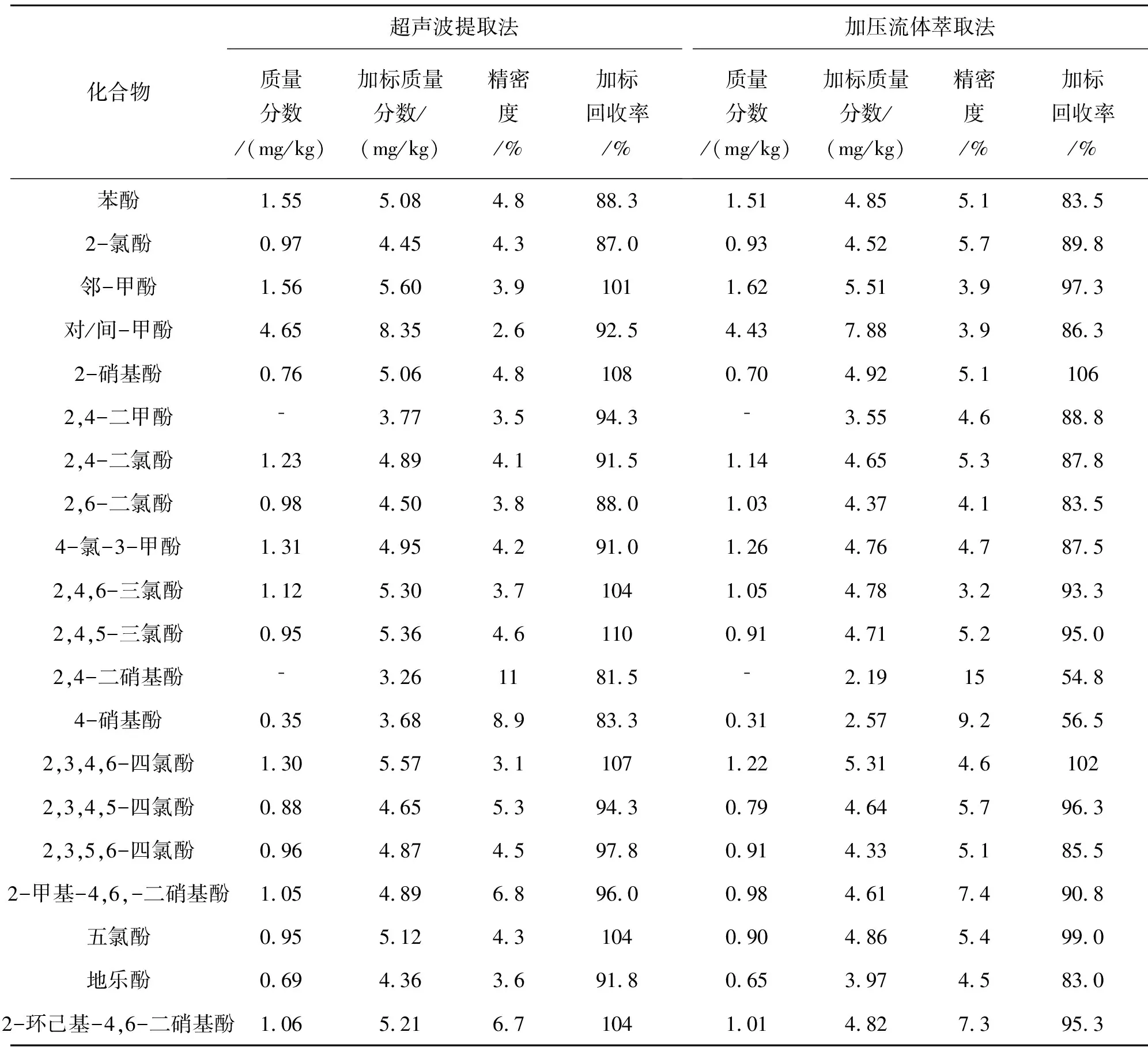
表5 土壤样品中酚类化合物测定的精密度和准确度(n=7)Table 5 Precision and accuracy of determination of phenolic compounds in soil samples
试验结果表明,两种方法测定的精密度和结果基本一致. 但采用超声波提取法所得2,4-二硝基酚和4-硝基酚的加标回收率明显高于加压流体萃取法,其余化合物加标回收率差别不大. 通过对试验过程及结果综合分析,可能由于加压流体萃取法萃取池填充的硅藻土对2,4-二硝基酚和4-硝基酚具有一定的吸附性,另外这两种化合物稳定性较差,而且萃取过程温度较高,导致加标回收偏低.
2.9 准确度
按照1.3方法,称取2.0 g(精确至0.001 g)酚类标准样品(ERA093,英国,Laboratory of the Government Chemist),采用超声波提取法进行准确度试验,测定结果如表6所列. 由表6可见,检测值与标准值的相对误差大部分低于10%,其中2,4-二硝基酚和4-硝基酚相对误差小于15%,能满足土壤中21种酚类化合物的测定要求[12].
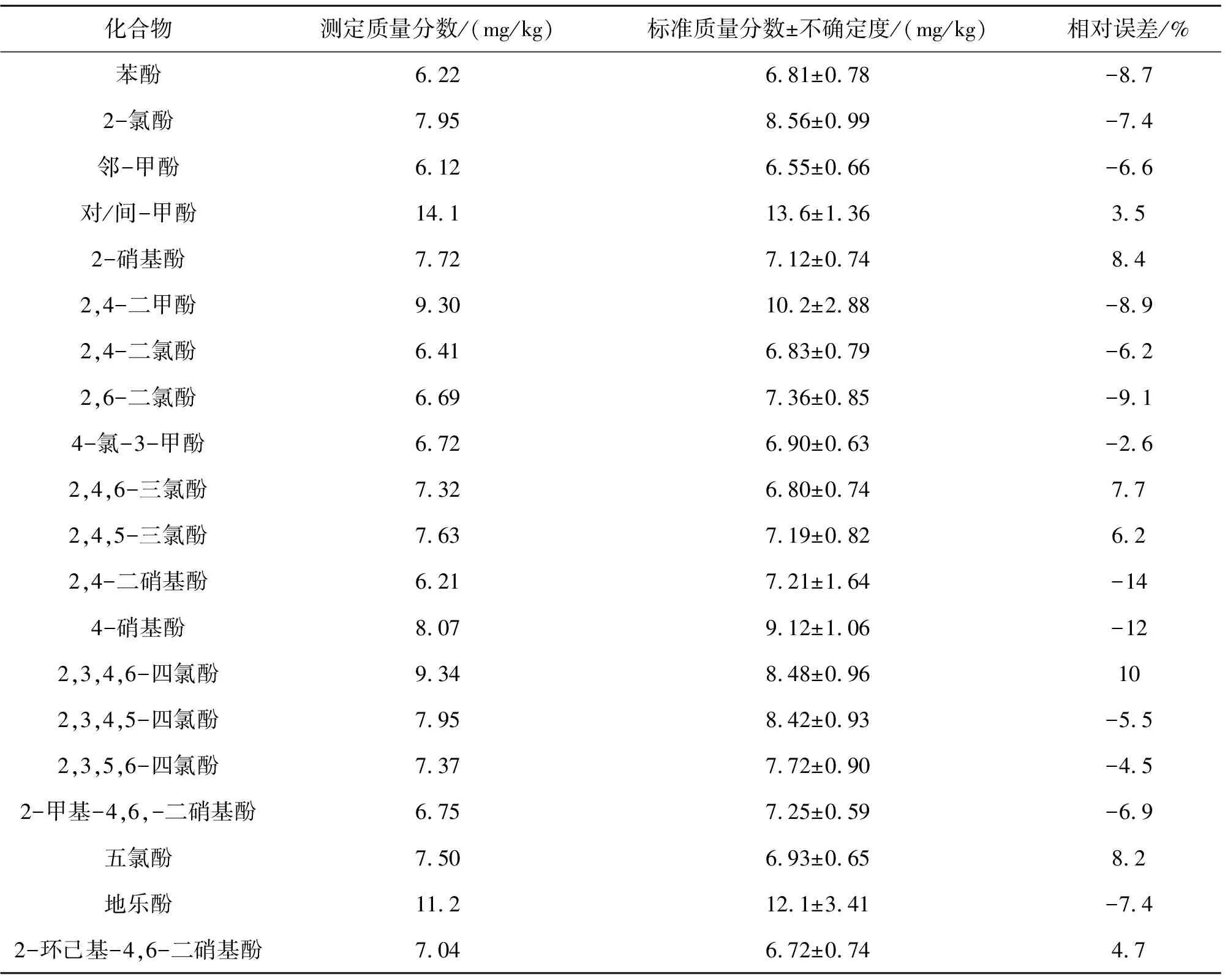
表6 21种酚类化合物的与标准样品相对误差Table 6 Relative errors among 21 phenolic compounds and standard samples
3 结论
本文探讨了加压流体萃取和超声波提取-气相色谱法测定油田区土壤中21种酚类化合物在实际中的应用. 综合比较,采用超声波提取法提取油田区土壤中酚类化合物,结果优于加压流体萃取法,加标回收率能同时满足21种酚类化合物的测定,特别是测定2,4-二硝基酚和4-硝基酚时,加标回收率明显提高. 同时该方法成本较低、操作简单快速、定量准确,是实用、有效的测定方法.
