牛疱疹病毒Ⅰ型(BHV-1)荧光定量PCR检测方法的建立及应用*
2019-12-27李晓波王淑菁王莎莎黄宗文岳秉飞贺争鸣
王 吉 付 瑞 李晓波 王淑菁 王莎莎 李 威 秦 骁 黄宗文 巩 薇 岳秉飞 贺争鸣
(中国食品药品检定研究院 国家实验动物微生物遗传检测中心,北京 100050)
牛疱疹病毒I型(Bovine herpesvirus type 1,BHV-1)主要引起牛传染性鼻气管炎,又称牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)。BHV-1属疱疹病毒科,甲型疱疹病毒亚科[1-3]。BHV-1感染又称红鼻病或牛传染性坏死性鼻炎,是一种急性接触性传染病,临床特征为呼吸困难和发热,有鼻炎、鼻窦炎、喉炎和气管炎为特征[4-7]。除能引起呼吸道疾病外,还可引起结膜炎、流产、脑炎和全身性感染[8-9]。OIE将其列为(通报疾病)B类疫病,在我国将其列为二类动物疫病,是我国进出境动物和国际动物贸易中规定的重点检疫对象[10-11]。病毒主要存在于鼻、眼、阴道分泌物和排泄物中[12-13]。本病主要由飞沫经呼吸道传播,吸血昆虫(软壳蜱等)也可传播本病。在自然条件下,各种年龄和品种的牛均易感,一般发病率为20%~100%,死亡率为1%~12%[2,14-15]。在国内外的养牛场广泛流行,大部分省份的奶牛、肉牛、牦牛等均有不同程度感染,是一种严重危害养牛业的传染病[11,16]。
随着牛源性生物制品开发利用的日益增多,人们对牛源性制品是否潜在病毒污染,对潜在病毒是否会通过直接或间接途径对人造成危害或者传染病的扩散也越来越关注[17]。为保障人民用药的安全及避免传染病的扩散,最大限度地降低使用牛源性生物制品而引起牛疱疹病毒1型传播的风险,实验建立了特异、敏感,操作快速、简便的BHV-1 实时荧光定量PCR方法,用于开展对牛及人用牛源性生物制品及原辅材料可能潜在的BHV-1 的检测,对保证牛源性材料及牛源性制品的使用安全性、保障人民的用药安全至关重要。
1 材料与方法
1.1 病毒及样品
牛疱疹病毒1型(Bovine herpesvirus type 1,BHV-1)、牛副流感病毒3型(Bovine parainfluenza virus type3,BPIV3)、牛病毒性腹泻病毒1型(Bovine viral diarrhea virus type 1,BVDV1)、猫疱疹病毒Ⅰ型(Felid herpesvirus 1,FHV-1)购自美国ATCC(编号分别为VR-188、VR-281、VR-1422、VR-636);猪伪狂犬病毒(Porcine pseudorabies virus,PRV)、单纯疱疹病毒Ⅰ型(Herpes simplex virus 1,HSV-1):本室保存;BHV-1 pGEM-T Easy-pol质粒标准品:委托宝生物工程(大连)有限公司合成;145份牛血浆样本(编号分别为X1~X145):来自内蒙古自治区某奶牛养殖场和北京市某奶牛和肉牛饲养单位;36批次人用牛源样本(编号:Ny1-Ny36):国内7省市11个厂家和国外2个厂家提供。
1.2 主要试剂及主要仪器
RNA快速提取试剂盒购自Qiagen公司;逆转录试剂盒购自美国Promega公司;Taq DNA聚合酶和100 bp DNA marker均购自TaKaRa公司;TaqMan Gene Expression Master Mix:美国ABI公司;PCR仪:美国Bio-RAD公司;核酸琼脂糖凝胶电泳仪:美国Bio-RAD公司PwerPac Basic;凝胶成像分析仪:美国 Kodak公司 GL212Pro;荧光定量PCR仪:美国Applied Biosystems公司7500fast Real-Time PCR System。
1.3 引物及探针的设计合成
分析已报道的BHV-1基因组序列,将不同株进行比对,根据GenBank中登陆的BHV-1gB基因(序列号:AJ004801.1),采用ABI PrimerExpress 3.0实时荧光定量PCR引物设计软件,设计合成TaqMan探针及引物。探针的荧光标记选择FAM(5’端)作为报告发光基团,NFQ(3’端)为淬灭基团,引物和探针由美国ABI公司合成。序列如下(见表1):
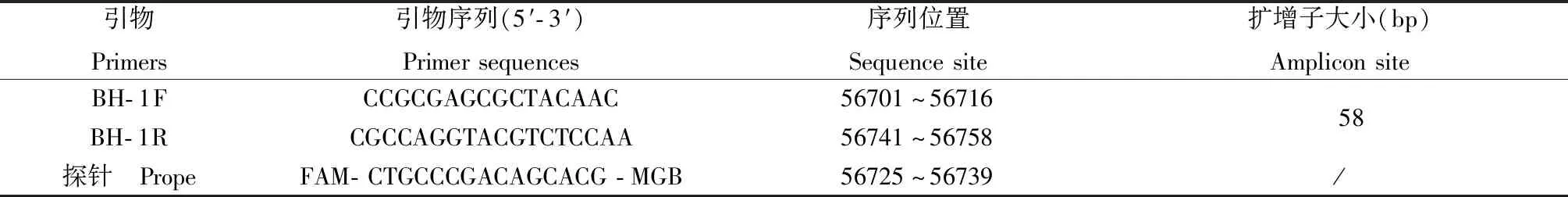
表1 用于扩增gB基因的引物与TaqMan探针序列Table 1 The sequences of primers and TaqMan probes to used for amplification gB gene
1.4 病毒DNA/RNA提取
按照DNA/RNA快速提取试剂盒操作方法,对正常牛肾细胞(Bovine kidney cells,MDBK细胞)、BHV-1感染MDBK细胞毒、BPIV3、BVDV1、PRV、FHV-1、HSV-1进行DNA/RNA提取。提取的DNA样本冻存于-70 ℃冰箱备用。提取的RNA样本立即进行cDNA合成。
1.5 实时荧光定量PCR扩增体系及标准曲线的建立
1.5.1通过优化在荧光定量PCR反应体系中使用的探针和引物浓度,确定最佳反应条件,建立实时荧光定量PCR检测方法[18-20]。
在96孔板中按以下体系加样,每个样品做3个重复:

Mix10μL灭菌水8μL探针+引物1μLDNA1μL总体积20μL
反应条件为:先50 ℃保持2 min;然后95 ℃预变性10 min;最后95 ℃ 15 s,60 ℃ 1 min,共40个循环,在每个循环的延伸结束时进行荧光信号检测。
1.5.2用含有目的片段的BHV-1质粒pGEM-T Easy-pol作为标准品,根据公式copies /μL=(6.02×1023)×(ng/μL×10-9)/(DNA length×660),算出BHV-1质粒标准品拷贝数。将其稀释为108~100copies/μL冻存备用。取107~102copies/μL作为模板按上述反应体系及反应条件进行实时荧光定量PCR反应,建立标准曲线[18-19]。
1.6 特异性试验
分别以BHV-1感染MDBK细胞毒、BPIV3、BVDV1、PRV、FHV-1、HSV-1及正常MDBK细胞的DNA/cDNA为模板,用建立的Q-PCR方法进行扩增,检测方法的特异性。
1.7 敏感性试验
取108~100copies/μL标准品用建立的荧光定量PCR进行检测,每个浓度标准品各做3个复孔。所能检测的最小浓度梯度的循环阈值(CT)≤35,拷贝数(copies)≥10时,此浓度为方法的检测灵敏度[17-18]。
1.8 重复性和稳定性试验
取107copies/μL、106copies/μL、105copies/μL 3个不同浓度阳性标准品,用建立的方法分3个不同时间重复检测3次,计算批间变异系数,评价本方法的重复性和稳定性[18-19]。
1.9 判断标准的制定
建立的标准曲线参数Slope在-3~-3.5之间、R2大于或等于0.99、Eff%在90%~110%之间,实验成立可用于定量检测。
样品循环阈值(CT)≤35,同时拷贝数(copies)≥10,判定该样品检测结果为阳性;循环阈值(CT)≤35、拷贝数(copies)<10,或者循环阈值(CT)>35、拷贝数(copies)≥10,或者循环阈值(CT)>35、拷贝数(copies)<10,此样品超出检测限,不能确定被检样品是阳性样品,结果判为阴性[18-19]。
(3)智慧城市市民抱怨、智慧城市预期与智慧城市建设满意度呈现负相关得到验证(H5,H6),且在0.05水平下是显著的。这表明较高的市民期望值会对智慧城市的建设发展产生些许的负面影响,如果市民对智慧城市建设的期望太高,市民在享受服务之后的实际心理感知与期望值相比差距较大,那么市民的满足性预期得不到满足,市民对智慧城市建设的抱怨就会增多,因而降低了市民的满意度。
1.10 应用
1.10.1取145份牛血浆样本(编号为X1~X145)按照DNA快速提取试剂盒操作方法提取样本DNA,同时设BHV-1、正常MDBK细胞对照。用建立的方法分2次对10倍稀释的145份血浆样本DNA进行检测。
1.10.2取36批次人用牛源生物制品及人用牛源生物制品生产用原材料样本(编号:Ny1~Ny36)按1.10.1方法进行检测。36批次牛源生物制品及原材料具体信息见表2。
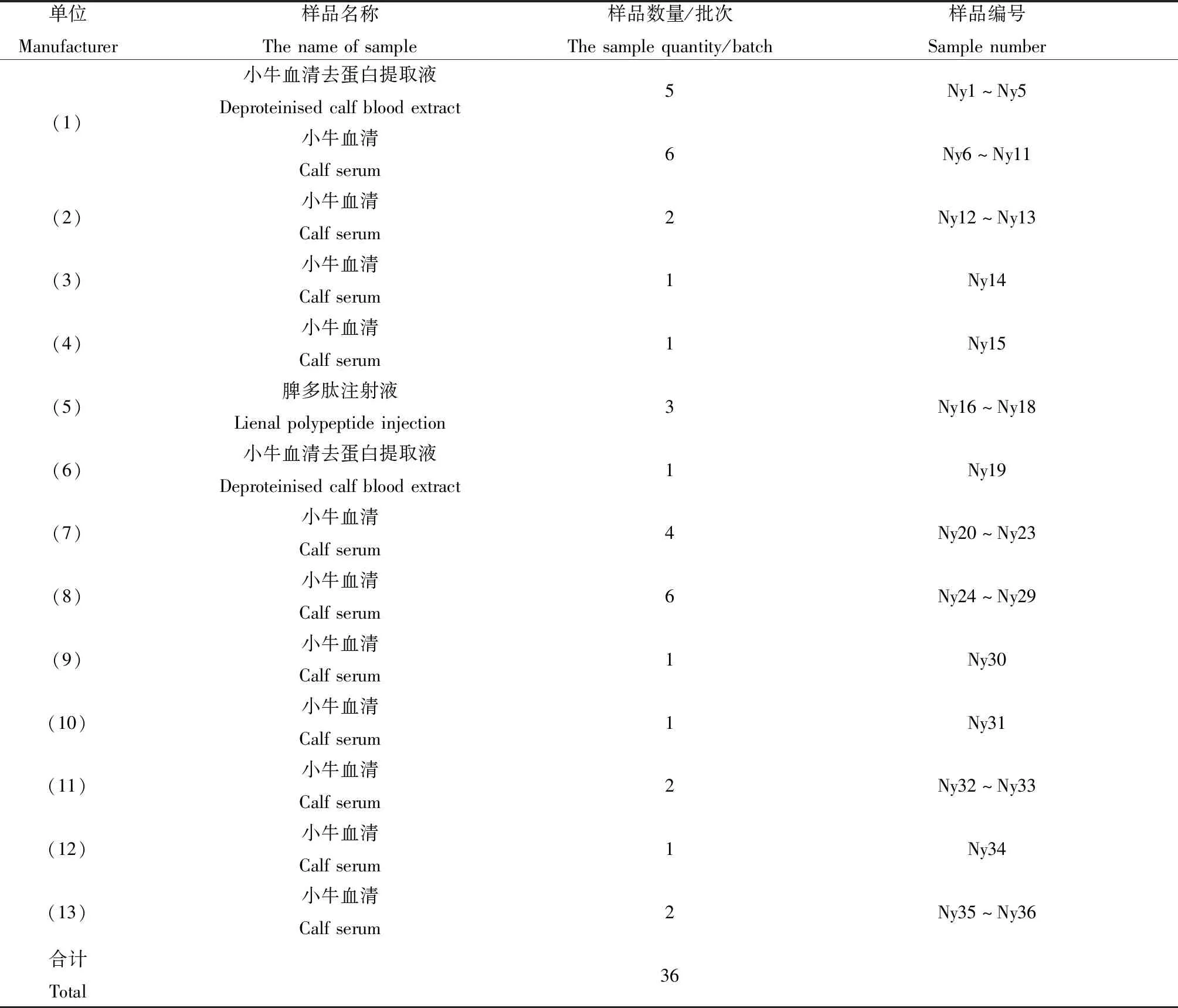
表2 36批次牛源样本信息Table 2 The information of 36 bovine origin samples
2 结果
2.1 标准阳性质控品的制备
经拷贝数计算公式copies/μL=(6.02×1023)×(ng/μL×10-9)/(DNAlength×660)计算,BHV-1质粒标准品原浓度分别为1.12×1011copies/μL。
2.2 实时荧光定量PCR标准曲线的构建
用含有目的片段的质粒标准品,分别设为1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101copies /μL,作为模板进行实时荧光定量PCR反应。扩增曲线各稀释梯度间距均匀,线性范围和标准曲线各参数结果见图1。
结果显示,标准曲线参数Slope(应在-3~-3.5之间)、R2值(应≥0.99),扩增效率Eff%(应在90%~110%之间)均优于Q-PCR标准规定范围,说明建立的方法相关性高,定量结果有效,可用于BHV-1的定量检测。
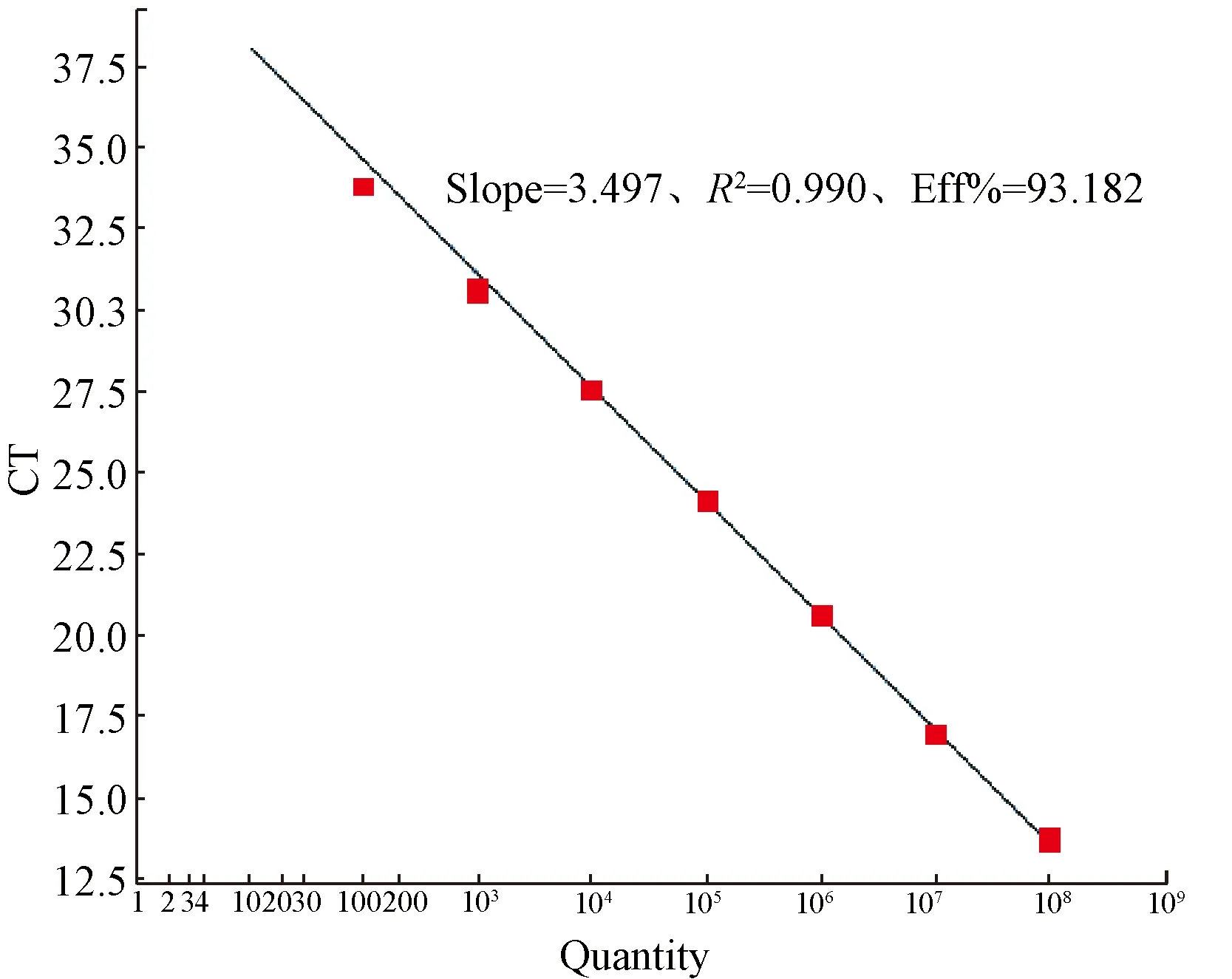
图1 1×107~1×101 copies/μL标准品的标准曲线Fig.1 The amplification curve of 1×107-1×101 copies/μL standard
2.3 实时荧光定量PCR检测方法的特异性实验
结果如图2所示,BHV-1感染MDBK细胞毒有明显扩增曲线,在标准曲线参数符合要求的条件下,其循环阈值CT值为24.721,拷贝数为2.42×104copies/μL,检测结果为阳性。BPIV3、BVDV1、PRV、FHV-1、HSV-1及正常MDBK细胞无曲线扩增,检测结果均为阴性。说明所建方法特异性良好。

图2 BHV-1 Q-PCR特异性检测结果注:1:BHV-1;2~7:BPIV3、BVDV1、FHV-1、PRV、HSV-1、MDBK细胞Fig.2 Specific test results of BHV-1 Q-PCRNote:1:BHV-1;2-7:BPIV3,BVDV1,FHV-1,PRV,HSV-1,MDBK cell
2.4 荧光定量PCR检测方法灵敏度检测
图3、图4可知,标准品稀释到1.0×101copies时有明显扩增曲线,CT值为32.139,实际检测拷贝数为13.234copies,仍在可信范围之内;1.0×100copies时有扩增曲线,CT值为35.539,拷贝数为0.772copies,已超出可信范围。所以临界稀释度为1.0×101时,其对应的拷贝数为10,因此最低检测限度为10个copies。说明建立的荧光定量PCR方法具有很高的灵敏度。

图3 1×108~1×100 copies/μL标准品的标准曲线Fig.3 The standard curve of 1×108-1×100 copies/μL standard
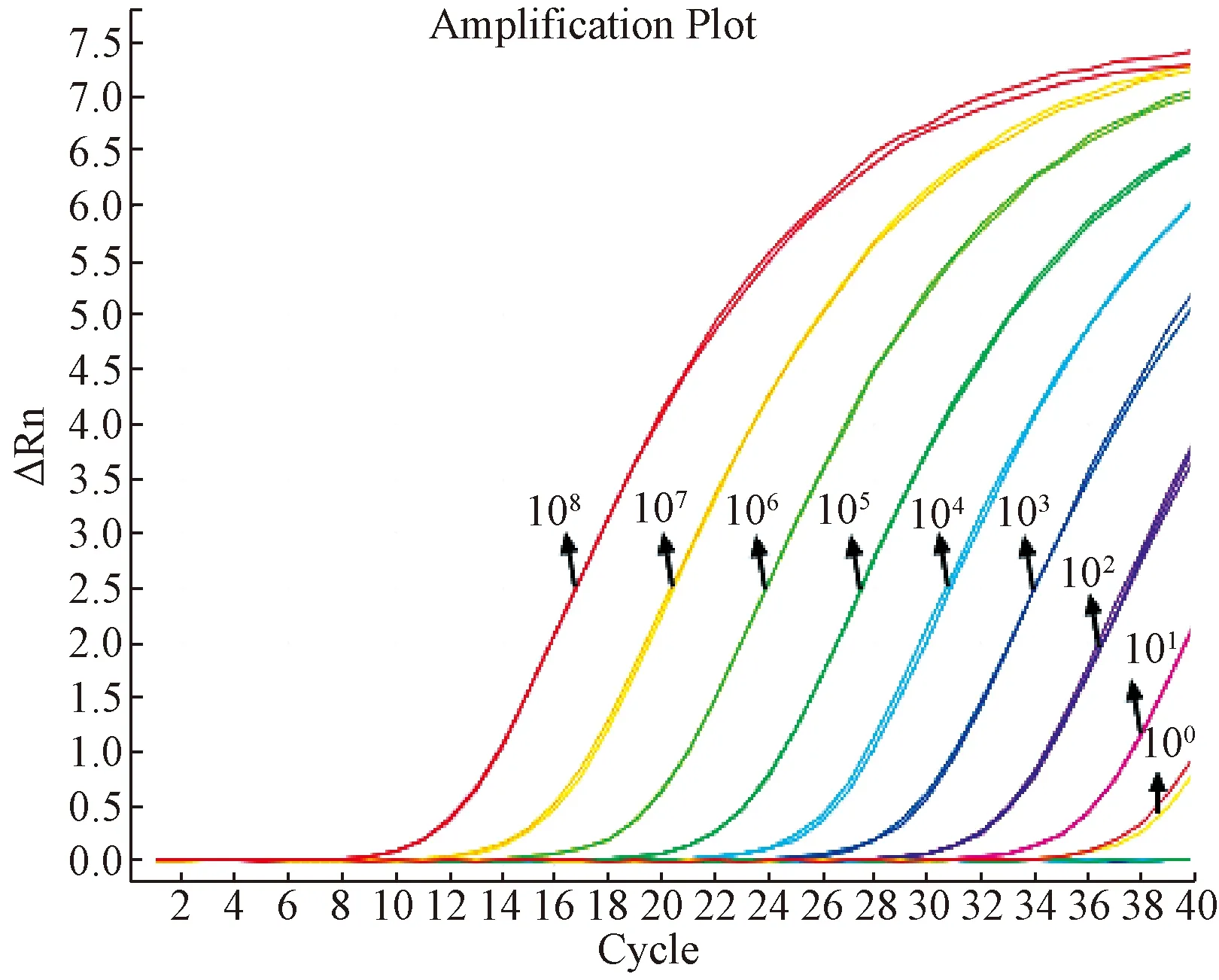
图4 1×108~1×100 copies/μL标准品的扩增曲线Fig.4 The amplification curve of 1×108-1×100 copies/μL standard
2.5 实时荧光定量PCR方法重复性和稳定性实验
起始浓度分别为1×106copies/μL、1×105copies/μL、1×104copies/μL的标准品的最终实测值的均值分别为1.083×106、0.9248×105、0.9832×104copies/μL,对应CTSD值及CV值见表3。3个浓度梯度3次重复实验Ct值的变异系数(CV)均小于5%,表明方法重复性、稳定性良好。
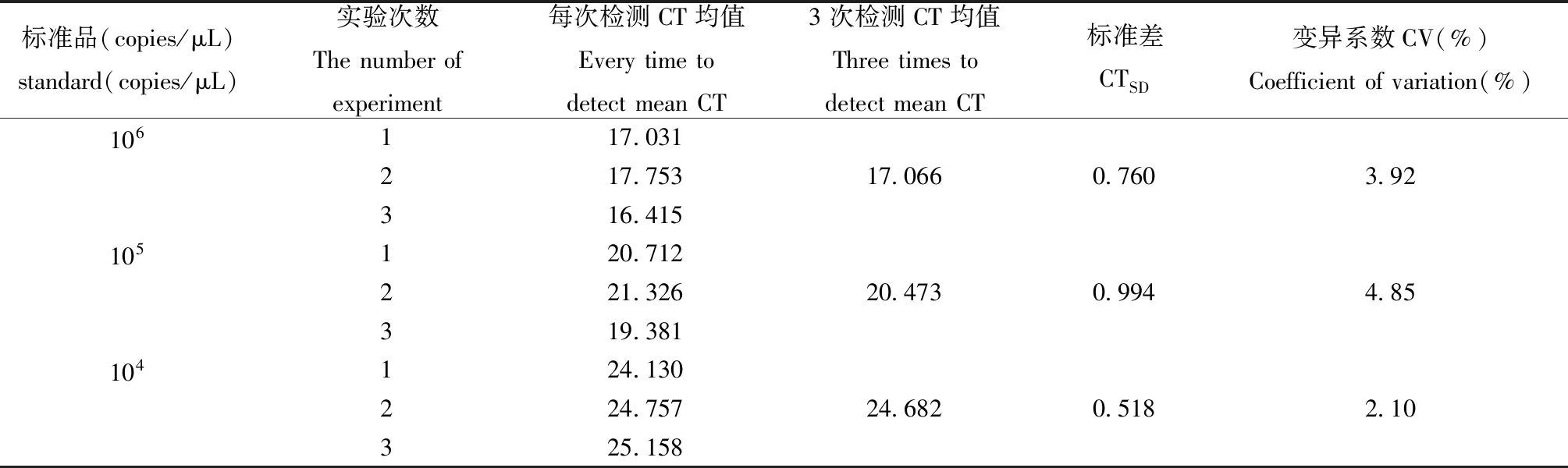
表3 荧光定量PCR检测方法的重复性和稳定性试验结果Table 3 The repeatability and stability testing results of Q-PCR
2.6 实时荧光定量PCR方法的应用
2.6.1血浆样本检测结果
利用建立的方法,对145份牛血浆样本(编号分别为X1~X145)分2次进行检测。第1次检测前64份血浆样本(编号X1~X64),第2次检测后81份血浆样本(编号X65~X145)。
在标准曲线参数符合要求、阴阳对照成立的条件下,依据结果判定标准,结果显示有6份牛血浆样本(X9、X10、X121、X133、X135、X145)BHV-1核酸阳性。其他139份样本均为阴性。145份牛血浆样本检测结果阳性率为4.14%(6/145)。
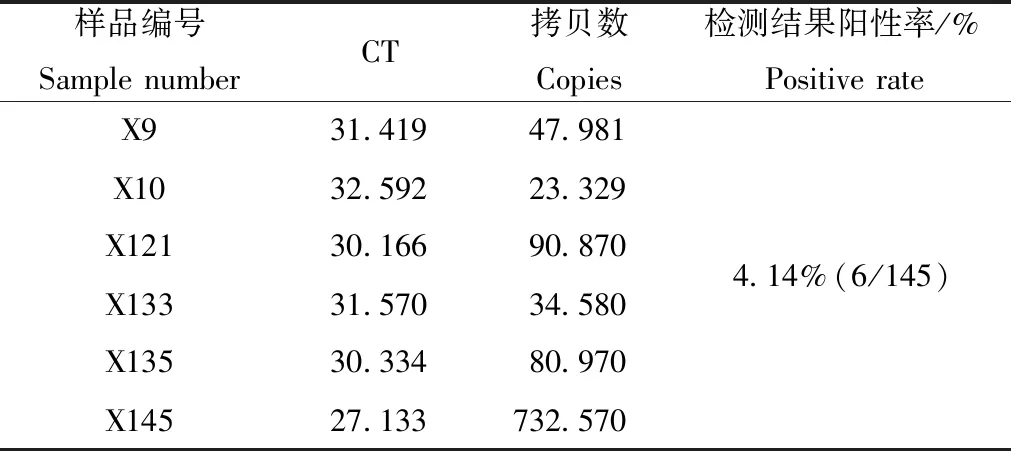
表4 荧光定量PCR方法检测145份血浆样本阳性结果Table 4 The positive results of Q-PCR to detect 145 plasma samples
样本X1~X64的扩增曲线见图5,相应的标准品扩增曲线图见图6;样本X65~X145的扩增曲线见图7,相应的标准品扩增曲线图略。2次检测标准曲线相关参数见表5。

图5 64份(X1~X64)血浆样本扩增曲线Fig.5 The amplification curve of 64 plasma samples
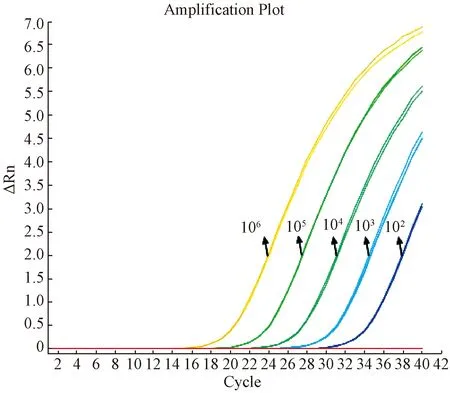
图6 检测64份血浆样本的标准品扩增曲线Fig.6 The standard amplification curve of detection 64 plasma samples

图7 81份(X65~X145)血浆样本扩增曲线Fig.7 The amplification curve of 81 plasma samples
2.5.2牛源性样本检测结果
在标准曲线参数符合要求、阴阳对照成立的条件下,结果显示36份牛源性样本均为阴性,扩增结果见图8,相应标准曲线扩增曲线图略。标准曲线参数见表5。
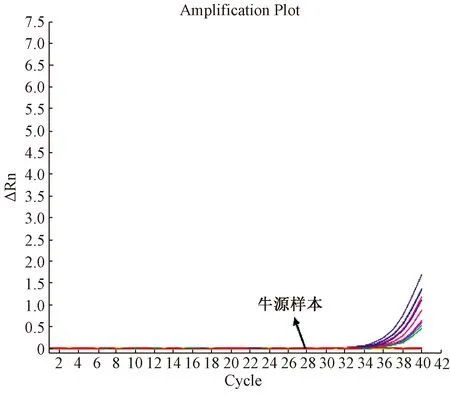
图8 36份牛源性样本扩增曲线Fig.8 The standard amplification curve of 36 bovine origin samples

表5 3次样本检测标准曲线参数Table 5 The results of Q-PCR to detect positive samples
从表5中可以看出3次样本检测标准曲线相关系数Slope均在-3~-3.5之间、R2值均≥0.99、扩增效率Eff%均在90%~110%之间,说明3次检测结果定量有效。
3 讨论
牛鼻气管炎病(疱疹病毒Ⅰ型感染)OIE将其列为(通报疾病)B类疫病,我国将其列为二类动物疫病[9-10],其传播范围广,危害大。目前国内外虽已建立了多种检测方法,包括血清学及PCR检测方法等[5-6,9-11,17,21-23],但未见有针对牛源性制品及牛源制品原辅材料外源BHV-1 检测的报道,中国药典亦没有关于牛源制品及原辅材料检测的规定[24]。中国药典在“新生小牛血清检测”中虽然有关于新生牛血清用细胞接种法和免疫荧光法检测病毒的规定,但没有更为敏感特异的分子生物学检测方法,针对人用牛源性材料及人用牛源性生物制品的检测目前在我国还几乎是空白[17]。
实验室在建立BHV-1 PCR检测方法的基础上[17],建立了操作更为简便、特异、敏感的BHV-1荧光定量PCR检测方法。其目的主要是用于牛及牛源性材料、人用牛源性生物制品潜在污染BHV-1的检测。如小牛血清去蛋白注射液、牛肉浸液、牛胆膏、牛骨粉、牛骨源性明胶,及其用于生产上述制品的原材料牛血浆、牛组织等,均可能携带外源BHV-1。制品或原材料携带的病原体及其代谢产物可能直接感染人或动物引起人和动物本身的危害,或者通过制品或原材料污染传播疾病,导致传染性疾病的流行爆发,或病毒核酸或蛋白可能导致免疫抑制、退行性病变或癌基因的活化等潜在危害[17]。
实验虽然没有从国内11个厂家和国外2个厂家的36份牛源性制品及生产制品的原材料血浆中检测出BHV-1,但是通过对来自内蒙古某饲养场和北京某饲养单位的牛血浆进行检测,发现2家单位的牛均有BHV-1感染,而且实验室之前通过PCR方法也从2家单位的牛样本中检测到BHV-1[17]。我们不仅证明了建立的方法确实可以用于牛及牛源样本BHV-1感染的检测,同时也证明用于牛源制品生产的原材料血浆中确实存在BHV-1的污染可能,无疑会给人民用药及传染病的传播带来潜在的风险。甚至有报道从BHV-1自然感染的牛的牛奶中检测到BHV-1[15],因此本实验室建立的方法不仅可以用于牛源生物制品及原辅材料的检测,还可用于牛奶等牛源性食品的检测,以保障牛源性食品的安全,防止牛鼻气管炎病的传播与扩散。
实验通过敏感性、特异性、重复性、稳定性方法学评价,证明建立的方法可用于牛及牛源性生物制品及其原辅材料携带外源病毒的检测,填补了我国在牛源生物制品检测技术方面的空白,为试剂盒的研发及检测技术的推广奠定了基础,为在全国范围内推动牛源制品及原辅材料外源BHV-1检测提供了技术支撑,同时也为制定牛源生物制品外源病毒检测技术操作规程和相关国家标准奠定了基础。
