不同毒株猪伪狂犬病活疫苗的稳定性和体液免疫效果评价
2019-12-27陈弟诗周远成陈斌周丽媛裴超信张毅李丽丁梦蝶
陈弟诗 ,周远成,陈斌,周丽媛,裴超信,张毅,李丽,丁梦蝶
(1.四川省动物疫病预防控制中心,四川 成都 610041;2.畜禽生物制品四川省重点实验室,四川 成都 610200)
猪伪狂犬病毒(PRV)是疱疹病毒科α疱疹病毒亚科的双链DNA 病毒,基因组全长约150 kb。PRV 可感染多种动物,以发热、奇痒(猪除外)、繁殖障碍、呼吸道症状和脑脊髓炎为主要特征。猪是PRV最主要的天然宿主和储存宿主,PRV 感染后的临床症状与猪的年龄、免疫状态及毒株毒力密切相关,通常情况下易感猪群年龄越小,感染后的发病率和死亡率越高,无母源抗体的幼龄仔猪感染后死亡率甚至高达100%[1-2]。PRV具有嗜神经特性,通过不同途径感染均可沿神经通路传播,定植于三叉神经节而终身带毒,在猪免疫力下降、药物刺激或应激条件下,潜伏的PRV可被激活重新复制并向环境中排出病毒[3]。目前很多国家已经成功根除该病,而我国一直存在着PRV的感染和流行,给养猪业造成了很大的经济损失。
伪狂犬病尚无特效药物可以治疗,疫苗免疫是防控该病最经济有效的方法。目前,市场上有多种疫苗可供选择,包括灭活疫苗、自然缺失弱毒活疫苗和人工基因缺失弱毒活疫苗等。鉴于PRV的嗜神经传播特性,活疫苗才是防控伪狂犬病的首选疫苗,虽然国内有灭活疫苗的推广,但灭活疫苗必须配合活疫苗的使用方能达到理想的效果,因此活疫苗的免疫效力是伪狂犬病免疫成功的关键。为评价临床上不同毒株伪狂犬病活疫苗的稳定性和免疫效力,本试验选择了市场上多个毒株的活疫苗包括Bartha K61株(进口和国产)、C 株、SA215 株、HB98 株、HB2000 株进行比较研究。希望通过不同毒株免疫效果的比较,为临床上猪伪狂犬病活疫苗的选择提供依据。
1 材料与方法
1.1 毒种、细胞与抗体检测试剂盒 猪伪狂犬病活疫苗Bartha K61 株(进口)、Bartha K61 株(国产)、C 株、SA215株、HB98株、HB2000株,均购于相应生产或代理企业,所购疫苗去除标签后随机标记为A、B、C、D、E、F。PRV gE 蛋白、gB 蛋白抗体ELISA检测试剂盒购于IDEXX,PRV XJ株由四川农业大学动物生物技术中心分离鉴定,MDBK细胞由畜禽生物制品四川省重点实验室保存提供。
1.2 实验动物 40 头体重相近、临床表现正常的DLY(杜洛克×长白×约克夏)断奶仔猪,购于四川省眉山市某猪场。所有仔猪均饲养于畜禽生物制品四川省重点实验室的动物房,严格在隔离条件下饲养。
1.3 不同疫苗的稳定性测试 将疫苗A~F 分别用配套疫苗稀释液按照瓶签标注头份数稀释,稀释后立即取稀释疫苗接种生长良好的MDBK 细胞,测定病毒含量;剩余疫苗在常温下存放,1、2、3、4 h 后分别取样测定病毒含量。添加病毒液于37 ℃5% CO2环境下培养96 h,观察细胞病变情况,使用Reed-Muench法计算结果。
1.4 免疫方案 将40头仔猪随机分为8组,每组5 头,隔离饲养7 d,观察无异常症状后分别免疫A、B、C、D、E、F疫苗(标记为1~6组),第7组免疫含有PBS稀释液的伪狂犬病活疫苗D(标记为DPBS组),第8组不免疫作为阴性对照。
免疫前和免疫后7、14、21、28 d 分别采集前腔静脉血,使用PRV gE 和gB 蛋白抗体试剂盒分别测定gE和gB抗体。选择免疫后28 d采集的血清样品,用RPV XJ株或其他毒株按照《中华人民共和国兽药典》附录记载的方法测定中和抗体,并记录结果。
2 试验结果
2.1 不同毒株伪狂犬病活疫苗稀释后的稳定性测试结果 所有立即稀释的疫苗病毒含量均大于105.5TCID50/头份,个别疫苗含量高达106.57TCID50/头份(结果见表1)。使用疫苗配套的稀释液稀释后于常温下放置不同的时间,测得不同疫苗株的稳定性差别较大。进口猪伪狂犬病活疫苗和个别国产疫苗在稀释后2 h 内稳定,大部分国产疫苗稀释后2 h 内病毒含量均有下降,某国产活疫苗稀释后1 h 的病毒含量下降达50%,稀释后4 h病毒含量仅为稀释前的14.79%,但所有疫苗稀释后4 h的病毒含量均高于105.2TCID50/头份,参照国内标准(猪伪狂犬病活疫苗的病毒含量为105.0TCID50/头份),所有疫苗均符合质量要求。
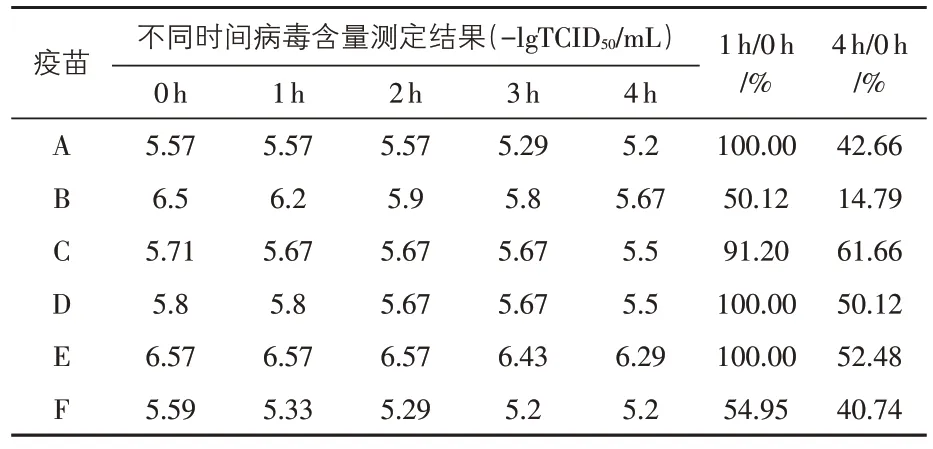
表1 不同毒株伪狂犬病活疫苗稀释后的稳定性比较
2.2 不同毒株伪狂犬病活疫苗免疫后gE 和gB ELISA 抗体的测定结果 使用PRV gB 和gE蛋白抗体ELISA试剂盒分别测定8组仔猪在免疫前和免疫后不同时间点采集的血清抗体,结果得出所有仔猪的gE 抗体均为阴性,所有仔猪在免疫后7 d的gB抗体均为阳性,在28 d内S/N值不断降低,不同疫苗间gB 抗体的变化趋势一致,通过测定的S/N值比较,不同疫苗间差异不显著(图1)。
2.3 中和抗体效价的测定结果 免疫后28 d,采集所有仔猪血清,使用新分离的伪狂犬病毒基因2型变异株XJ株进行中和抗体效价测定,结果见表2。
分别使用不同毒株进行中和抗体试验,发现6 种市售疫苗除F 外,其余疫苗免疫后28 d 对PRV 2 型变异株XJ 株的中和抗体均较低。在临床中某些疫苗携带有专用的免疫增强剂型稀释液,为验证专用稀释液能否提高疫苗免疫后的中和抗体水平,本试验选择自带专用稀释液的疫苗D 进行测定,分别使用疫苗D 自带的专用稀释液和常规PBS 缓冲液按说明稀释,然后免疫仔猪。免疫后28 d 采集专用稀释液免疫组和常规PBS 稀释液免疫组的仔猪血清,分别使用疫苗D和PRV XJ 株进行中和抗体的测定。结果显示:疫苗D无论是使用常规PBS液稀释还是使用专用稀释液稀释,其针对PRV 2型XJ株的中和抗体效价均低于10,但均能产生针对本疫苗的中和抗体。使用含免疫增强剂的专用稀释液稀释的D疫苗在免疫仔猪28 d后,中和抗体效价平均值为37.05,而使用PBS稀释液组的中和抗体效价平均值为28.93,前者明显高于后者。可见疫苗D虽然能够诱导针对自身的高效价中和抗体,但是无论是否使用免疫增强剂,均不能诱导针对猪伪狂犬病毒2型XJ株的等效中和抗体。
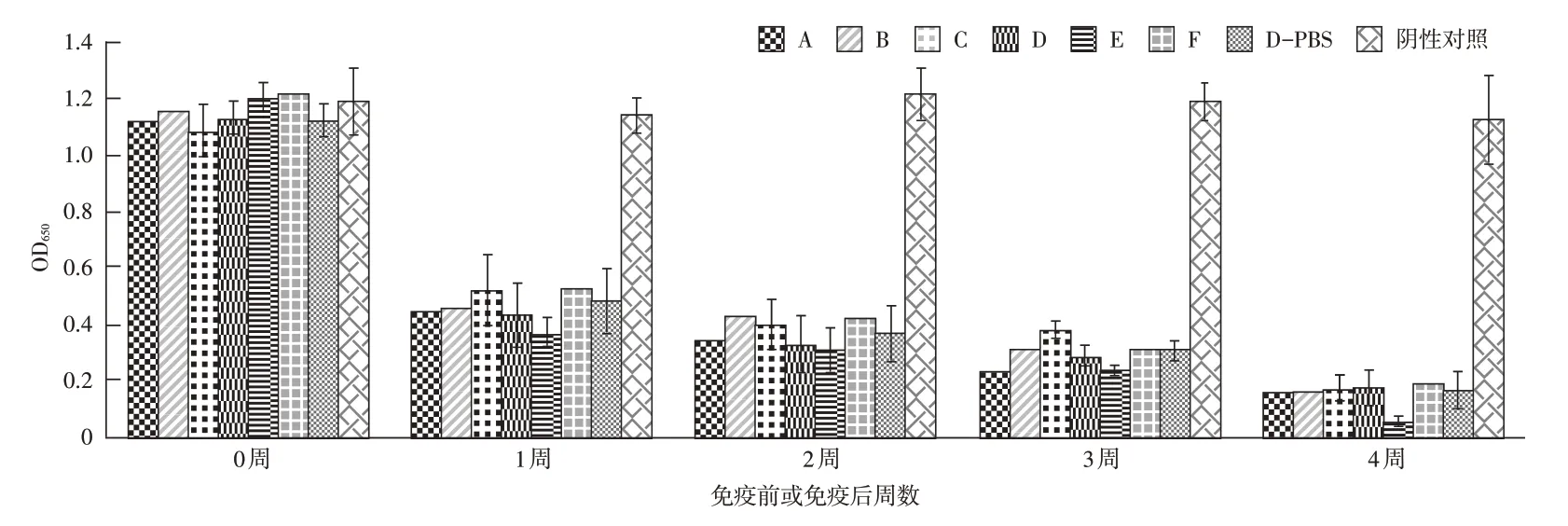
图1 不同毒株伪狂犬病活疫苗免疫后gB抗体的测定结果
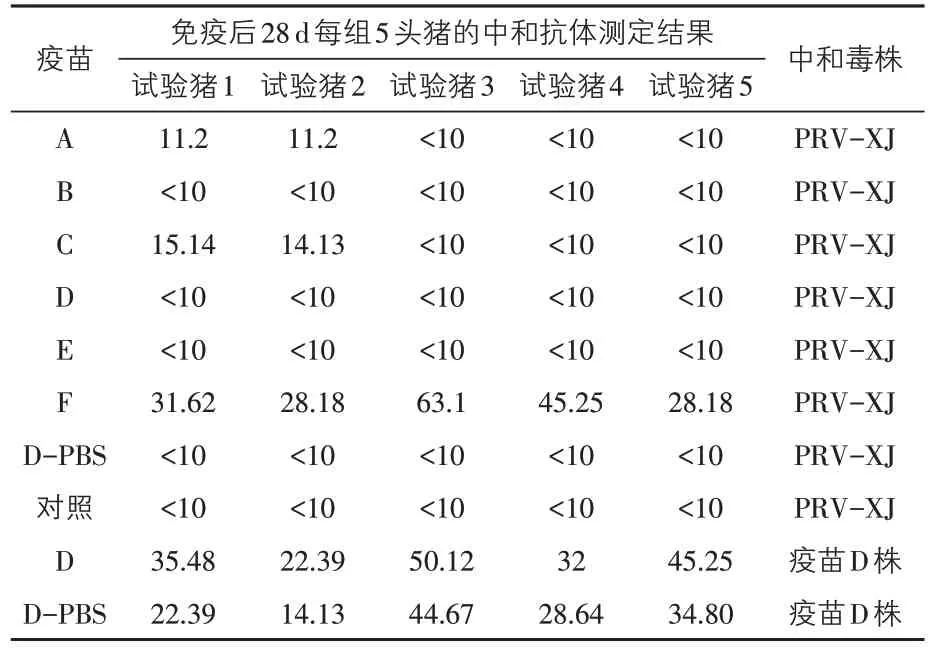
表2 不同毒株猪伪狂犬病活疫苗免疫后28 d血清中和抗体效价的测定结果
3 讨论
猪伪狂犬病毒具有疱疹病毒的典型特征,感染猪后可以潜伏在猪外周神经组织中形成隐性感染,在免疫抑制性药物、应激条件或某些疾病感染等因素的刺激下会诱发PRV 的再次复制和排毒[4]。隐性感染猪的排毒可能会对猪群造成很大的经济损失,经济损失的多少取决于猪群的群体免疫力。在猪伪狂犬病防控中,综合考虑经济效益和净化成本,猪场需要选择是执行免疫净化的策略还是免疫防控的策略。无论如何选择,当前形势下对PRV 疫苗的合理选择和使用始终是防控伪狂犬病的关键。因此,如何去评价当前临床上使用的各种猪伪狂犬病活疫苗显得尤为重要。
3.1 猪伪狂犬病活疫苗的免疫效果评价 对疫苗效果的评价主要从免疫学效果和安全性两方面入手。安全性评价可以通过观察免疫后猪群的群体表现来得到比较直观的结果。免疫学效果通常采用血清学方法或攻毒保护实验进行评价,多数疫苗的血清学抗体指标与攻毒保护率呈正相关。在临床条件下使用攻毒实验去评价猪伪狂犬病活疫苗是否对田间野毒株有效,可能会导致散毒而对猪场造成毁灭性的打击,因此使用血清学方法更为简单有效。血清学评价手段可以采用ELISA 测定免疫抗体,或者采用血清中和实验测定中和抗体。由于中和抗体测定需要一定的实验条件,而多数实验室不具备这些条件,因此临床上更多的是通过ELISA 来监控疫苗免疫效果。
本试验选择了6种不同毒株的常用疫苗来免疫仔猪,然后分别使用ELISA 和中和抗体测定两种方法来进行猪伪狂犬病活疫苗的免疫学效果评价,结果发现不同疫苗免疫后ELISA 抗体的产生规律基本一致,组间无显著性差异;而使用当前流行毒株XJ株进行中和抗体测定后发现,市售的大多数疫苗在免疫后28 d 并不能诱导针对XJ株的高效价中和抗体。因此,针对猪伪狂犬病活疫苗的免疫学效果评价,只有在使用当前流行毒株进行中和抗体测定后才能筛选到优秀的猪伪狂犬病活疫苗。
3.2 猪伪狂犬病活疫苗的稳定性评价 随着动物生物制品生产工艺的革新,科研人员开发出了多种耐热保护剂,耐热保护剂的出现使得疫苗在运输和使用过程中可以耐受更高的环境温度,与普通冻干保护剂相比,耐热保护剂在37 ℃下依然能够长时间地维持冻干疫苗滴度不发生变化,使得疫苗的运输和使用更为方便。但到目前为止,人们只关心耐热保护剂或常规保护剂在冻干状态下对疫苗的保护能力,而缺乏对冻干疫苗稀释后稳定性的研究。本试验选择了多种临床上常用的猪伪狂犬病毒冻干活疫苗,对其稀释后的稳定性进行了测试,分别使用疫苗自带的稀释液按照使用说明书进行稀释,稀释后于不同时间点取样测定不同毒株伪狂犬病活疫苗中的病毒含量,结果显示:不同疫苗稀释后的稳定性有差异,随着稀释时间的延长病毒含量持续下降,部分耐热保护剂活疫苗稀释后1 h 的病毒含量下降约50%,稀释4 h后部分疫苗病毒含量下降最高可达85.21%。这提示人们在使用疫苗时需要现配现用,不宜久置,也提示疫苗研发人员在关注冻干保护剂耐热能力的同时,还应关注冻干疫苗稀释后的稳定性。
