长链非编码RNA 00152对胰腺癌细胞增殖的影响*
2019-12-26何美玲杨喆戴研平雷珊高晓勤
何美玲,杨喆,戴研平,雷珊,高晓勤
(1.贵州医科大学 基础医学院,贵州 贵阳 550004;2.遵义医药高等专科学校,贵州 遵义 563006)
胰腺癌(pancreatic cancer,PC)是人类消化道的恶性肿瘤之一,其病情进展迅速易发生早期转移和产生化学抗性,通常患者确诊时已为晚期[1-2]。对PC治疗有手术切除、化学疗法和放射疗法等多种手段,但患者5年生存率仍低于5%[2-3]。因此,详细了解PC发病的分子机制,对寻找新的PC生物标志物和治疗策略的发展具有重要的意义。长链非编码RNA(long noncoding RNA, LncRNA)是一类长度超过200个核苷酸的不编码蛋白质的 RNA,在多种细胞病理生理过程中起着至关重要的作用,如增殖、凋亡、去分化、周期阻滞、侵袭和迁移等[4-5]。LncRNA异常表达的现象在各种肿瘤中均有发现,提示lncRNA可能是潜在的致癌或抑癌的RNA[6-9]。Linc00152是一种定位于2号染色体(2p11.2)的LncRNA[10],研究表明其在多种类型的癌症中参与肿瘤发生和转移[11-14],本课题组前期研究发现Linc00152在胰腺癌组织和细胞系中均高表达,影响胰腺癌患者的生存预后,但Linc00152在胰腺癌中的相关功能及影响尚不清楚。本研究通过干扰胰腺癌细胞株MIA PaCa-2和SW1990中Linc00152的表达,研究Linc00152对胰腺癌细胞增殖能力的影响,为寻找胰腺癌潜在的治疗靶点提供依据。
1 材料与方法
1.1 材料
胰腺癌细胞株MIA PaCa-2和SW1990购自美国ATCC细胞库,胎牛血清(FBS)、转染用OPTI-MEM培养基购自美国Gibco公司,RT试剂盒、PCR相关SYBRP、逆转录试剂盒购自鼎国生物有限公司,CCK-8试剂盒购自日本同仁化学研究所,细胞周期试剂盒购自美国Thermo公司,兔抗人单克隆抗体细胞周期蛋白D1(cyclinD1)、细胞周期蛋白依赖性激酶4(CDK4)以及鼠抗人GAPDH单克隆抗体均购自武汉赛威尔生物技术有限公司,Lipofectamine 2000和相关转染试剂盒购自Invitrogen公司,Linc00152的下调siRNA序列TAGGCGATACGATGCTTTA-3′、阴性对照(NC)序列TAATCGCTACGATGCACTA-3′及RT-qPCR相关的Linc00152和GAPDH上游、下游引物均由上海生工生物技术有限公司设计合成,Linc00152上游引物5′-AAAATCACGACTCAGCCCCC-3′、下游引物5′-AATGGGAAACCGACCAGACC-3′,GAPDH上游引物5′-GGAGCGAGATCCCTCCAAAAT-3′、下游引物 5′-GGCTGTTGTCATACTTCTCATGG-3′。
1.2 方法
1.2.1细胞培养及转染 人胰腺癌细胞MIA PaCa-2和SW1990分别培养在含10% FBS的DMEM培养基中,均放置于在5% CO2、37 ℃的培养箱中培养;根据Lipofectamine 2000操作说明转染NC及Si-Linc00152序列,实验分为阴性对照组(NC组)和Linc00152干扰组(Si-Linc00152组),细胞转染48 h后, 进行后续实验。
1.2.2实时荧时聚合酶链式反应(RT-qPCR)验证Linc00152的干扰效率 收集各组转染48 h后的细胞,在TRIzol 试剂,离心、萃取,加异丙醇沉淀,75%乙醇洗涤,DEPC水溶解,测RNA纯度和浓度。取总RNA 1 000 ng配制RT反应液,Takara逆转录试剂盒进行逆转录反应。按说明书配好PCR反应液后,瞬时离心,上实时荧光定量PCR仪扩增Linc00152以及内参基因GAPDH,通过2-(ΔΔCT)法计算Linc00152的相对表达量。
1.2.3CCK-8实验检测细胞增殖 转染48 h后,胰酶消化各组细胞株,终止消化并重悬细胞,以每孔1×103个细胞,接种到96孔培养板中;于6、24、48、72和96 h时,将 CCK-8的溶液加入每个孔中,在37 ℃下孵育2 h;取出96孔培养板上酶标仪,在450 nm处检测CCK-8的吸光度,根据吸光度描绘曲线。
1.2.4平板克隆细胞集落形成实验 转染48 h后,胰酶消化各组对数生长期的细胞株,用含10%胎牛血清的完全培养基重悬,分别接种到6 cm培养皿中,调整密度为每皿1 200个。然后在5% CO2培养箱中于37 ℃温育8 d,弃去培养基,PBS洗涤2次后,用4%多聚甲醛固定30 min后,倒掉甲醛,加入结晶紫染液染色30 min,倒掉结晶紫液,纯水清洗、拍照,并计数染色的集落形成数目。
1.2.5流式细胞仪检测细胞周期 分别将转染48 h后的各组细胞株接种于6孔板培养72 h,胰酶消化,调整细胞密度1×107个/L,70%乙醇-20 ℃固定过夜后,离心弃上清,加PBS洗净重悬,加入RNA酶、碘化丙啶在37 ℃下避光放置30 min,最后上流式细胞仪检测细胞周期。用CellQuest 软件、ModFit 软件分析实验结果,统计学方法分析各组细胞周期的分布。
1.2.6Western blot检测细胞周期相关蛋白cyclinD1及CDK4表达 取出转染48 h后的各组PC细胞株,加RIPA蛋白裂解液,低温离心,提取总蛋白,加入BCA显色剂,制作标准曲线。蛋白变性10 min,按配方配制SDS-PAGE胶,电泳,转PVDF膜,室温封闭2 h,加一抗4 ℃孵育过夜;次日加二抗于摇床上室温孵育2 h。上曝光机,加ECL化学发光混合液,曝光显影,Image J软件用于分析蛋白质条带的灰度值,统计图分析蛋白表达量。
1.3 统计学处理

2 结果
2.1 转染效率及干扰效率
利用siRNA构建干扰模型 48 h,与NC组比较, Si-Linc00152组的Linc00152表达水平明显降低,差异有统计学意义(P<0.01),见图1。

注:(1)与NC组比较,P<0.01。图1 转染后胰腺癌细胞Linc00152相对表达量Fig.1 The relative expression of Linc00152 after transfection
2.2 干扰Linc00152后胰腺癌细胞增殖能力受到抑制
通过转染Si-Linc00152干扰Linc00152的表达,结果显示,在72和96 h两个时间节点,Si-Linc00152组较NC组的增殖能力显著降低,差异有统计学意义(P<0.01),见图2。
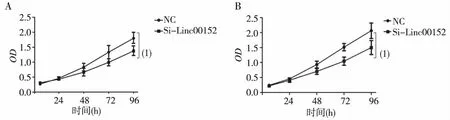
注:A为MIA PaCa-2,B为SW1990;(1)与NC组比较,P<0.01。图2 干扰Linc00152表达对胰腺癌细胞增殖能力的影响 (CCK8法)Fig.2 Effect of knockdown Linc00152 on the cell proliferation of pancreatic cancer cells by CCK8 assay
2.3 干扰Linc00152后胰腺癌细胞克隆形成能力受到抑制
收集经转染48 h后的各组胰腺癌细胞,细胞在培养皿中培养8 d后,NC组MIA PaCa-2集落形成的数量为(548.3±11.6)个、Si-Linc00152组为(245.0±9.8)个,NC组SW1990集落形成的数量为(562.3±14.1)个、Si-Linc00152组为(306.0±8.4)个,Si-Linc00152组均较NC组的细胞集落形成数目明显减少,差异有统计学意义(P<0.01),见图3。
2.4 干扰Linc00152可以阻滞胰腺癌细胞周期于G0/G1期
与NC组比较,Si-Linc00152组在细胞周期中的G1期细胞所占百分比上升,差异有统计学意义(P<0.01),见图4。提示干扰Linc00152可诱导胰腺癌细胞在G0/G1期细胞周期阻滞。
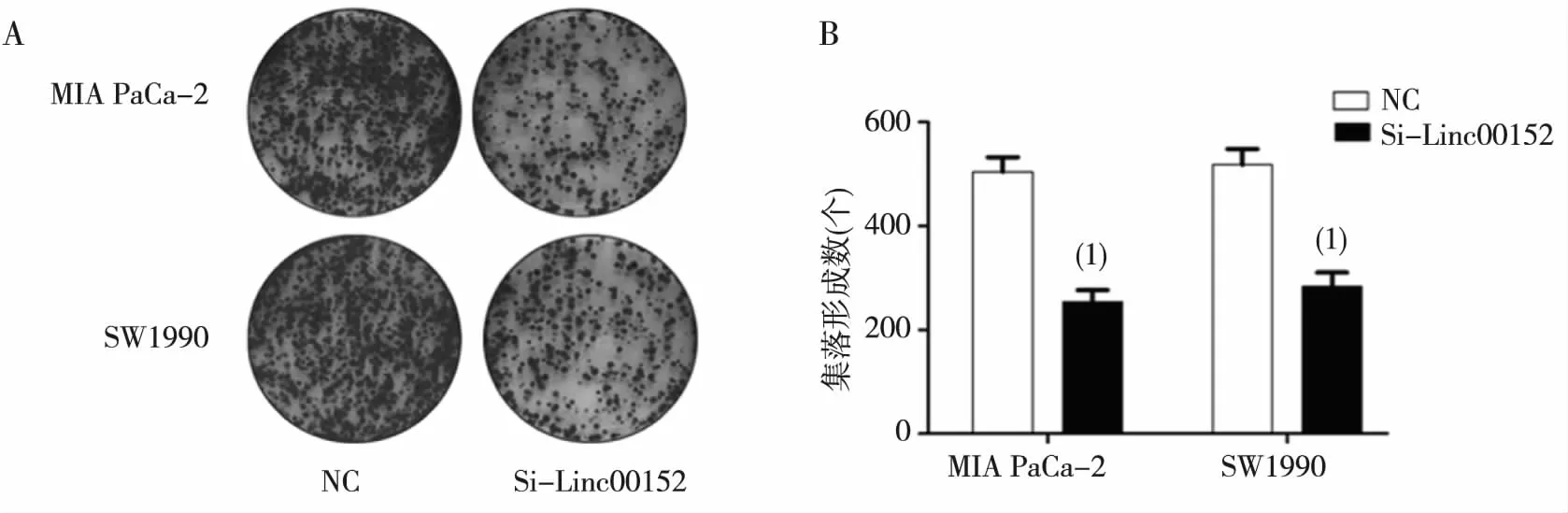
注:A为平板克隆实验,B为细胞集落形成数;(1)与NC组比较,P<0.01。图3 干扰Linc00152表达对胰腺癌细胞增殖的影响(克隆形成实验)Fig.3 Effect of knockdown Linc00152 on the cell proliferation of pancreatic cancer cells by colony formation assay
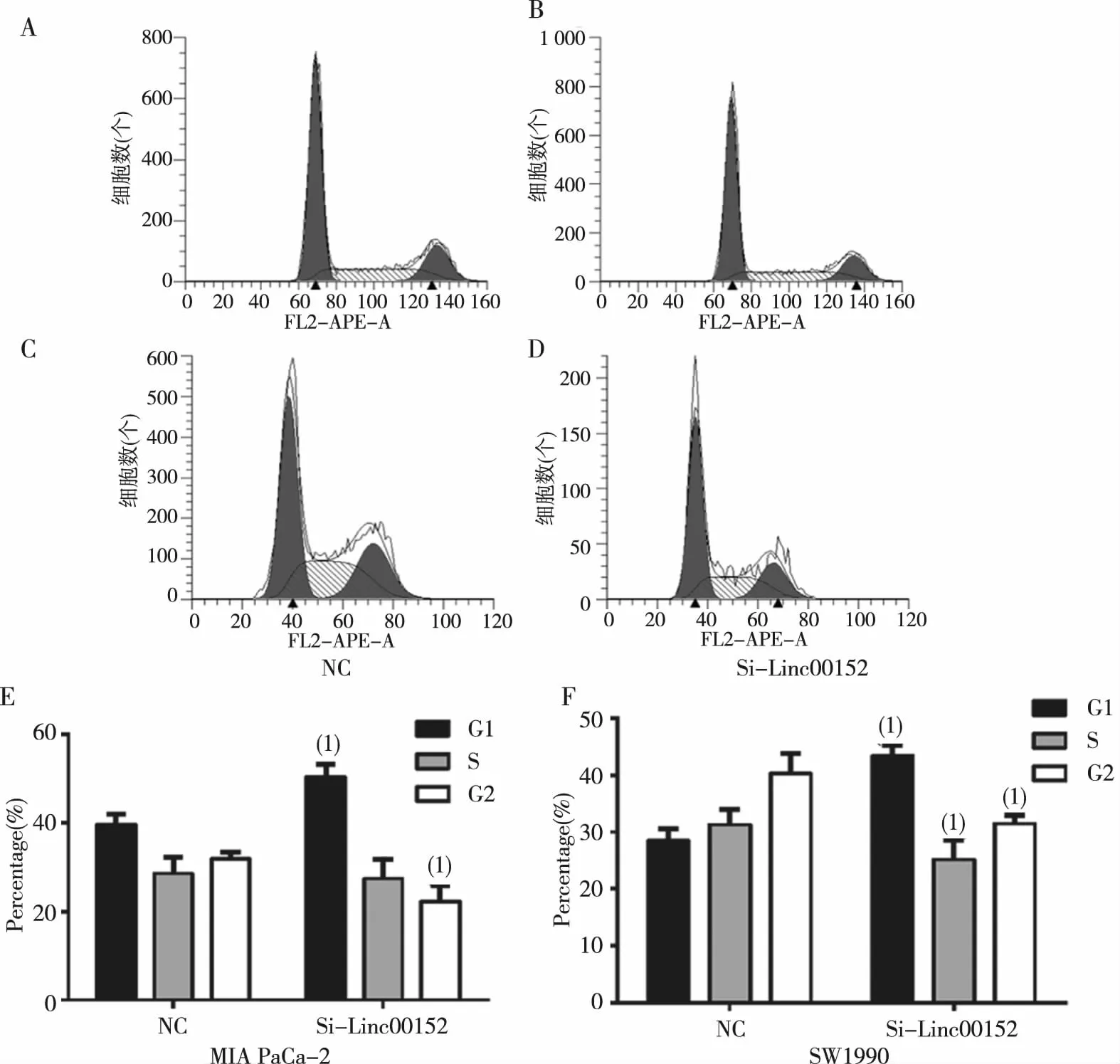
注:A~D为流式细胞图,E、F为直条图,A、B、E为MIA PaCa-2,C、D、F为SW1990,A、C为NC组,B、D为Si-Linc00152组;(1)与NC组比较,P<0.01。图4 干扰Linc00152表达后对细胞周期的影响 (流式细胞术) Fig.4 Effect of knockdown Linc00152 on cell cycle of pancreatic cancer cells by FCM
2.5 干扰Linc00152表达后cyclinD1和CDK4蛋白表达
Western blot检测转染48 h时MIA PaCa-2和SW1990细胞蛋白表达水平变化,实验显示,与NC组比较,Si-Linc00152组的细胞周期相关蛋白cyclinD1及CDK4的表达均减少,差异有统计学意义(P<0.01),见图5。提示干扰Linc00152抑制了胰腺癌细胞株的增殖能力,诱导细胞在细胞周期G0/G1期停滞,可能与细胞周期相关蛋白cyclinD1及CDK4的表达减少有关。
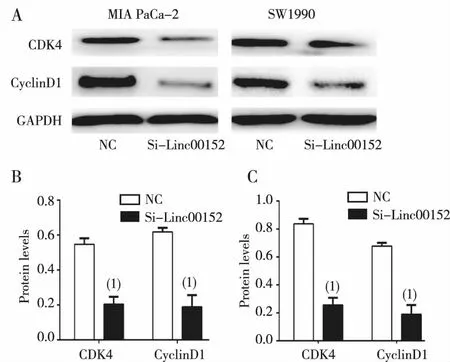
注:A为Western blot结果,B、C分别为MIA PaCa-2、SW1990条图;(1)与NC组比较,P<0.01。图5 干扰Linc00152表达后对胰腺癌细胞中CyclinD1及CDK4蛋白表达的影响Fig.5 The expression of CyclinD1and CDK4 proteins after knocking down Linc00152
3 讨论
LncRNA已成为基因表达的关键调节因子,并在各种癌症的发生和进展中发挥关键作用[15]。Linc00152(长基因间非编码RNA 152),是一类与癌症相关的828 bp的lncRNA,定位于2号染色体短臂(2p11.2)[16]。有研究表明,Linc00152的高表达与肿瘤进展、淋巴结侵袭和TNM分期进展呈正相关[17],并且在体外和体内促进肿瘤进展[18]。尽管Linc00152逐步被证实为多种人类恶性肿瘤形成的重要的基因表达调控器,但是其与胰腺癌的关系却尚不清楚。在本实验室前期研究中,发现在Linc00152胰腺癌细胞株和组织中均高表达,且与生存预后密切相关。本研究中,CCK8实验结果显示干扰Linc00152表达后胰腺癌细胞的增殖能力明显降低;平板克隆实验结果表明,沉默Linc00152后胰腺癌细胞克隆数目显著降低;结果表明干扰Linc00152的表达可抑制MIA PaCa-2和S1990细胞的增殖能力。细胞周期主要由细胞周期蛋白依赖性激酶(CDK)驱动,CDK通过在不同细胞周期阶段与细胞周期蛋白(cyclin)结合形成特异性复合物而被激活,并促进细胞通过G1/S期调控点进入S期进行DNA复制,因此促进细胞增殖,异常调节的CDK会诱导细胞不定期增殖[19]。流式细胞术实验表明,沉默Linc00152的表达后G1期MIA PaCa-2和S1990细胞增多,发生细胞周期阻滞;沉默Linc00152后cyclinD1和CDK4的表达下调,而cyclinD1和CDK4是细胞周期G1 向S期转换的调节剂,因此干扰Linc00152能延长G1期的持续时间,阻碍G0/G1到S期的转变,导致细胞在细胞周期G0/G1期停滞,抑制了细胞的增殖。
综上所述,本研究证实干扰Linc00152在体外能抑制胰腺癌细胞株的增殖,显示了Linc00152在胰腺癌发生发展过程中的调控作用,为胰腺癌的分子靶向治疗提供了思路和依据。目前对Linc00152的机制研究仍然不完整,其具体的作用途径及分子生物学机制尚未明确,还需要进一步的探索及研究。
