人肠道来源样品中肺炎克雷伯菌的分离及特征研究*
2019-12-26洪伟钱声艳吴昌学饶凤琴程玉梅张婷齐晓岚禹文峰官志忠
洪伟,钱声艳,吴昌学**,饶凤琴,程玉梅,张婷,齐晓岚,禹文峰,官志忠
(1.贵州医科大学 地方病与少数民族疾病教育部重点实验室&贵州省分子生物学重点实验室,贵州 贵阳 550004;2.贵州医科大学附院 ICU,贵州 贵阳 550004)
肺炎克雷伯菌属于肠杆菌科(Enterobacteriaceae),是一种革兰阴性的兼性厌氧菌[1]。对于医院内住院、患有严重基础疾病(如糖尿病、慢性酒精中毒或肺阻塞)或免疫功能受损的病人,肺炎克雷伯感染可引起尿路感染、败血症肺炎、化脓性肝脓肿和危及生命的败血症[2]。在亚洲(中国和韩国等)肺炎克雷伯菌是引起肝脓肿的主要病原体,这种现象在欧美国家却很少见[3-5]。有研究表明肝脓肿的发病机制是由于肠道定植肺炎克雷伯菌入侵肠道黏膜、进入门静脉或上行感染胆道而引起[6]。随着肺炎克雷伯肺炎发病率和致死率逐年增高,有关该菌的基础研究也日益受到重视[7-8]。目前,经典肺炎克雷伯菌和高致病性肺炎克雷伯菌(hypervirulentK.pneumoniae, hvKp)是医院的主要流行菌株,对医疗系统造成了严重的威胁[9-11]。造成这种现象的主要原因是肺炎克雷伯菌能够产生β内酰胺酶[12],且随着广谱抗菌药物的广泛使用,肺炎克雷伯菌的耐药性日益增加[13-15]。重症监护病房(intensive care unit, ICU)病人因基础病情多样、复杂,肺炎克雷伯菌感染率居高不下。因此,检测肺炎克雷伯在ICU的感染情况和耐药性对于控制肺炎克雷伯感染和治疗具有重大意义。本研究采集ICU住院病人肠道来源样品(粪便)分离肺炎克雷菌,并研究分离菌株对常用胃肠道感染抗生素的耐药性及其分类地位,以期为临床诊疗提供参考。
1 材料与方法
1.1 材料
1.1.1菌株与试剂 肺炎克雷伯菌从医院ICU病房患者粪便样品分离得到。酵母粉(Oxoid,英国),哥伦比亚培养基(columbia medium)、胰蛋白胨、氯化钠、琼脂粉、红霉素、克拉霉素、链霉素、四环素、氯霉素购买于索莱宝(Solarbio),诺氟沙星、阿莫西林、甲砜霉素、甲硝唑及克林霉素均购自上海阿拉丁生化科技股份有限公司。
1.1.2主要仪器 电子天平购自上海浦春计量仪器有限公司,压力蒸汽灭菌锅购自上海医疗申安医疗器械厂,移液器购自德国 Eppendorf 公司,PCR 扩增仪购自美国 ABI 公司,DYY-7C 型电泳仪购自北京六一有限公司,超净工作台(苏州安泰空气技术有限公司),隔水式电热恒温培养箱购自苏州安泰空气技术有限公司。
1.2 方法
1.2.1细菌培养条件及培养基的配制 按照厂家说明书称取哥伦比亚培养基40 g加蒸馏水溶解至1 L,另在电子天平上准确称取胰蛋白胨10 g、酵母浸粉5 g及氯化钠10 g加入双蒸水定容至 1 L,配制Luria-Bertani(LB)培养基;固体培养基配制时需加1.5%的琼脂粉,以上培养基均需高压灭菌 30 min。细菌在以上2种培养基上涂板,37 ℃静置培养即可生长良好。实验所用抗生素因其化学性质不同,故而用特定溶剂溶解并根据溶解度配制成浓度不同的工作液备用,使用抗生素的种类及浓度分别为阿莫西林(2.5 mg/L)、甲硝唑(10 mg/L)、克林霉素(10 mg/L)、链霉素(50 mg/L)、氯霉素(10 mg/L)克拉霉素(30mg/L)、红霉素(10 mg/L)、四环素(10 mg/L)、甲砜霉素(10 mg/L)及诺氟沙星(50 mg/L),以上抗生素溶解完成后均需使用0.22 μm过滤器过滤除菌。
1.2.2菌株的分离及鉴定 从ICU病房取病人粪便样品,用磷酸缓冲液处理样品,取50 μL处理后的粪便样品涂布于哥伦比亚选择培养基上;涂布完成后,将平板静置于隔水式电热恒温培养箱内,37 ℃需氧培养18~24 h,挑选菌落形态疑似肺炎克雷伯菌的单菌落(与质控菌株比较)。酪氨酸转氨酶基因(tyrB)是肺炎克雷伯菌特异性分子标记,可用于初筛分离平板上形成的菌落,缩小测序范围,所用引物见表1。PCR反应程序为94 ℃预变性5 min,94 ℃变性30 s、55 ℃退火30 s、68 ℃延伸1 min,30个循环,68 ℃最后延伸5 min。tyrB阳性菌株,使用平板划线法纯化细菌并接入LB液体培养基培养8~12 h,油镜观察菌悬液(放大倍数100倍)。显微镜下细菌形态为均一杆状时,PCR扩增16S rDNA并送至上海生工生物工程有限公司测序,测序结果利用NCBI(https://www.ncbi.nlm.nih.gov/)的BLAST程序比对,确定菌种种属。

表1 引物列表Tab.1 Primer list
1.2.3菌株的培养及生长曲线测定 在最适培养条件下(37 ℃静置培养),以0.1%(V/V)的接种量,将纯化好的肺炎克雷伯菌液接入新鲜的LB培养基,刚接种时,每隔3 h取出1 mL浊度计仪600 nm处测定吸光度值(OD)值;12 h之后,每隔12 h测1次OD值,根据OD值绘制肺炎克雷伯菌生长曲线。
1.2.4琼脂稀释法(Agar Dilution)测定菌株耐药性 参照国际抗生素敏感实验标准,根据美国临床和实验室标准协会(clinical and laboratory standards institute, CLSI)(2017)标准确定各抗生素的耐药折点,将药物的最高浓度设定为耐药折点的2倍。诺氟沙星耐药折点为128 mg/L,则琼脂稀释平板浓度依次为0.0、0.5、1.0、2.0、4.0、8.0、16.0、32.0、64.0、128.0、及256.0 mg/L,其余抗生素也按此方法进行琼脂稀释。用直尺绘制6×6方格,每个平板接14株菌,且每株菌设置3个重复,即每3个格子接1株菌,每格加菌悬液1.5 μL;另设置不添加任何抗生素的LB培养基为对照,菌株在不同抗性培养基与对照组中均设置3个重复;点板完成后,将平板静置于恒温培养箱37 ℃需氧培养16 ~24 h,肉眼观察肺炎克雷伯菌的生长情况,判读最低抑菌浓度 (minimal inhibitory concentration,MIC)、MIC50及MIC90值(MIC50及MIC90指在一批实验中能抑制50%或90%受试菌生长所需抗生素浓度)。
2 结果
2.1 肺炎克雷伯菌菌落、菌体形态及生长曲线
肺炎克雷伯菌在哥伦比亚培养基上形成白色、直径2 ~ 5 mm菌落(图1A和图1B),菌落不透明、边缘光滑。用牙签挑取菌落时,菌落具有黏性、可拉丝。在液体哥伦比亚培养基中,37 ℃静止培养肺炎克雷伯菌3 h进入对数生长期,对数生长期24 h结束,最大OD600值为2.0,继续培养无菌体自溶现象(图1C)。在油镜下,革兰染色为阴性(红色),菌体呈短杆状(图1D,红圈区域)。

注:A:肺炎克雷伯菌QSY-1在平板上的菌落形态;B:肺炎克雷伯菌QSY-2在平板上的菌落形态;C:肺炎克雷伯菌QSY-1生长曲线;D:肺炎克雷伯菌QSY-1革兰氏染色结果。图1 肺炎克雷伯菌菌落、菌体形态及生长曲线Fig.1 Colony, morphology and growth curve of Klebsiella pneumoniae
2.2 分离肺炎克雷伯菌株BLAST比对
从54份ICU粪便样品中,分离到14株菌落形态疑似肺炎克雷伯的菌株,携带率26%;使用PCR方法扩增这些菌株的16S rDNA并送测序后,NCBI BLAST比对结果确认为肺炎克雷伯菌,菌株根据分离顺序分别命名为QSY-1 到 QSY-14(表2)。
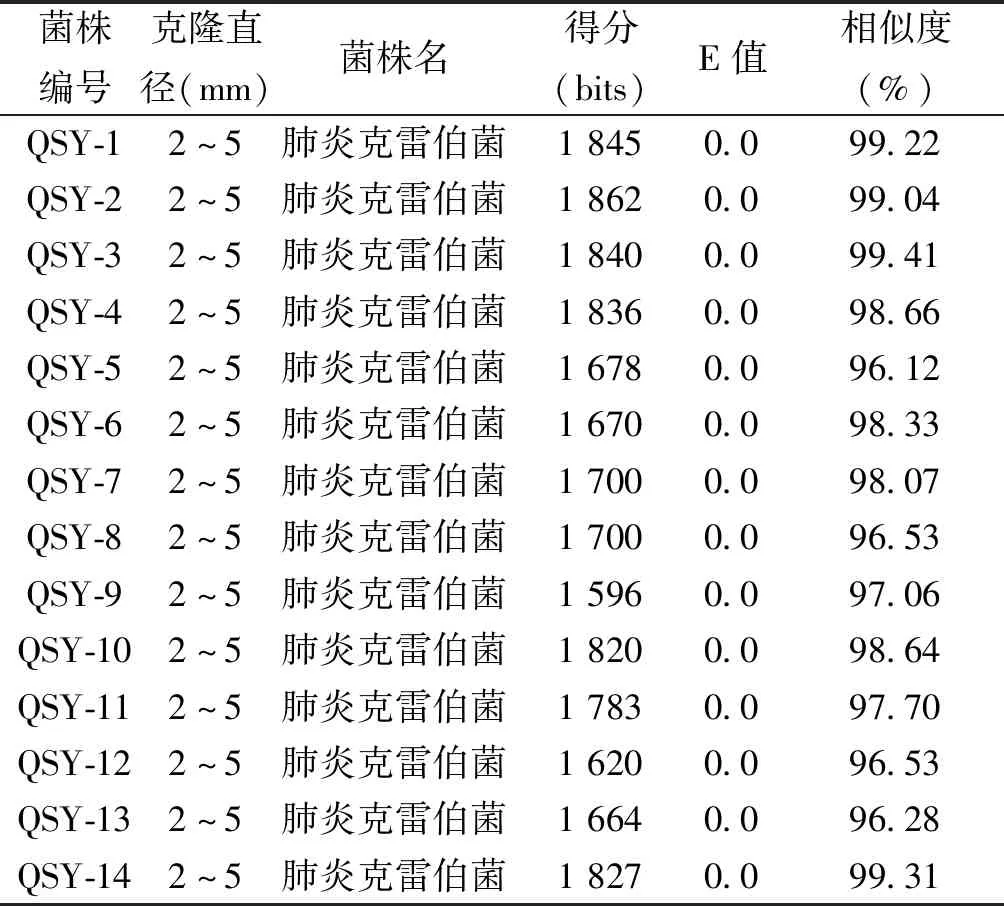
表2 16S rDNA序列Blastn比对结果Tab.2 The Blastn results of 16S rDNA sequences
2.3 ICU分离肺炎克雷伯菌进化发育分析
以常见肠杆菌科标准菌株16S rDNA作为参照,构建分离的14株肺炎克雷伯菌的系统进化树。ICU分离肺炎克雷伯菌在进化树上形成独立簇,远离欧、美地区分离的肺炎克雷伯菌标准菌株(klebsiellapneumoniaesubsp.),与新加坡分离菌株Klebsiellasingaporensisstrain LX3亲缘关系较近。聚集为一簇的ICU分离肺炎克雷伯菌可进一步分为两个分支,其中QSY-13、QSY-14、QSY-2、QSY-5、QSY-9、QSY-3、QSY-11、QSY-12、QSY-4、聚为一个分支;QSY-1、QSY-8、QSY-6、QSY-7、QSY-10聚为一个分支(图2)。
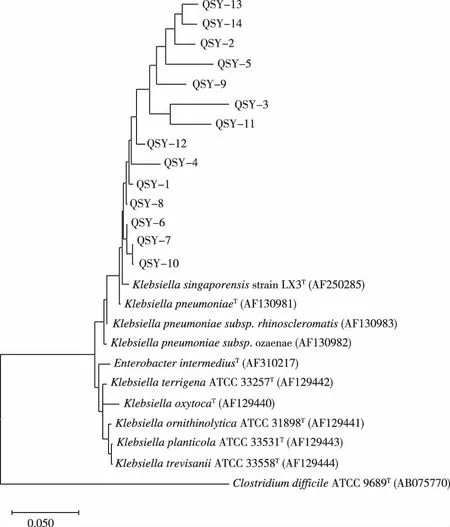
图2 基于菌株16s rDNA序列的系统发育树Fig.2 The phylogenetic tree based on 16S rDNA sequence of strain
2.4 14株肺炎克雷伯菌对10种抗生素的耐药性
如表4所示,14株菌对红霉素、克拉霉素、链霉素、四环素、氯霉素、阿莫西林、甲砜氯霉素、甲硝唑和克林霉素均具有耐药性,耐药率为100%。14株菌对诺氟沙星均不具有耐药性,耐药率为0.0%。见表3。
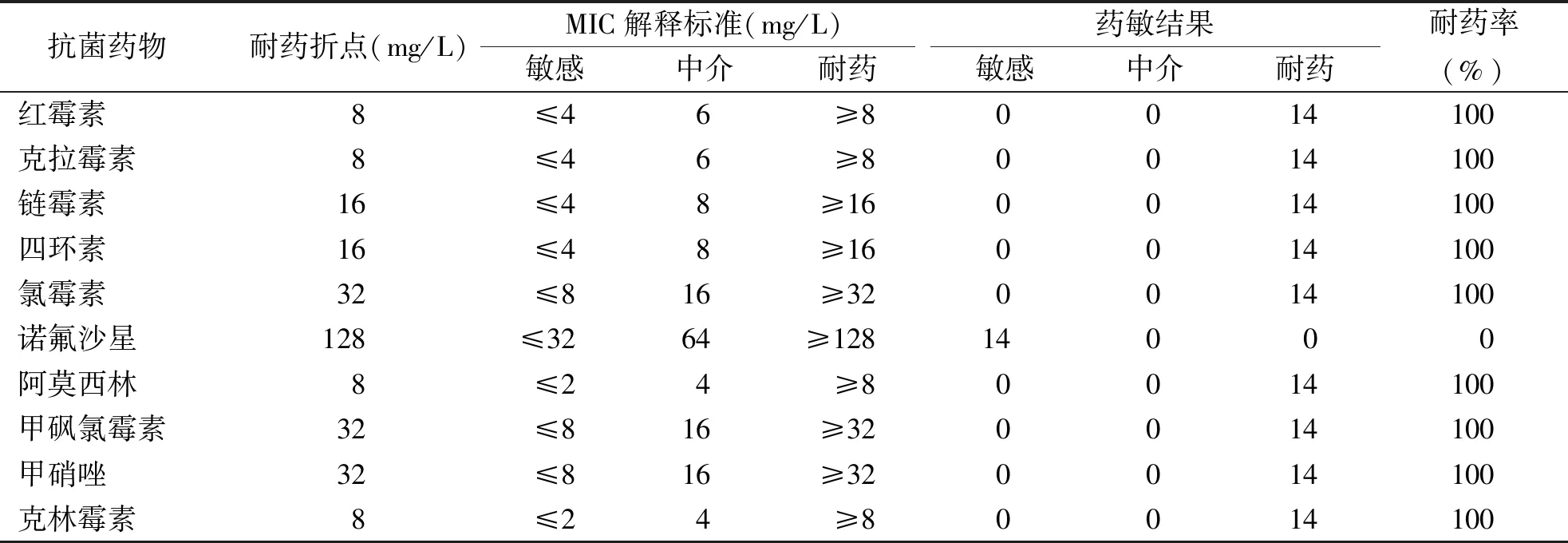
表3 14株肺炎克雷伯菌对常用肠道感染抗生素的耐药性Tab.3 Resistance of 14 strains of Klebsiella pneumoniae to commonly used antibiotics for intestinal infections
2.5 14株肺炎克雷伯菌rmpA和khe基因鉴定
结果显示,Mucoid phenotype A(rmpA)和溶血素(hemolysin)基因(khe)是肺炎克雷伯菌高毒力的分子标记。14株分离的肺炎克雷伯菌株中QSY-1、QSY-4、QSY-7、QSY-10、QSY-11、QSY-6、QSY-9基因型为rmpA-khe+,占50%;QSY-2、QSY-12、QSY-5、QSY-13基因型为rmpA+khe+,占29%;QSY-3基因型为rmpA-khe-,占7%;QSY-8、QSY-14基因型为rmpA+khe-,占14%。见表4。
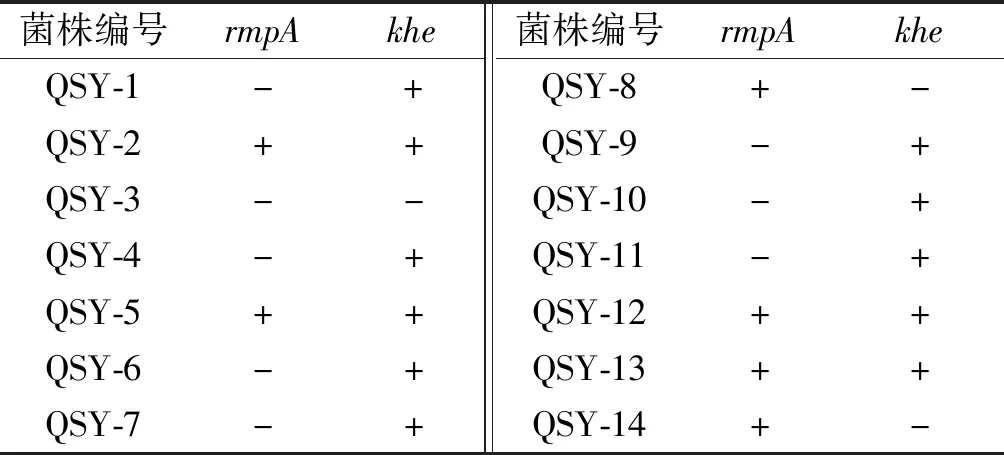
表4 4株肺炎克雷伯菌rmpA和khe基因鉴定Tab.4 Identification of rmpA and khegene of 14 Klebsiella pneumoniae
注:“+”表示有这种毒性基因,“-”表示无这种毒性基因。
3 讨论
在欧美肺炎克雷伯菌定置率位5%~35%[16-17]。在亚洲,如马来西亚、新加坡、日本、泰国、越南和韩国,肺炎克雷伯菌在健康人肠道中的定植率分别为87.8%、61.1%、18.8%、52.9%、41.3%和21.1%[2,18]。本研究采集了54位ICU住院病人粪便样品,其中14位病人检出肺炎克雷伯菌,定植率为26%,提示贵州地区ICU病房肺炎克雷伯菌在肠道中的定植率低于亚洲平均水平;其次,本研究观察了菌株形态和生长特征,并构建了其进化树,同时测定了14株菌对常见治疗肠道感染的抗生素的耐药性,发现ICU分离肺炎克雷伯对90%的测试抗生素具有耐药性,仅对诺氟沙星敏感。最后,本研究利用PCR方法发现14株菌种rmpA+khe+双阳性菌株占比高达29%,提示在ICU病人肠道可能是高致病性克雷伯菌的主要来源。
在进化分类特征上,贵州ICU分离的肺炎克雷伯菌具有明显的地域特征,在进化树上与欧、美菌株的距离较远,与亚洲分离菌株的分类距离较近(新加坡分离株)。本研究发现14株肺炎克雷伯菌形成两个独立的分支,提示在进化地位相近的同时,菌株与菌株之间也存在明显的差异,这一观点在后续rmpA和khe鉴定过程中也得到了印证。以上结果表明,肺炎克雷伯菌具有区域特征,这些特征可能是肺炎克雷伯菌在贵州地区长期进化的结果。
分离肺炎克雷伯菌菌株中rmpA和khe两个基因的携带状态不尽相同,提示菌株与菌株之间存在较大的毒素基因型差异。高毒力肺炎克雷伯菌(hypervirulentK.pneumoniae,hvKp)比传统肺炎克雷伯菌具有更高的毒力。在过去的30年中,hvKp在亚洲流行性和致病性呈增长趋势[19-20]。Mucoid phenotype A(rmpA)溶血素基因(hemolysin,khe)是hvKp的分子标记[21],本次在ICU分离的肺炎克雷伯菌种,含毒性基因的菌株(包含rmpA或khe)占比高达93%(非毒性菌株仅占7%),其中mpA-khe+占50%、rmpA+khe+占29%、mpA+khe-占14%。值得注意的是rmpA+khe+双阳性菌株占比高达29%,提示在ICU病人肠道可能是高致病性克雷伯菌的主要来源。因此,不同毒素基因型在致病力上是否存在差异是未来研究的重要方向,值得进一步深入研究。
