人肠道来源艰难梭菌感染Caco-2细胞对NF-κB信号通路相关蛋白表达的影响*
2019-12-26洪伟饶凤琴吴昌学赵行行程玉梅张婷齐晓岚禹文峰官志忠
洪伟,饶凤琴,吴昌学**,赵行行,程玉梅,张婷,齐晓岚,禹文峰,官志忠
(1.贵州医科大学 地方病与少数民族疾病教育部重点实验室&贵州省分子生物学重点实验室,贵州 贵阳 550004;2.贵州医科大学附院 ICU,贵州 贵阳 550004)
艰难梭菌(Clostridioidesdifficile)是一种革兰染色阳性且专性厌氧的产芽孢杆菌,是导致艰难梭菌相关性腹泻的主要病原菌[1],艰难梭菌感染(Clostridioiesdifficileinfection,CDI)的临床表现可从轻度自限性腹泻到可致命的伪膜性结肠炎[2-3]。正常情况下,人群肠道内微生物处于动态平衡状态,抗生素的使用会扰乱肠道内微生物群落的平衡,进而导致有益微生物种类和数量减少,对艰难梭菌的阻遏效应被解除。阻遏效应解除后,艰难梭菌迅速占据肠道生态位,大量繁殖并产生毒素A(toxinA,TcdA)和毒素B(toxinB,TcdB),这些毒素损伤肠上皮细胞、导致肠道炎症,最终导致CDI的发生[4]。在CDI发生的过程中,艰难梭菌黏附于肠细胞,引发免疫反应[5]。真核细胞核因子(nuclear factor-kappa B,NF-κB)信号通路被认为是细胞内调控细胞炎症产生的主要信号转导通路[6-7],研究认为TcdA可在体外激活单核细胞NF-κB信号通路[8],用纯化的艰难梭菌毒素感染巨噬细胞会激活炎症相关通路NF-κB信号通路、且艰难梭菌毒素会引起小鼠肠道炎症反应[9-10]。目前尚无艰难梭菌感染人克隆结肠腺癌细胞(Caco-2)是否会引起NF-κB信号通路激活的研究报道,本研究探讨艰难梭菌感染Caco-2细胞与NF-κB信号通路相关蛋白的表达关系,为防治CDI提供新思路。
1 材料与方法
1.1 主要试剂与仪器
DMEM培养基和胰酶购自Hyclone公司,胎牛血清购自Gibco公司;革兰染料和BHI脑心浸液琼脂培养基购自Solarbio公司,艰难梭菌纯化毒素A、毒素B、兔抗IκBα、P-p65、p65、IKKα及辣根过氧化物酶标记山羊抗兔二抗均购自Abcam公司;SuperSignal West Pico化学发光底物、蛋白分子量标准购自Absin公司,细胞核荧光染料DAPI购自上海碧云天生物技术有限公司,PVDF膜购自Immobilon公司,厌氧产气袋购自日本三菱公司。
1.2 方法
1.2.1细菌培养 艰难梭菌菌株由贵州医科大学重症监护科患者粪便样品分离[11],接种于新鲜配制的BHIS培养基,37 ℃厌氧(80% N2,10% H2,10% CO2)培养48 h,生化鉴定、传代。液体培养24 h后2 000 r/min、4 ℃离心10 min,收集细菌、重悬于无抗生素 DMEM 培养液中,紫外分光光度计测量OD600的吸光度值,将菌悬液调至1×1010CFU/L备用。
1.2.2细胞培养 Caco-2 细胞用10%胎牛血清细胞培养液(DMEM)培养在5% CO2,37 ℃环境,然后将Caco-2细胞铺于6孔板或者T25培养瓶。
1.2.3显微镜观察艰难梭菌与细胞黏附 用6孔板做细胞爬片,将Caco-2细胞铺于6孔板,待细胞完全贴满爬片时,更换新鲜培养基,加入艰难梭菌至感染复数(MOI=100),分别共培养3、6、9、12及24 h,PBS洗2次,用甲醇于-20 ℃固定5~10 min,分别用4′,6-二脒基-2-苯基吲哚(DAPI)和革兰染料染色,使用油镜观察(放大倍数100倍,每个样本取30个视野),单盲法计数,每组实验设置3个重复。
1.2.4Western blot 实验 Caco-2细胞培养至铺满T25培养瓶,倒掉培养基,用PBS洗2次,更换新鲜培养基,分别用毒素TcdA、TcdB和艰难梭菌直接感染。毒素感染处理分组如下:TcdA毒素感染Caco-2细胞组(TcdA+Caco-2组),TcdB毒素感染Caco-2细胞组(TcdB+Caco-2组),不加任何毒素的Caco-2细胞对照组(Caco-2 24 h组)。TcdA+Caco-2组加入终浓度为30 mg/L 的TcdA毒素蛋白,TcdB+Caco-2组加入终浓度为30 mg/L 的TcdB毒素蛋白,Caco-2 24 h组不加任何毒素,培养24 h;艰难梭菌直接感染分组为:艰难梭菌直接感染Caco-2组(C.difficile+Caco-2组)和不加艰难梭菌的Caco-2对照组(Caco-2 12组)。C.difficile+Caco-2组以MOI=100加入艰难梭菌感染Caco-2细胞,Caco-2组不加艰难梭菌,培养12 h。所有分组培养后,均提取蛋白,测定蛋白质浓度,取20 μg蛋白样品进行蛋白质免疫印迹,每组实验重复3次。
2 结果
2.1 艰难梭菌与Caco-2黏附
艰难梭菌与细胞黏附后,分别用细胞核荧光染料DAPI染色和革兰染色。显微镜观察可见小杆状的艰难梭菌和类似卵圆形的Caco-2细胞核。见图1。

未加艰难梭菌的Caco-2细胞对照组 艰难梭菌黏附于Caco-2细胞组图1 DAPI和革兰染色艰难梭菌与Caco-2细胞黏附情况(1 000×)Fig.1 Microscopic observation of DAPI staining and Gram staining of C. difficile adherence to Caco-2 cells
为统计艰难梭菌与Caco-2细胞的黏附情况,将艰难梭菌感染Caco-2细胞3 h、6 h、9 h、12 h及24 h,革兰染色、制片,在1 000×油镜下观察,统计黏附细菌与细胞比值,见图2。可见感染3、6、9、12及24 h时,平均每个Caco-2 细胞上黏附的艰难梭菌个数分别为2.7、3.2、4.2、5.5及4.3。
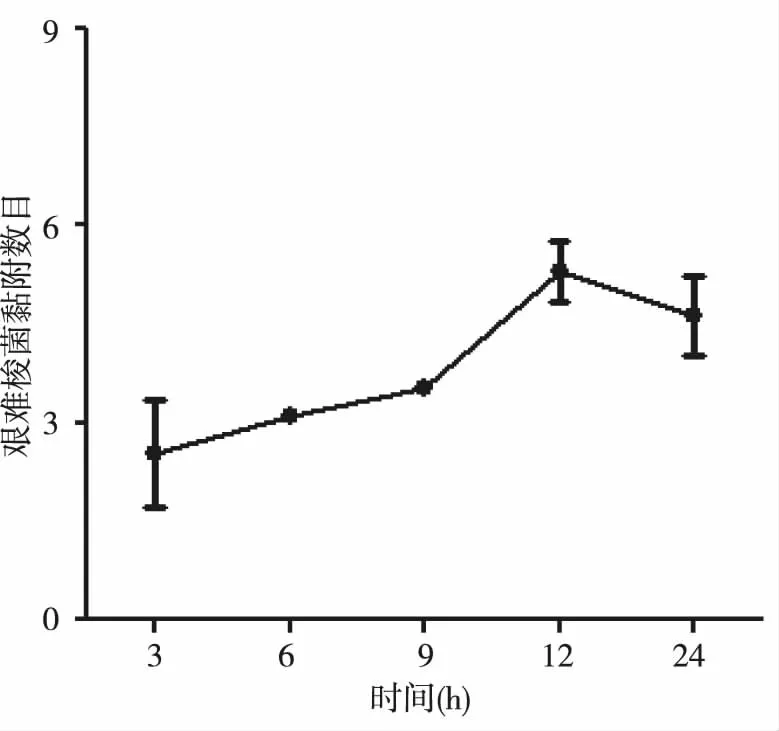
图2 艰难梭菌黏附Caco-2细胞 Fig.2 Clostridioides difficile adherence to Caco-2 cells
2.2 毒素A和B感染Caco-2细胞后NF-κB信号通路p65蛋白表达
用艰难梭菌毒素A和毒素B感染Caco-2细胞后,蛋白质免疫印迹检测NF-κB信号通路磷酸化p65蛋白(P-p65)和p65总蛋白表达水平。结果显示,与对照组相比,TcdA和TcdB感染组P-p65蛋白均升高(P<0.05),p65总蛋白水平降低。见图3。

注:(1)与Caco-2组比较,P<0.05。图3 艰难梭菌毒素感染Caco-2细胞对P-p65和p65表达水平的影响Fig.3 The effect of C. difficile Toxins on the expression levels of p-P65 and P65 proteins in Caco-2 cells
2.3 艰难梭菌感染Caco-2细胞后NF-κB通路P-p65、p65总蛋白、IKKα及IκBα 蛋白表达
艰难梭菌与Caco-2细胞共培养12 h,蛋白质免疫印迹检测NF-κB信号通路磷酸化p65蛋白、p65总蛋白、IKKα及IκBα蛋白表达水平。结果显示,与对照组相比,细菌共培养组P-p65和IKKα均升高(P<0.05),IκBα和p65总蛋白表达均降低(P<0.05)。见图4。
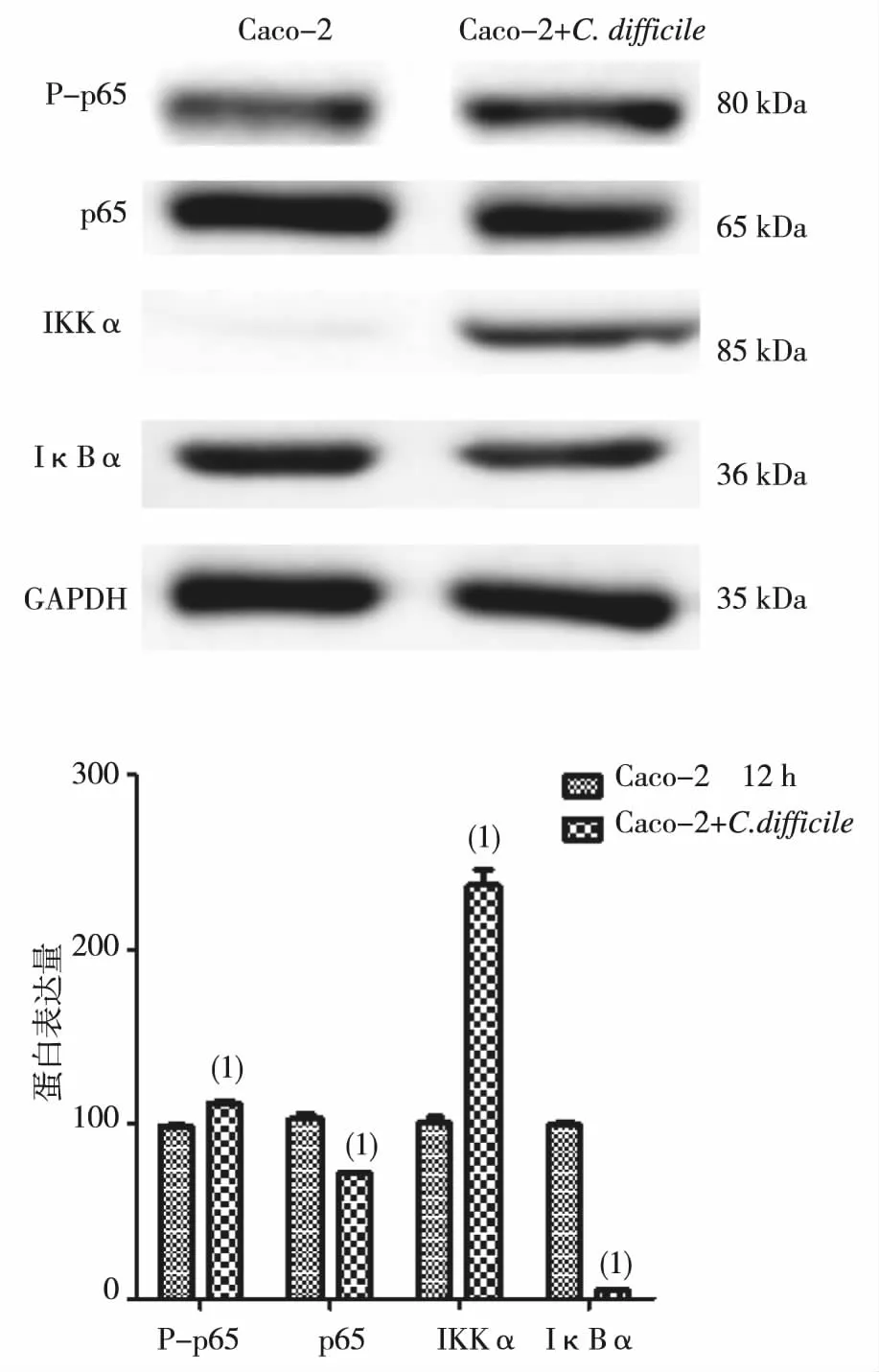
注:(1)与Caco-2细胞比较,P<0.05。图4 艰难梭菌感染Caco-2细胞对P-p65、p65、IKKα及IκBα表达水平的影响Fig.4 The effect of C. difficile on the expression of P-p65, p65, IKKα and IκBα in Caco-2 cells
3 讨论
近年来,艰难梭菌感染引起的肠道炎症越来越受到研究者的关注[12-14]。伪膜性结肠炎是以艰难梭菌为病原体引起的炎症性肠道疾病,严重时可导致死亡[15-16]。NF-κB在机体的细胞增殖、凋亡及免疫反应等方面起到关键作用。生理状态下,NF-κB 与其抑制因子(inhibitor of kappa B,IκB)结合为复合体存在于胞质中,处于相对休眠状态,在细菌入侵或者其他信号刺激下,IκB 在蛋白水解酶的作用下降解,NF-κB被激活,从细胞质进入细胞核,引发其他炎症因子释放,导致肠道炎症的发生[17-18]。Batah Jameel等人发现艰难梭菌菌株中提取的鞭毛蛋白可通过Toll-like receptor 5(TLR5)促进肠道上皮细胞中NF-κB和MAPKs信号通路的激活[19-20],提示了艰难梭菌的存在可能会引起肠道上皮细胞的激活。为了验证这一猜想,本研究首先验证了用TcdA和TcdB感染Caco-2细胞24 h会引起NF-κB信号通路蛋白p65磷酸化升高,总p65蛋白表达降低,提示了艰难梭菌毒素能够激活NF-κB信号通路,促进炎症的发生。
为了验证艰难梭菌直接感染是否有相同的促炎作用,本研究首先建立了艰难梭菌黏附Caco-2细胞的感染模型,发现感染12 h黏附细菌数最多。使用免疫印迹检测NF-κB信号通路蛋白P-p65、p65、IKKα及IκBα,结果显示,P-p65和IKKα蛋白表达增加,总p65蛋白和IκBα蛋白表达降低。当NF-κB信号通路被激活时,激活IKKα,IKKα将IκBα蛋白磷酸化,使其蛋白酶体降解,IκBα表达降低,核外总p65蛋白被部分磷酸化,还有部分会入核,故P-p65蛋白表达增加,而p65总蛋白在核外表达减少[21]。本实验结果提示了艰难梭菌直接感染Caco-2细胞可能激活NF-κB信号通路,此通路是炎症反应通路中很重要的一环。炎症反应是一把“双刃剑”,可能使疾病更加严重,成为转化为肿瘤的标志,也可能使机体发挥免疫防御,成为清除病原体的标志[22-23]。因此,进一步研究艰难梭菌感染的免疫机制,对于CDI的防治提供新的参考具有重要意义。
综上,本研究建立了艰难梭菌感染的体外模型,揭示了艰难梭菌直接感染Caco-2细胞后可上调P-p65和IKKα蛋白的表达,同时下调总p65蛋白和IκBα蛋白的表达,从而激活NF-κB信号通路,促进了炎症反应的发生。
