表面活性剂对地表水中微生物的毒性效应
2019-12-26车阳丽魏小芳钟瑶瑶刘春爽
车阳丽,魏小芳,张 周,钟瑶瑶,张 群,刘 芳,3*,刘春爽,3
表面活性剂对地表水中微生物的毒性效应
车阳丽1,魏小芳2,张 周1,钟瑶瑶1,张 群2,刘 芳1,3*,刘春爽1,3
(1.中国石油大学(华东)化学工程学院,山东 青岛 266580;2.中国石油勘探开发研究院提高采收率国家重点实验室,北京 100083;3.石油石化污染物控制与处理国家重点实验室,北京 102206)
研究了甜菜碱和石油磺酸盐表面活性剂对地表水中微生物的数量和代谢活性的影响,并基于菌群16S rRNA基因的高通量测序,比较分析了表面活性剂作用前后微生物群落结构的变化.结果表明,两种表面活性剂胁迫下微生物的生长活性均遵循低浓度促进、高浓度抑制的作用规律,表现出明显的浓度依赖性.与空白组相比,在1.5g/L的表面活性剂的作用下,微生物数量、蛋白质含量以及脱氢酶的活性均明显降低,且同浓度下的甜菜碱表现出更高的生物毒性;菌群多样性分析发现,肠杆菌属()以高于75%的比例成为所有样本中的优势菌属,从各组来看石油磺酸盐可有效提高肠杆菌属()的相对丰度,对假单胞菌属()和根瘤菌属()抑制作用显著;而甜菜碱则可明显增加假单胞菌属()和寡养单胞菌属()的菌属比例,抑制肠杆菌属()和根瘤菌属()的繁殖;通过表面活性剂与纯种菌的作用发现,表面活性剂可通过扰乱细菌的生长周期、破坏细胞膜结构来干扰细胞的正常生理功能,从而使其活性降低甚至死亡.
甜菜碱;石油磺酸盐;表面活性剂;生物毒性;群落结构
在能源需求量持续增加而新能源尚未普及的形势下,提高石油等常规能源的采收率成为缓解能源紧张的重要举措.目前,我国各油田依次进入三次采油阶段,各种化学驱油技术应运而生,如化学驱油、混相驱油、热力驱油以及微生物驱油等.其中,表面活性剂驱油作为一种常见的化学驱油技术,因具有投资低、收益高的特性被各大油田广泛采用[1-2].表面活性剂是一类含有“双亲”官能团(亲水亲油基)、可使表面张力显著下降的有机物[3],按溶于水后的带电性质可以将其分为非离子表面活性剂、阳离子表面活性剂、阴离子表面活性剂和两性表面活性剂.其中,由于地层岩石表面一般带有负电荷,阳离子表面活性剂基本被排除在驱油体系之外.非离子基团的亲水性要比离子性基团差得多,且非离子表面活性剂在地层中稳定性较差,吸附消耗量大于阴离子表面活性剂,因此使用范围较小[4].在阴离子表面活性剂体系中,石油磺酸盐以高效的界面活性、原料易得和成本较低等优势成为驱油剂体系中的“佼佼”者.近年来,面临着原油开采深度增加、高矿化度、地层温度高的挑战,对表面活性剂的性能也提出了更高的要求,在此背景下,具有良好的配伍性、耐高温、同时含有阴阳离子基团的甜菜碱两性表面活性剂脱颖而出,同时它可以螯合金属离子,对高矿化度的油层具有较强的适用性,得到了研究者们的广泛关注[5-6].
表面活性剂广泛应用于油田生产以及日常生活中的各个方面,在我们的生活发挥了关键的作用[7-9],同时,这也导致人们往往只关注于它带来的便利,却忽略了其可能在使用的过程中进入水体,对生态环境造成潜在危害.前期研究指出[10],1mg/L的表面活性剂就可在水体表面形成泡沫隔离层,阻碍气体交换致使水体发臭;表面活性剂与生物细胞膜之间的电子效应可增加两者之间的接触比例,增加膜的通透性造成细胞死亡[11];表面活性剂还可以通过乳化作用增加水体中油类等疏水性污染物的浓度,打破水生态系统的平衡发展等.合理应用表面活性剂、降低可能带来的环境隐患是保障其发挥最大经济效益的前提.因此,有必要对新研制的表面活性剂进行环境效应评估,建立表面活性剂的生态毒性评价机制.
微生物生长活性的变化可以直接反映出水体受污染程度,将微生物作为表面活性剂毒性监测的指示者具有一定的实用价值[12].然而,目前国内外尚无统一的表面活性剂生物毒性的检测方法和评价标准,在室内评价中研究者们通常以单种菌作为受试物种来考察其毒性效应,为表面活性剂与分离菌之间的作用机理提供指导意义[13-14],但笔者认为在微生物物种的选择上缺乏一定的代表性和广泛性,未能提供微生物群落的全面信息,降低了实验的可信度.而近年发展起来的高通量分子生物学技术(又称“第二代测序技术”)则可有效避免此问题的产生,它不仅具有覆盖面广、通量高、测序周期短的特点[15],而且有效克服大部分微生物无法培养的难题[16].综合考虑,本文以广泛应用的石油磺酸盐(KPS)为对照,采取传统培养法与现代分子生物学技术相结合的方法考察新研制的甜菜碱表面活性剂(TCJ)对地表水中微生物的毒性效应,并对两者之间的作用机理作出预测,为表面活性剂生态效应评估体系的建设提供参考.
1 材料与方法
1.1 实验材料
1.1.1 水样的采集与预处理 本实验所用水样取自山东省青岛市漓江西路与江山南路交汇处西北方向的岔河地表水(120°10'E,35°56'N),其地理位置及周围环境如图1所示.该河道自北向南最终流入唐岛湾海,水体表观较清澈,取样时间为2018年11月,采样时将取水器置于液面下约30cm处,避免漂浮性物质进入水体.采样完毕后,尽快运送至实验室,置于4℃冰箱低温保存,备用.

图1 采样点位置分布
1.1.2 主要仪器及试剂 蘇州净化BCM-1000型生物净化工作台、TU-1901双光束紫外可见分光光度计、SPX-250B生化培养箱(上海浦东荣丰科学仪器有限公司)、ZHWY-2102C恒温培养振荡器(上海智城分析仪器制造有限公司)、LDZM立式压力蒸汽灭菌器(上海申安医疗器械厂)、MiSeq测序仪(美国Illumina公司)等;Q5高保真DNA聚合酶(美国NEB公司)、琼脂糖凝胶回收试剂盒(美国AXYGEN公司);实验用表面活性剂为克拉玛依石油磺酸盐(KPS),棕黑色膏状物,常温下不易溶解;白色甜菜碱型(TCJ)表面活性剂由中国石油勘探开发研究院提供,白色浓稠液状,与水混合后呈浑浊的水化固体状态.
1.2 实验方法
1.2.1 细菌的富集与培养 细菌富集营养液成份(g/L):水1L,NH4Cl 1.67g,NaNO32.65g,K2HPO40.6g, MgSO4·7H2O 0.25g,牛肉膏2g,蛋白胨5g,pH值7.2~7.4.培养基组成(MSM g/L):水1L, NaCl 1g, (NH4)2SO41.25g,NaNO32g, KH2PO43g,K2HPO41.5g, MgSO4·7H2O 0.25g,葡萄糖2g,pH值7.2~7.4.固体培养基的制备:称取5.0g NaCl和10.0g蛋白胨溶于1L去离子水中,在微热状态下加入5.0g牛肉膏搅拌至溶解,然后加入16g琼脂继续加热至煮沸.121℃条件下灭菌处理30min后将其倒至培养皿中,凝固后备用.
表面活性剂作用下地表水微生物的培养:以地表水为接种源,营养液为细菌富集培养基.用无菌枪头吸取地表水样品加入灭菌后的细菌富集培养液中,构建地表水本源微生物的培养体系.待细菌繁殖进入对数生长期后按2%的添加量将菌液转移到无机盐培养基(MSM)中,同时向其中加入表面活性剂溶液,使其最终浓度分别为0,0.1,0.2,0.3,0.6,0.9,1.2和1.5g/L,封口膜包装后置于37℃、160r/min的培养振荡器中培养2d.
培养结束后,从各份培养基中吸取10mL菌液在5000r/min的转速下离心处理10min,倒掉上清液后加入10mL无菌水洗涤3次以除去细胞表面残存的表面活性剂,最后将细菌重悬于10mL无菌水中,低温保存用于后续蛋白质和脱氢酶活性的测定实验.
1.2.2 表面活性剂生物毒性的测定 分别从生物量、蛋白质含量的多少以及脱氢酶活性的高低三方面评判表面活性剂对地表水微生物的生物毒性.
生物量的确定采用稀释平板涂布法[17],取表面活性剂作用下的菌液1mL置于9mL无菌水中按梯度稀释至10-6、10-7稀释度,取此稀释度的菌液涂布于固体琼脂平板上,每个稀释倍数下设立3个平行样,选取菌落数在30~300CFU范围内的平板进行菌数统计,换算出每毫升菌液中的细菌个数,并按公式(1)进行抑菌率的计算[18].
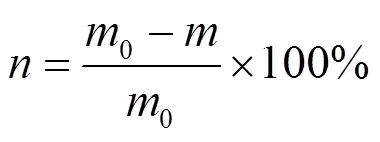
式中:为抑菌率,%;0为无表面活性剂作用的空白组菌落个数,CFU/mL,为表面活性剂作用下的实验组菌落个数,CFU/mL.
采用考马斯亮蓝法[19-20]对细胞内蛋白质含量进行测定.向洗涤重悬后的菌液中加入NaOH,高温煮沸15min使细胞裂解.待其冷却至室温后,用移液枪吸取1mL混合液,加入5mL考马斯亮蓝充分混匀,显色稳定后于595nm处测定其吸光度,并根据标准曲线推算出不同表面活性剂作用下的菌液的蛋白质浓度.
脱氢酶是一种常用来表征微生物活性的指标,其活性的大小可以反映活细胞对有机质的降解利用强度[21].目前,常采用氯化三苯基四氮唑(TTC)比色法对脱氢酶活性进行测定[22-23],以三氯甲烷萃取还原生成的红色三苯基甲贊(TF),分层后用紫外可见分光光度计测定有机相样品在485nm波长处的吸光度,以1mL菌悬液1h生成的TF含量为一个酶活力单位,根据标准曲线推算出生成的TF浓度.脱氢酶活性 = TF浓度(µg/mL)/培养时间
1.2.3 高通量测序 为满足测序要求,需对地表水本源微生物扩大培养.为此,以地表水为接种源,无机盐培养基为基础培养基,建立无表面活性剂干扰的空白对照组、浓度各为100mg/L的TCJ和KPS作用下的实验组培养体系,同时每组设立3个平行.培养完成后取各组水样用0.20µm的聚碳酸酯膜抽滤处理,收集到的菌体滤膜置于无菌离心管中,用干冰保存后送至上海派森诺生物科技有限公司进行后续DNA的提取测定.
PCR扩增:分别以338F (5’-ACTCCTACGG GAGGCAGCA-3’)和806R (5’-GGACTACHVGG GTWTCTAAT-3’) 作为特异性引物,采用Q5高保真DNA聚合酶对标准细菌的16S rRNA 基因V3+V4区进行PCR扩增,其扩增片段长度约为468bp.前引物338F中5’连有一个寡核苷酸序列(barcode),用以区分不同的样品.PCR扩增体系及反应程序如表1所示.
扩增完成后,采用琼脂糖凝胶电泳对产物进行检测确认,切取目的片段并采用Promega QuantiFluor系统对其进行荧光定量,按所需测序量对样本进行混样处理,然后在Illumina Miseq平台进行2×250bp双端测序.
数据处理:为保证测序质量,需要对测序过程中产生的碱基替换、嵌合体等疑问序列进行有效去除,运用QIIME软件对相似度³97%的保留序列进行归并及可操作分类单元(OTU)的划分,选取每个OTU中的高丰度代表序列与Greengenes数据库进行比对,获取各单元内物种从门到种分类水平上的丰富度及菌群微生物多样性指数,用以组间的相似性及差异性分析.
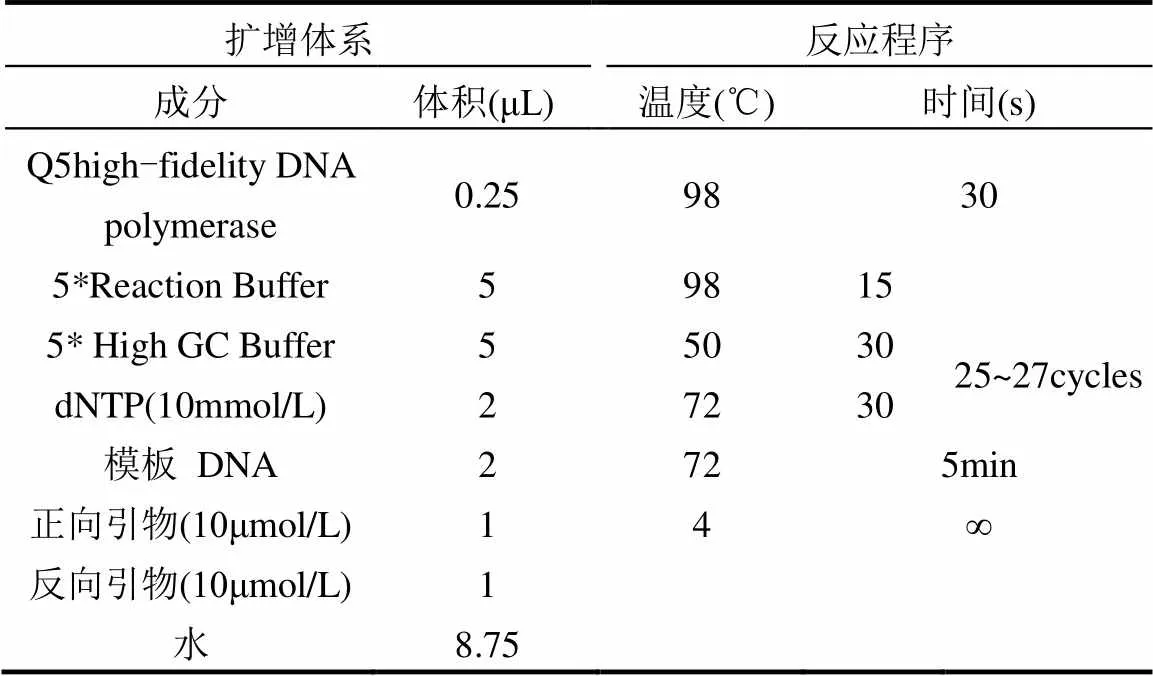
表1 细菌PCR扩增体系及反应程序
1.2.4 表面活性剂作用于纯种菌的机理探究 以大肠杆菌和金黄色葡萄球菌为模式菌,从其生长趋势、细胞膜通透性以及细胞形态三方面入手探究表面活性剂与细菌之间的作用机理.
生长曲线的测定采用光电比浊法[24],分别取OD600=1.0的纯种菌悬液1mL于100mL无菌液体培养基中,向其中加入TCJ和KPS溶液使其最终浓度为1.5g/L.培养过程中定时取出10mL菌液,以5000r/min的速度离心10min并等体积重悬.然后以无菌水做参比,于600nm波长处测定菌悬液的吸光度,绘制菌体的生长曲线.
碘化丙啶(PI)作为一种细胞核染色试剂,可透过破损的细胞膜与双链DNA结合释放出红色荧光,但却对活细胞“无能为力”.因此,可利用它来检测细胞的存活状态[25].实验中,选取未受表面活性剂干扰和与表面活性剂混匀培养的菌液,离心后向菌体沉淀物中加入磷酸盐缓冲溶液(0.1mol/L)和1mg/mL的PI染色液,置于暗处反应20min完成染色.随之取一滴染色后的菌液于载玻片上,通过倒置荧光显微镜观察制备样本并拍照.
利用扫描电子显微镜对表面活性剂作用前后的和细胞形态进行观察.首先,取适量正常培养和添加1.5g/L的表面活性剂条件下培养的菌液,利用磷酸盐缓冲溶液进行冲洗以除去菌体表面的分泌物和表面活性剂,然后利用质量分数为2.5%的戊二醛溶液和1%的锇酸进行双固定.之后,采用一系列质量分数分别为30%,50%, 70%,90%和100%的乙醇溶液对细菌进行脱水处理,并置于超临界CO2环境下进行过夜干燥,最后在扫描电镜下观察并拍照.
2 结果与讨论
2.1 水质分析结果
实验用水的基本理化因子如表2所示,总体来看,表观清澈的地表水呈弱碱性,大分子有机物以及氮磷指标含量较低,不至于出现富营养化状态,但可溶性盐离子含量较高,这可能与其地理位置靠近入海口有关.

表2 地表水物理化学指标
2.2 表面活性剂对微生物的毒性作用
表面活性剂对微生物数量的影响结果如图2所示.从图2(a)(b)所示的平板菌落中可以直观的看出,低浓度的表面活性剂作用下细菌量较多,而后随着表面活性剂剂量的增加,菌量逐渐降低.为从统计学角度评估表面活性剂的作用强度,将生物量进行统计绘制如图2(c)(d)所示柱状图,可以看出,两种不同的表面活性剂分别对微生物表现出不同程度的影响,对于同一种表面活性剂,其对生物量的影响程度表现出明显的浓度依赖性.低浓度范围内,微生物数量随着表面活性剂浓度的升高而增加,并且在TCJ浓度为0.1g/L、KPS浓度为0.2g/L时分别出现生物量的最大值,与空白组数量相比分别增长5.09%和10.12%.此结果一方面说明水体中的微生物可以在含有表面活性剂的环境中生存,另一方面也表示,低浓度的表面活性剂对微生物基本无影响,甚至还可以在一定程度上刺激生物细胞系统,起到促进的作用.Bautista等[26]指出,低浓度的表面活性剂可以作为碳源供微生物吸收利用,这也许是刺激微生物生长的又一重要因素.此后随着表面活性剂浓度的继续增加,这种促进作用减弱直至转换为增殖抑制作用,并且TCJ的增殖抑制强度明显高于同浓度下的KPS的抑制强度,这可能是由于细菌细胞膜上的磷脂层、革兰氏阴性菌体膜上的脂多糖以及革兰氏阳性菌的磷壁酸等结构一般带有负电荷,TCJ表面活性剂作为一种同时含有阴阳离子基团的两性表面活性剂,与阴离子表面活性剂KPS相比更易通过静电作用和疏水效应与细菌表面接触,正负电荷的结合打破了细胞的电位平衡状态,因而表现出更高的毒性作用[27-28].所以,针对不同的利用目的合理选择浓度范围对于充分发挥表面活性剂的综合效益起着至关重要的作用.
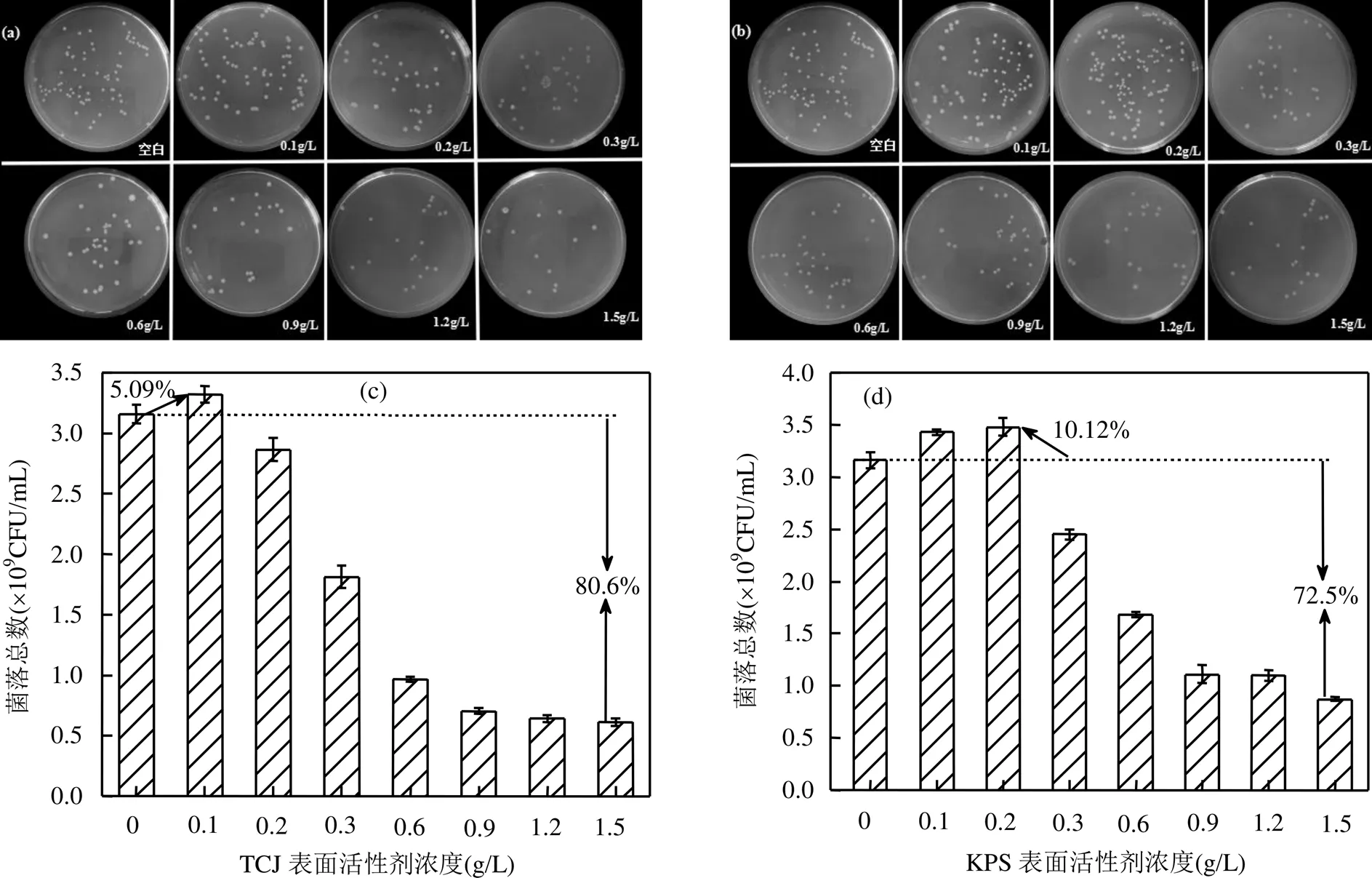
图2 微生物在不同浓度的TCJ和KPS下的平板照片及其生物量的变化
(a)和(c)分别为TCJ作用下的平板照片和生物量变化曲线,(b)和(d)分别为KPS作用下的平板照片和生物量变化曲线
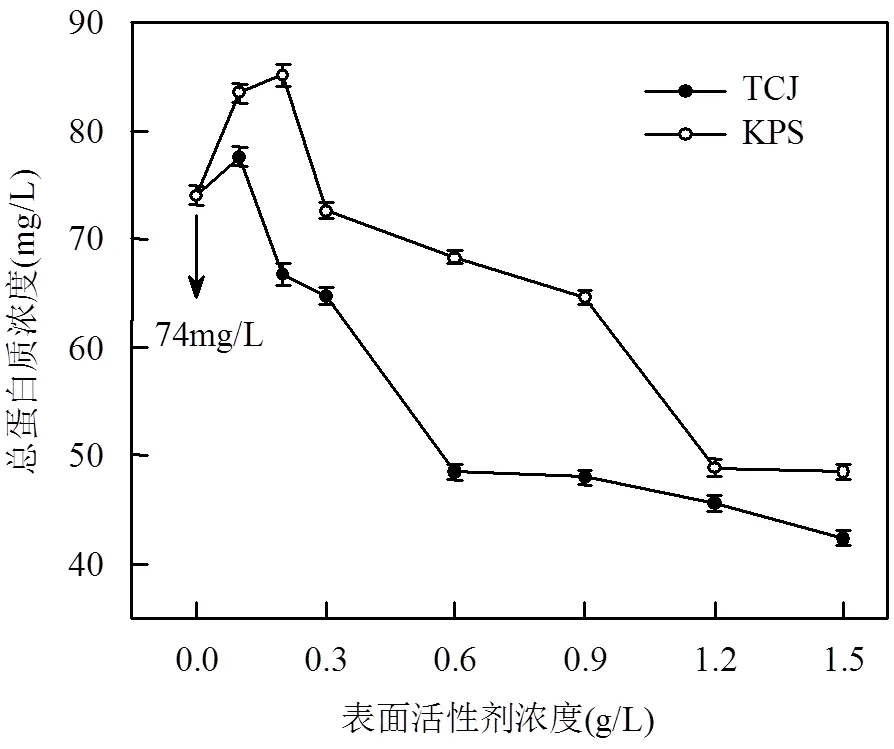
图3 表面活性剂对总蛋白质含量的影响
图3所示为表面活性剂对微生物蛋白质含量的影响,可以看出,总蛋白含量的变化趋势与细菌生物量基本一致,即在较低浓度的表面活性剂作用下,细菌总蛋白质含量与对照组相比均有所增加.其中,在TCJ浓度为0.1g/L、KPS为0.2g/L时,其蛋白质含量相对于空白组分别提高4.90%和15.04%,体现出一种超补偿机制[29].但是随着浓度提高,表面活性剂对细胞的胁迫作用增强,蛋白质含量呈现负增长趋势,在最高浓度1.5g/L的情况下,其蛋白质含量较空白组降低约34%~43%.蛋白质是胞内各代谢反应的物质基础,此结果表明高浓度表面活性剂的存在将会造成蛋白质活性或结构损伤,干扰细菌的正常生理功能.细胞膜的基本骨架是以磷脂和蛋白质为主要成分的磷脂双分子层,属于一种含有疏水端和亲水基的类磷脂型表面活性剂,由于两者之间的相似性,外来表面活性剂分子可能会与膜蛋白形成复合体或者替换磷脂层,使细胞膜渗透性增强,胞内小分子物质外漏造成细菌死亡[30].
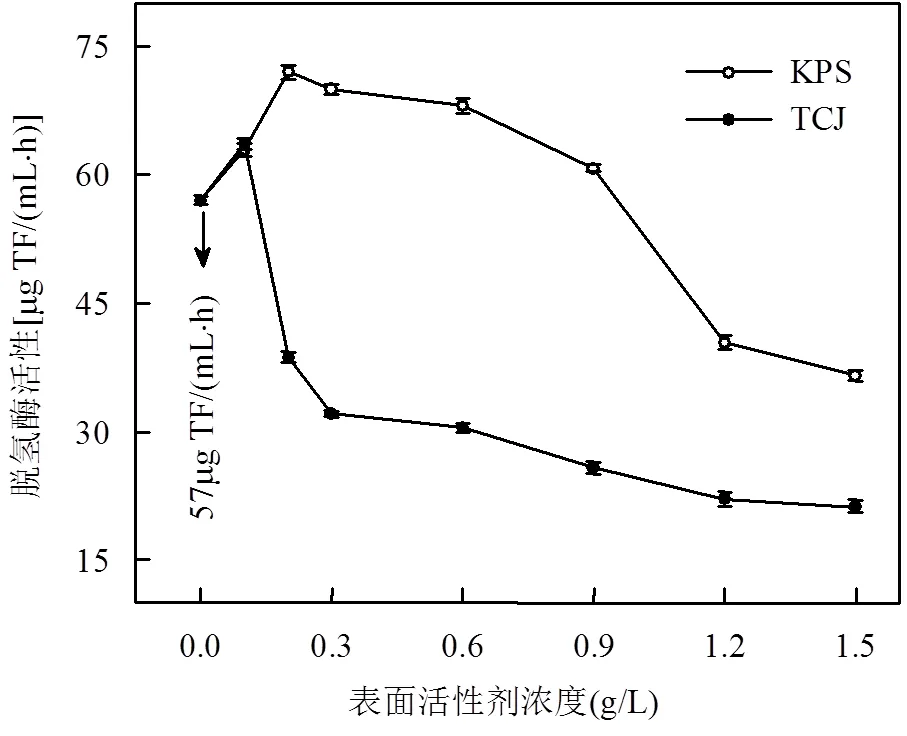
图4 表面活性剂对微生物脱氢酶活性的影响
以TCJ和KPS为对象,测定其在不同浓度条件下对地表水中微生物脱氢酶活性的影响,结果如图4所示.可以看出,在两种不同的表面活性剂的作用下,脱氢酶活性的变化呈现相同的趋势,即随着表面活性剂浓度的升高,酶活性先增加后下降,最后在高剂量表面活性剂的作用下趋于平缓.不同点在于,对于TCJ,其酶活性最大值[63.7µg/(mL·h)]出现在表面活性剂0.1g/L的浓度下,此后随着浓度的增大,脱氢酶活性迅速下降,最终降低量约为对照组的62.8%,呈现出显著的“剂量-效应”关系.而在KPS的作用下,脱氢酶活性在达到最高值72.0 [µg/(mL·h)]后平缓下滑,但仍表现出较空白组高的活性含量,在最高表面活性剂浓度1.5g/L下降低约36%.这是因为酶活性与生物量并不是简单的线性关系,而是受到培养环境的pH值、温度、基质底物以及激活剂等各种因素的影响.分析以上实验结果可知,一定量的表面活性剂分子可以刺激细胞的感应系统,调节微生物代谢使之尽快适应环境的改变,作为酶的“激活剂”诱导脱氢酶的合成,而当表面活性剂的含量超过细菌的耐受限度后,微生物已无法通过自身的调节功能应对外界毒物的胁迫,导致胞内化学反应的有序性被破坏,酶活性代谢紊乱,继而演变成为脱氢酶的“抑制剂”.
2.3 表面活性剂对微生物群落结构的影响
2.3.1 样品的α多样性及测序质量分析 高通量测序序列经过精简纯化后,从3个样品中共获得123681条细菌有效序列,平均测序量约为41100~41300条.从门到属各分类水平上对微生物类群进行统计,结果如表3所示,所有样本的微生物有效序列可分别归属于9个门,16个纲,34个目,52个科和90个属.通常,根据指示侧重点的不同将α多样性指数分为两大类,着重体现微生物群落丰富度的Chao1估计量(Chao1)以及统筹兼顾群落均一性的香农(Shannon)多样性指数和辛普森(Simpson)指数.一般而言,指数与群落的丰富度或者多样性大致呈正比关系.从表3中可以看出,α多样性指数的大小基本呈现出TCJ>空白>KPS的顺序,说明TCJ作用下的水体中微生物丰度最高,TCJ在一定程度上刺激了某些微生物的生长繁殖,促使微生物向多样性的方向发展;而此浓度下的KPS在生物量上并未造成显著的影响,但却能抑制部分微生物的繁殖.微生物样品的Shannon和Simpson指数在TCJ作用下具有最大值,说明TCJ组的微生物多样性较高[31].总体来看,3个样品间的微生物组成仍存在一定的差异.另外,通过对3个样本随机抽取的序列绘制稀疏曲线(图5)发现,随着测序深度的增加,曲线渐趋平缓,表明测序深度的继续增加不再对微生物群落丰富度和多样性造成显著的影响,即此深度下的测序量可满足后续的群落结构分析的要求.
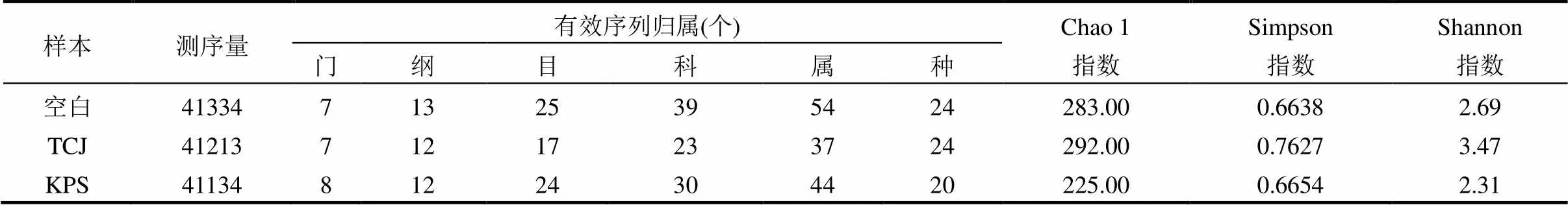
表3 细菌16S rRNA 序列及a多样性指数
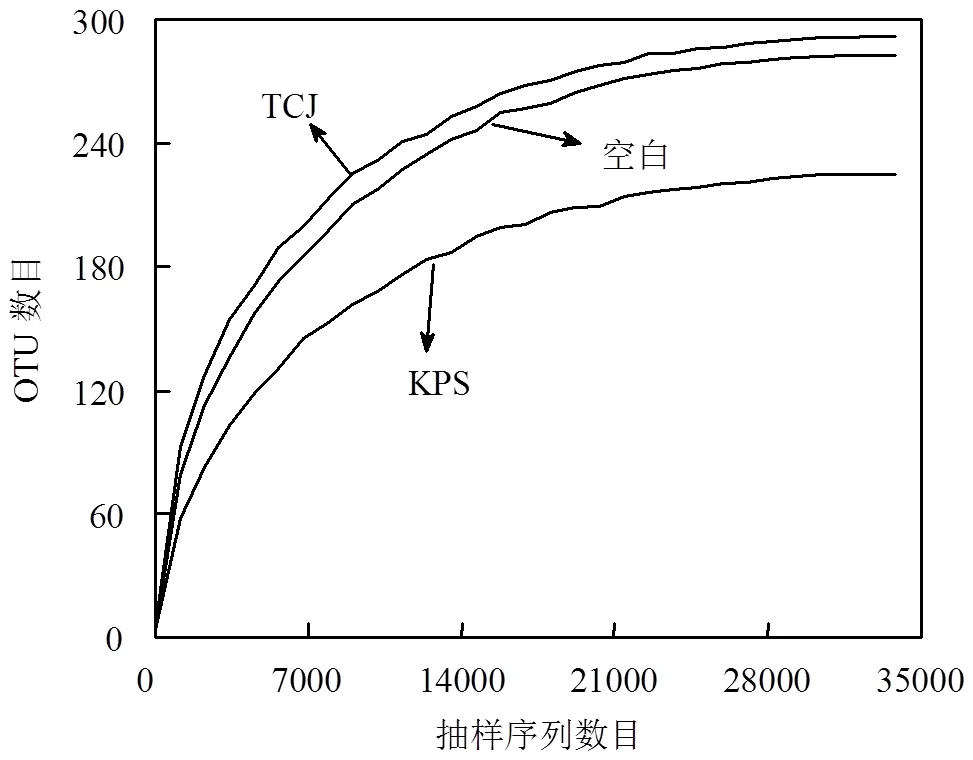
图5 随机抽取序列的稀释性曲线
2.3.2 微生物在属水平上的分析 运用QIIME软件构建样本微生物在属水平上的组成分布柱状图(图6),可以看出,水体中的微生物群落结构较为单一,结合水样采集时间及水质监测结果可以推测出,冬季气温较低、水体有机物含量少等都可能成为制约微生物多样性的重要因素[32].其中,肠杆菌属()在KPS作用下的微生物中相对丰度高达97.8%,在空白组和TCJ组中分别占有87.3%和75.0%,以较高的数量优势成为所有样品中的优势菌群,这可能是由以下两方面造成的:(1)肠杆菌属作为一种分布极为广泛的菌属,其在原水样中本身数量较多;(2)可能受到培养条件的影响[33],肠杆菌属在扩大培养环境中具有较强的适应能力,处于优势地位,因而相对丰度较高.此外,在空白组中相对丰度位于前列的还有假单胞菌属(7.7%)、根瘤菌属(2.1%)和不动杆菌属(, 0.7%);KPS作用下的水体中除了肠杆菌属这一绝对优势菌群外,不动杆菌属以0.6%的比例成为相对丰度位居第二的菌群,其余菌属的相对丰度均低于0.3%;而在TCJ作用下的样品中,假单胞菌属的相对丰度达到11.6%,寡养单胞菌()以10.1%的相对丰度成为此样品中的又一优势菌属.除此之外,不动杆菌属的菌属比例为1.2%,具有1%的相对丰度.对以上结果进行分析发现,相同的表面活性剂浓度下,KPS可极大的促进的生长代谢,而且对其它菌属(尤其是和)的抑制作用显著;与对照组相比,此浓度的TCJ可使原水样中的和的相对丰度分别下降12.3%和1.1%,以及的相对丰度分别提高9.7%和3.9%,进一步说明和对于TCJ表面活性剂较为敏感.
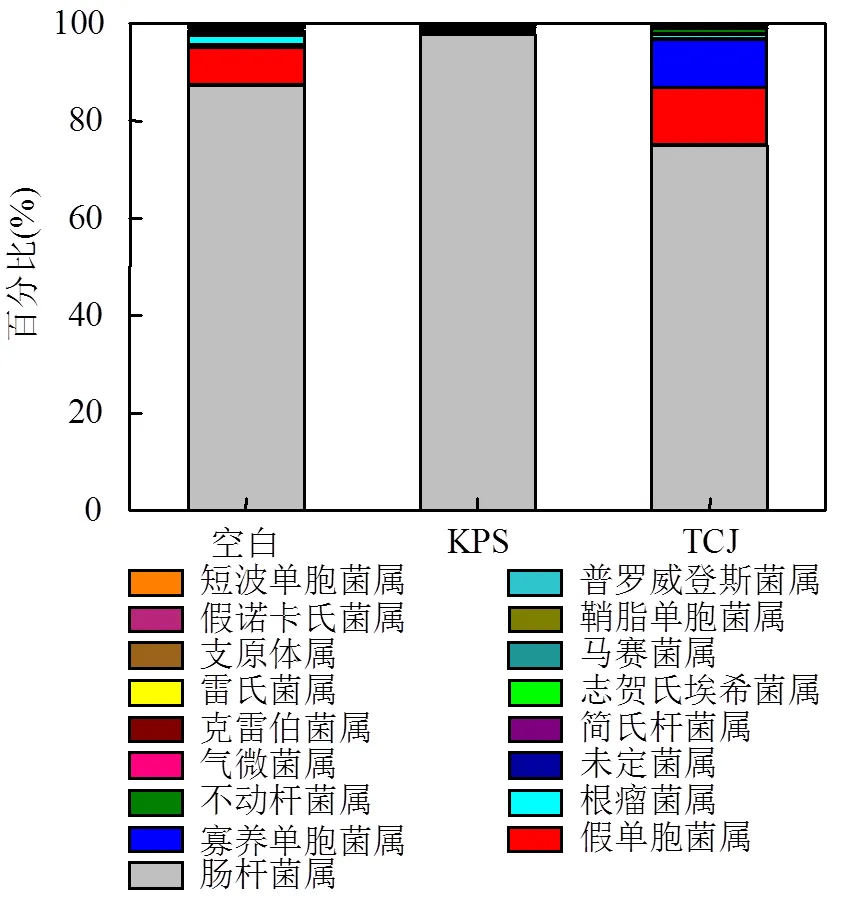
图6 样本在属分类水平上的组成
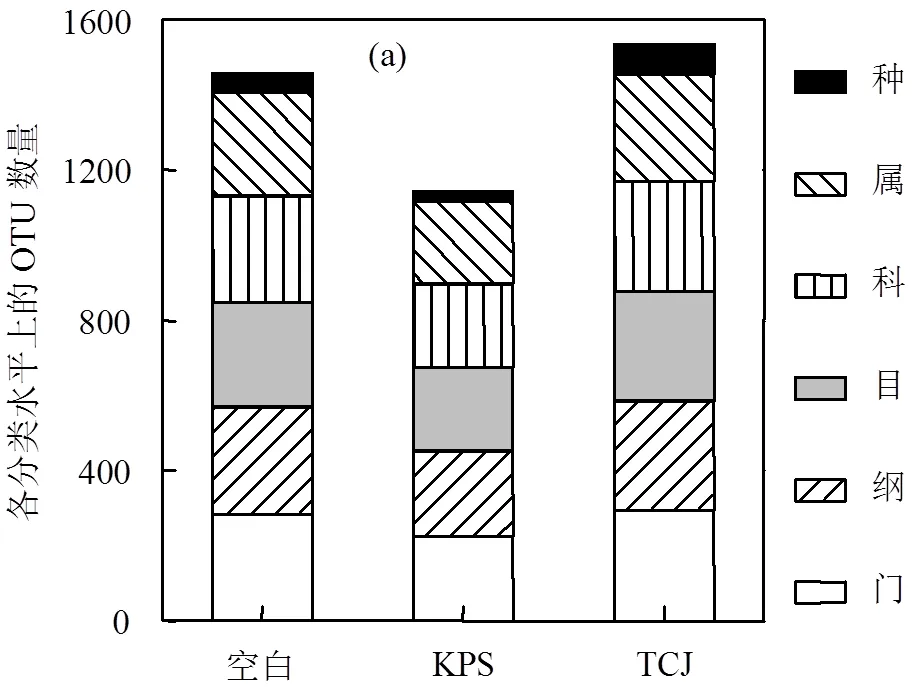
2.3.3 群落OTU比较分析 将丰度值低于全样本测序总量0.001%的OTU去除,对得到的有效OTU单元进行划分和分类地位鉴定,结果如图7(a)所示,可以看出,KPS的OTU分类单元明显低于空白组和TCJ组.再通过R软件对样本中特有及共有的OTU丰度矩阵进行计算,得到图7(b)所示的OTU分布韦恩(Venn)图.从图中可直观看出,在97%的相似度阈值水平上3个样本共产生474条OTU,囊括空白样、TCJ和KPS中各包含的283、292和225条OTU信息,3个样本间共有OTU为108个,分别占KPS、空白、TCJ组各自OTU数目以及所有样品OTU总数的48%、38%、37%和22.8%.空白、TCJ 和KPS特有的OTU单元数分别为79、105和72个.尽管3个样本的微生物来源于同一水体,但是在KPS和TCJ两种表面活性剂的分别作用下,其中的群落结构发生显著变化,体现出群落结构与环境之间的密切相关性.另外,KPS组中约有61.8%的OTU可以在原水样中发现,高于同评判标准下TCJ组与空白组的共有OTU比例(59.2%),间接表明TCJ对微生物群落结构的改变程度大于KPS的作用程度.同时,3个样品的未加权聚类分析(图8)表明KPS与空白组的微生物构成相似性高于TCJ与KPS、TCJ与空白之间的相似度,与OTU分析结果保持一致.
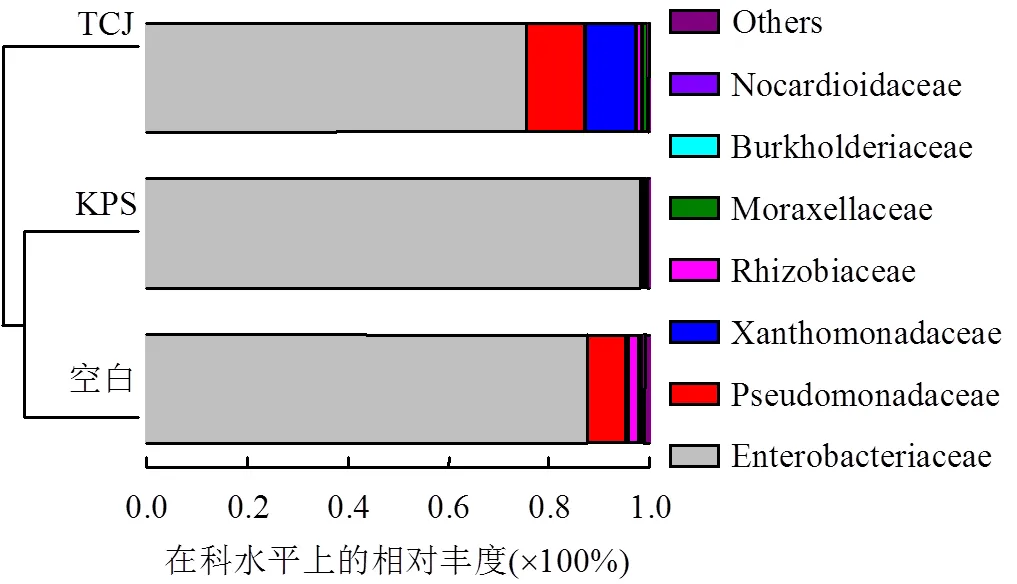
图8 基于物种(科)分布的样本聚类分析
2.4 表面活性剂对细菌的作用机理分析
2.4.1 表面活性剂对细菌生长曲线的影响 表面活性剂对和生长曲线的作用结果如图9所示,可以看出,未受表面活性剂干扰的纯种菌在培养期的前4h基本处于生长迟缓期,光浊度无明显变化,4h~12h之间为细菌的对数生长期,12h后细菌数量基本处于动态平衡状态.观察TCJ作用下的(a)和(c)发现,其生长受到严重抑制,分别在10,14h内均无明显数量变化.同样于KPS作用(b, d)下,两种菌在16h内均未出现浊度的变化.此结果表明表面活性剂对细菌可产生一定的毒害作用,使处于S-G2/M期的细菌数目明显增多[34],延缓或抑制细菌进入对数生长期,从而造成高剂量的表面活性剂下细菌数目明显降低[35].此外,对比TCJ和KPS的作用效果发现,KPS在细菌的生长周期方面表现出更强的抑制作用.
2.4.2 表面活性剂对细菌细胞膜通透性的影响 图10为表面活性剂作用和后的荧光显色照片,从图10(a)和(d)可以看出,不受表面活性剂干扰的和无荧光显色,表明正常生长条件下的细菌细胞膜完整,生长状态良好,PI染料无法进入活细胞内部,因而背景为全黑模式.而添加TCJ(图10b和e)和KPS(图10c和f)表面活性剂后,显微镜视野中呈现红色斑点,说明表面活性剂作用下细菌细胞膜的完整性受到破坏,通透性增加后PI染料分子方可进入受损细胞内部与DNA相嵌,从而释放出红色荧光.可以看出,KPS作用下的细菌荧光强度稍弱于TCJ作用下的强度,整体上说明细胞膜在KPS体系中的破坏程度低于TCJ体系.

图9 表面活性剂对大肠杆菌(a, b)和金黄色葡萄球菌(c, d)生长曲线的影响
2.4.3 表面活性剂对细菌形态的影响 为进一步探究表面活性剂对细菌的作用机制,利用扫描电镜对其作用后的细菌形态进行观察.从图11(a)可以看出,正常情况下的细胞表面光滑,呈短杆状结构,然而当其受到TCJ(图11b)和KPS(图11c)表面活性剂干扰后,细胞变为干瘪状.对于,正常生长条件下细胞表面圆润光滑,类葡萄球状,当其暴露于TCJ(图11e)和KPS(图11f)表面活性剂后,细胞表面变得粗糙且呈不规则形态.对此可以推测出,表面活性剂通过静电与疏水作用与细菌结合后,可造成其膜结构完整性的破坏.且相对于KPS,含有阴阳离子基团的TCJ与细菌之间的结合力度更大,因而破坏性更强.
对以上结果分析可得,TCJ和KPS对细菌的作用机制存在一些共性,即都会造成细菌生长停滞期的延长、细胞膜渗透性的增加以及细胞形态的改变.但两种表面活性剂之间又存在一定的差异性,如对于TCJ而言,其对细菌的破坏力度大但抑制时间短于KPS,KPS对细菌破坏强度小但抑制时间长.总而言之,表面活性剂对细菌的毒性作用是各种机制综合作用的结果.

图10 表面活性剂作用后的E.coli和S.aureus的荧光照片
(a)空白组;(b) TCJ表面活性剂处理后的;(c) KPS表面活性剂处理后的;(d)空白组;(e) TCJ表面活性剂处理后的;(f) KPS表面活性剂处理后的

图11 表面活性剂作用后的E.coli和S.aureus的SEM图
(a)空白组;(b) TCJ表面活性剂处理后的;(c) KPS表面活性剂处理后的;(d)空白组;(e) TCJ表面活性剂处理后的;(f) KPS表面活性剂处理后的
3 结论
3.1 微生物的数量及代谢活性均随着表面活性剂浓度的增加呈现出先升高后降低的趋势.其中,当TCJ浓度为0.1g/L时,其作用下的微生物数量、总蛋白质含量及脱氢酶活性较空白组分别提高5.09%、4.90%和11.75%;在0.2g/L的KPS的作用下,其分别提高10.12%、15.04%和26.31%,表现出明显的剂量—效应关系.
3.2 对0.1g/L表面活性剂作用下的微生物群落结构分析可得,KPS表面活性剂可有效提高的相对丰度,对和抑制作用显著;而TCJ表面活性剂则可明显提高和的相对丰度,而使和的丰度值进一步降低.
3.4 纯种菌实验表明,表面活性剂可通过延缓或抑制细菌进入对数生长期、增加细胞膜的通透性、破坏细胞形态等干扰细胞的正常代谢途径使之活性降低甚至死亡.
[1] Cheng J, Wu J, Hu J. Key theories and technologies for enhanced oil recovery of alkaline/surfactant/polymer flooding [J]. Shiyou Xuebao/ Acta Petrolei Sinica, 2014,35(2):310-318.
[2] Yuan C D, Pu W F, Wang X C, et al. The effects of interfacial tension, emulsification and surfactant concentration on oil recovery in surfactant flooding process for high temperature and high salinity reservoirs [J]. Energy & Fuels, 2015,29(10):6165-6176.
[3] Liwarska-Bizukojc E, Bizukojc M. Effect of selected anionic surfactants on activated sludge flocs [J]. Enzyme and Microbial Technology, 2006,39(4):660-668.
[4] 姜 丽.三次采油用石油磺酸盐的合成研究[D]. 青岛:中国石油大学, 2009.Jiang L. Synthesis of petroleum sulfonate used for tertiary recovery [D]. Qingdao: China University of Petroleum, 2009.
[5] Cai H Y, Wang H Z, Ma D S, et al. Progress on synthesis and application of betaine surfactants [J]. Advanced Materials Research, 2014,881:148-153.
[6] Qiao W, Cui Y, Zhu Y, et al. Dynamic interfacial tension behaviors between Guerbet betaine surfactants solution and Daqing crude oil [J]. Fuel, 2012,102:746–750.
[7] Huang X, Mu T, Shen C, et al. Effects of bio-surfactants combined with alkaline conditions on volatile fatty acid production and microbial community in the anaerobic fermentation of waste activated sludge [J]. International Biodeterioration & Biodegradation, 2016,114:24-30.
[8] Ni N, Wang F, Song Y, et al. Effects of cationic surfactant on the bioaccumulation of polycyclic aromatic hydrocarbons in rice and the soil microbial community structure [J]. RSC Advances, 2017,7(66): 41444-41451.
[9] Nitsche M, Silva S S. Recent food applications of microbial surfactants [J]. Critical Reviews in Food Science and Nutrition, 2018,58(4):631-638.
[10] Okpokwasili G C, Olisa A O. River-water biodegradation of surfactants in liquid detergents and shampoos [J]. Water Research, 1991,25(11):1425-1429.
[11] Vasileva-Tonkova E, Sotirova A, Galabova D. The Effect of rhamnolipid biosurfactant produced by pseudomonas fluorescenson model bacterial strains and isolates from industrial wastewater [J]. Current Microbiology, 2011,62(2):427-433.
[12] 李 军,张翠云,蓝芙宁等.区域地下水不同深度微生物群落结构特征[J]. 中国环境科学, 2019,39(6):2614-2623. Li J, Zhang C Y, Lan F N, et al. Structure characteristics of microbial community at different depths of groundwater [J]. China Environmental Science, 2019,39(6):2614-2623.
[13] Qiao S, Zheng N, Tian T, et al. Effects of short-term exposure to linear anionic surfactants (SDBS, SLS and SDS) on anammox biomass activity [J]. RSC Advances, 2016,6:53004-53011.
[14] Liu Y, Ma X, Zeng G, et al. Role of low-concentration monorhamnolipid in cell surface hydrophobicity of: adsorption or lipopolysaccharide content variation [J]. Applied Microbiology and Biotechnology, 2014,98(24):10231-10241.
[15] 黄郑郑,曹 刚,李紫惠,等. XH02菌强化反应器脱氮过程中菌群结构的高通量分析 [J]. 中国环境科学, 2017,37(5):1922-1929. Huang Z Z, Cao G, Li Z H, et al. High-throughput sequencing analysis of community structure in reactor enhanced by heterotrophic nitrification-aerobic denitrification bacteria XH02 [J]. China Environmental Science, 2017,37(5):1922-1929.
[16] Ren H Y, Zhang X J, Song Z Y, et al. Comparison of microbial community compositions of injection and production well samples in a long-term water-flooded petroleum reservoir [J]. PLoS ONE, 2011, 6(8):e23258.
[17] Novakowski K E, Loukov D, Chawla V, et al. Bacterial binding, phagocytosis, and killing: measurements using colony forming units [J]. Methods in molecular biology, 2017,1519:297-309.
[18] Sütterlin H, Alexy R, Kümmerer K. The toxicity of the quaternary ammonium compound benzalkonium chloride alone and in mixtures with other anionic compounds to bacteria in test systems with Vibrio fischeri and Pseudomonas putida [J]. Ecotoxicology & Environmental Safety, 2008,71(2):498-505.
[19] Al-Tahhan R A, Sandrin T R, Bodour A A, et al. Rhamnolipid- induced removal of lipopolysaccharide from Pseudomonas aeruginosa: effect on cell surface properties and interaction with hydrophobic substrates [J]. Applied & Environmental Microbiology, 2000,66(8): 3262-3268.
[20] Lowry O H, Rosebrough N J, Farr A L, et al. Protein measurement with the Folin phenol reagent [J]. Journal of Biological Chemistry, 1951,193(1):265-275.
[21] 马 涛.循环冷却水水质条件对生物粘泥性质及控制的影响研究[D]. 青岛:中国石油大学, 2010. Ma T. Research on Characteristics and Control of Biofouling in recirculating Cooling Water at Different Nutrient Levels [D]. Qingdao: China University of Petroleum, 2010.
[22] Xie J, Hu W, Pei H, et al. Detection of amount and activity of living algae in fresh water by dehydrogenase activity (DHA) [J]. Environmental Monitoring and Assessment, 2008,146(1-3):473-478.
[23] Mina D, Wenrong H, Haiyan P, et al. Determination of dehydrogenase activity and its application [J]. Industrial Water Treatment, 2008, 28(10):1-4.
[24] Ma Y, Tu Y, Chen X L, et al. Growth curves of oleaginous yeast in high density liquid medium determined by spectrophotometry [J]. Northern Horticulture, 2013,37(8):116-118.
[25] Kang S, Pinault M, Pfefferle L D, et al. Single-walled carbon nanotubes exhibit strong antimicrobial activity [J]. Langmuir, 2007,23(17):8670-8673.
[26] Bautista L F, Sanz R, Molina M C, et al. Effect of different non-ionic surfactants on the biodegradation of PAHs by diverse aerobic bacteria [J]. International Biodeterioration & Biodegradation, 2009,63(7): 913-922.
[27] Li X F, Che Y L, Lv Y, et al. Synthesis and characterization of CuZnO@GO nanocomposites and their enhanced antibacterial activity with visible light [J]. Journal of Sol-Gel Science and Technology, 2019,89(3):1-13.
[28] 刘智峰.鼠李糖脂对疏水性有机污染物降解的影响研究[D]. 长沙:湖南大学, 2012. Liu Z F. Effect of rhamnolipids on the degradation of hydrophobic organic compounds [D]. Changsha: Hunan University, 2012.
[29] Yang H, Xu R, Xue X, et al. Hybrid surfactant-templated mesoporous silica formed in ethanol and its application for heavy metal removal [J]. Journal of Hazardous Materials, 2008,152(2):690-698.
[30] 钱欣平,阳永荣,孟 琴.生物表面活性剂对微生物生长和代谢的影响[J]. 微生物学通报, 2002,29(3):75-78. Qian X P, Yang Y R, Meng Q. Effects of biosurfactants on microbial growth and metabolism [J]. Microbiology China, 2002,29(3):75-78.
[31] 宋云龙,张金松,朱 佳,等.基于高通量测序的微生物强化污泥减量工艺中微生物群落解析 [J]. 中国环境科学, 2016,36(7):2099-2107. Song Y L, Zhang J S, Zhu J, et al. Analysis of microbial community in in-situ sludge reduction process by bioaugmentation using high- throughput sequencing technology [J]. China Environmental Science, 2016,36(7):2099-2107.
[32] 宋淑芬,杨 帆,高绣纺,等.湿地法处理生活污水对仙桃湿地地表水微生物群落结构的影响[J]. 微生物学通报, 2019,46(3):512-521. Song S F, Yang F, Gao X F, et al. Effects of sewage treatment on microbial community structure of surface water in Xiantao wetland [J]. Microbiology China, 2019,46(3):512-521.
[33] Khleifat K M, Sharaf E F, Al-Limoun M O. Biodegradation of 2-chlorobenzoic acid by: Growth kinetics and effect of growth conditions [J]. Bioremediation Journal, 2015,19(3): 207-217.
[34] Zhang S, Ding S, Yu J, et al. Antibacterial activity, in vitro cytotoxicity and cell cycle arrest of Gemini quaternary ammonium surfactants [J]. Langmuir, 2015,31(44):12161-12169.
[35] 姜 霞,区自清,张春桂.表面活性剂对分枝杆菌KR2生长的影响[J]. 上海环境科学, 2002,21(12):716-720. Jiang X, Qu Z Q, Zhang C G. Effects of surfactant on growth ofKR2 [J]. Shanghai Environmental Sciences, 2002, 21(12):716-720.
Toxic effects of surfactants on microorganisms in surface water.
CHE Yang-li1, WEI Xiao-fang2, ZHANG Zhou1, ZHONG Yao-yao1, ZHANG Qun2, LIU Fang1,3*, LIU Chun-shuang1,3
(1.College of Chemical Engineering, China University of Petroleum (East China), Qingdao 266580, China;2.PetroChina Research Institute of Petroleum Exploration & Development, State Key Laboratory of Enhanced Oil Recovery, Beijing 100083, China;3.State Key Laboratory of Petroleum Pollution Control, Beijing 102206, China)., 2019,39(12):5301~5311
The effects of betaine and petroleum sulfonate surfactants on the quantity and metabolic activity of microorganisms in surface water were investigated in this study. In addition, we also analyzed the changes of microbial community structure before and after treatment with surfactants based on the high-throughput sequencing of the 16S rRNA gene of the flora. The results showed that the growth activities of microorganisms under the stress of these two surfactants all present the phenomenon of promotion in low concentration and inhibition in high concentration, showing obvious concentration dependence. Compared with the control group, the microbial biomass, protein content and dehydrogenase activity were significantly decreased in the presence of 1.5g/L surfactants, and microbial community showed higher biological toxicity with betaine surfactant than petroleum sulfonate at the same concentration. The analysis of flora diversity indicated that(with a ratio of more than 75%) was the dominant genus in all samples. From each group, petroleum sulfonate can effectively improve the relative abundance of, and exert a significant inhibitory effect onand. However, betaine can significantly increase the proportion ofand, and inhibit the reproduction ofand. Through the interaction between surfactant and pure bacteria, it was shown that surfactant could interfere with the normal physiological function of cells by disturbing the growth cycle of bacteria and destroying the structure of cell membrane, resulting in the reduction of its activity and even death.
betaine;petroleum sulfonate;surfactant;biological toxicity;community structure
X172
A
1000-6923(2019)12-5301-11
车阳丽(1994-),女,山东潍坊人,中国石油大学(华东)硕士研究生,主要从事水污染控制技术研究.发表论文3篇.
2019-05-06
国家科技重大专项子课题(2016ZX05040-003)
* 责任作者, 教授, liufangfw@163.com
