互花米草入侵对滨海盐沼土壤甲基汞的影响
2019-12-26龙颂元张曼胤刘魏魏胡宇坤
龙颂元,张曼胤*,刘魏魏,胡宇坤,李 晶
互花米草入侵对滨海盐沼土壤甲基汞的影响
龙颂元1,2,张曼胤1,2*,刘魏魏1,2,胡宇坤1,2,李 晶1
(1.中国林业科学研究院湿地研究所,湿地生态功能与恢复北京市重点实验室,北京 100091;2.河北衡水湖湿地生态系统国家定位观测研究站,河北 衡水 053000)
本研究跨越11个纬度选取了4个典型滨海盐沼湿地,通过对比分析互花米草湿地和其他盐沼湿地(没有互花米草的本地种单优或者共优群落湿地)的汞(THg)和甲基汞(MeHg)含量特征及环境因子,探究互花米草入侵对我国滨海盐沼湿地土壤甲基汞的影响.结果表明:(1)4个研究区THg含量高低顺序为闽江口((115.327±18.220)μg/kg)>杭州湾((37.792±3.761)μg/kg)>黄河三角洲((27.690±4.359)μg/kg)>盐城((8.843±1.688)μg/kg);MeHg含量为杭州湾((0.589±0.134)μg/kg)>黄河三角洲((0.511±0.059)μg/kg)>闽江口((0.361±0.065)μg/kg)>盐城((0.191±0.027)μg/kg).(2)综合4个研究区进行分析发现,互花米草入侵对盐沼湿地土壤MeHg和%MeHg的均没有显著影响,但是互花米草入侵著增加了黄河三角洲的MeHg含量(95.0%).(3)在两种湿地类型中,%MeHg(甲基化率)和THg均呈现极显著的负相关关系,且二者之间的关系存在一个临界值(20~30μg/kg之间),当THg小于临界值时,%MeHg与环境因子相关性较弱;当THg大于临界值时,%MeHg与环境因子显著相关.本研究从较大的空间尺度回答了互花米草入侵对滨海盐沼湿地甲基汞特征的影响,为全面评价互花米草入侵对我国滨海地区的影响提供了数据支持,为研究滨海滩涂地区汞的迁移转化提供了依据.
互花米草;盐沼湿地;汞;甲基汞;环境因子
汞(Hg)是一种具有持久性、高生物富集性和严重生物毒性且唯一能以气态形式存在的重金属,大气汞能随大气环流传输到世界各地,因此汞被认为是一种全球性的污染物[1-2].由于化石燃料燃烧、矿石冶炼和废物焚烧,全球大气汞浓度比工业革命前增长了5倍[3-4],2015年东亚及东南亚地区的大气汞排放量占全球排放量的38.6%[5].湿地的积水环境和丰富的有机质能够吸收大气沉降和径流输入的汞,是汞的活性库[6].汞能在一定条件下通过甲基化作用转化为毒性更高的甲基汞(MeHg).甲基汞是一种强亲脂性、高神经毒性并具有生殖毒性[7]和发育毒性[8]的有机汞化合物,可以通过生物富集和生物放大作用造成人类甲基汞暴露[9].甲基汞的产生主要是由厌氧微生物驱动的,该过程受生物因素和非生物因素的影响,其中生物因素包括微生物的种类[10-12]、活性[13]等,非生物因素包括底物汞的形态和浓度[14]、环境因素(温度、pH值、有机质等)[15-18].现有的研究表明,具有甲基化功能的微生物主要包括硫酸盐还原菌(SRB)、铁还原菌(FeRB)和产甲烷菌三大类[19].湿地以其厌氧环境和丰富的营养物质,以及湿地土壤中的高丰度甲基化微生物[20],为汞的甲基化提供了十分有利的条件,使得湿地成为甲基汞产生的重要场所.
滨海盐沼湿地是我国重要的湿地类型之一,也是互花米草()入侵的主要区域.互花米草自1979年从北美被引入后[21],就迅速在我国沿海地区扩张,对我国滨海湿地重金属的生物地球化学循环和土壤理化性质产生了重要影响[22].互花米草入侵能促进土壤中重金属的累积[23],显著改变土壤的理化性质(如pH值、含水率、有机碳和总磷等),但互花米草入侵对土壤理化性质的影响目前还没有形成定论[24-30].此外,互花米草入侵还能增加产甲烷菌数量和产甲烷潜力,促进滨海湿地甲烷的排放.项剑等[31]和Zeleke等[32]通过对产甲烷菌功能基因A的qPCR分析都表明互花米草入侵能显著增加产甲烷菌的数量,布乃顺等[33]的研究表明互花米草入侵提高了沿海湿地甲烷的排放,潘小翠等[34]的研究进一步表明互花米草入侵能增加产甲烷菌数量和产甲烷潜力,从而提高滩涂湿地的甲烷排放.
互花米草对重金属累积的促进作用,及其入侵造成的产甲烷菌数量和产甲烷能力的增加以及土壤理化性质的改变都可能会影响土壤汞甲基化的过程,但是互花米草入侵究竟是否会对盐沼湿地土壤中MeHg特征产生影响目前还缺乏相关研究.所以本研究选取了4个不同纬度的受互花米草入侵的滨海盐沼湿地,通过对比分析互花米草湿地和其它盐沼湿地(没有互花米草的本地种单优或者共优群落湿地)的汞和甲基汞含量特征及其环境影响因素,探究互花米草入侵对滨海盐沼湿地土壤MeHg特征的影响,以期为全面评价互花米草入侵对我国滨海地区的影响提供数据支持,为研究滨海滩涂地区汞的迁移转化提供依据.
1 材料与方法
1.1 研究区概况
研究区为我国东部沿海的闽江口、杭州湾、盐城和黄河三角洲4个滩涂湿地(图1和表1),4个研究区均为典型的受互花米草入侵的滨海盐沼湿地,纬度跨度为11.7°,能较好的代表我国受互花米草入侵的滨海盐沼湿地.
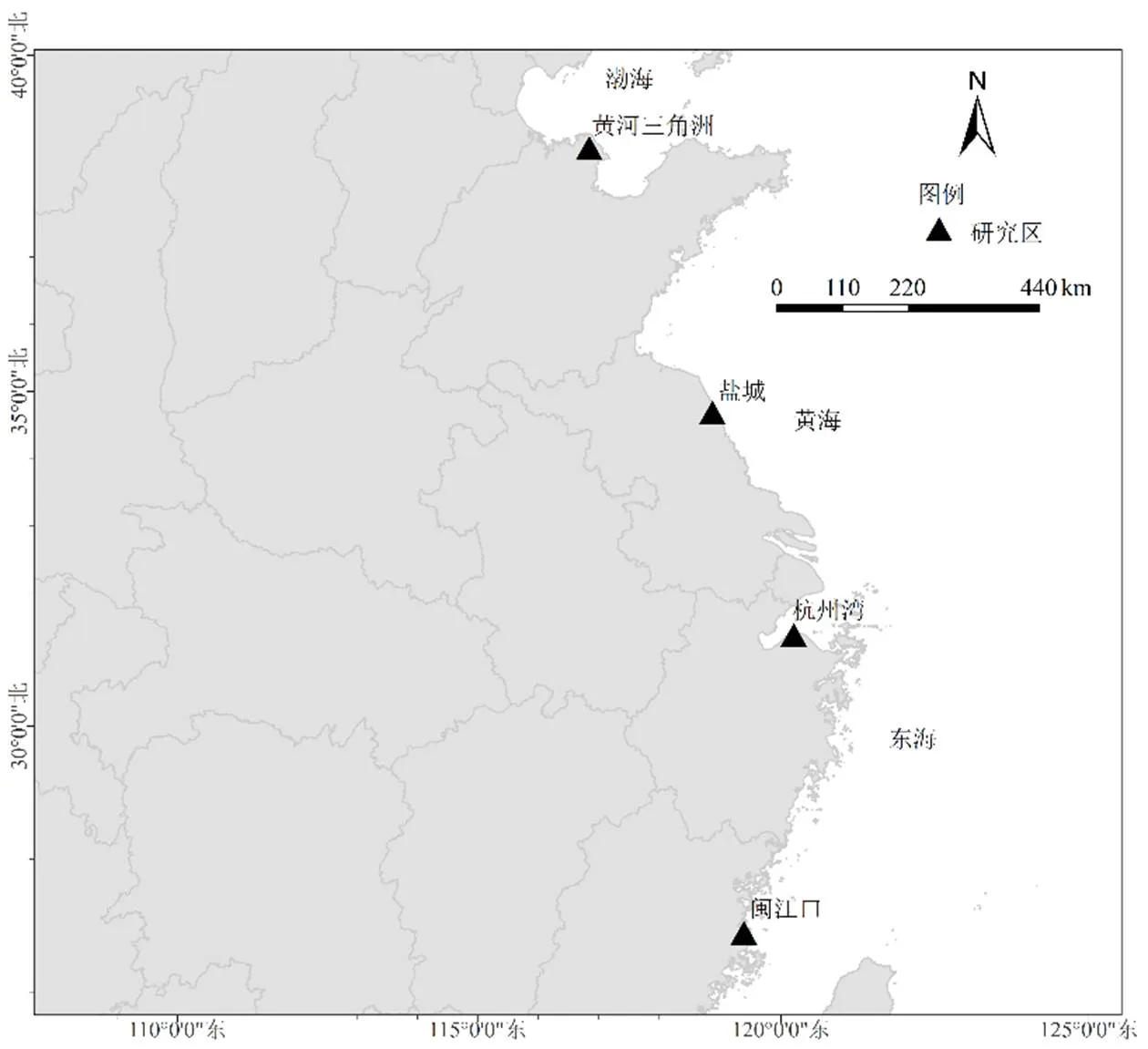
图1 研究区分布
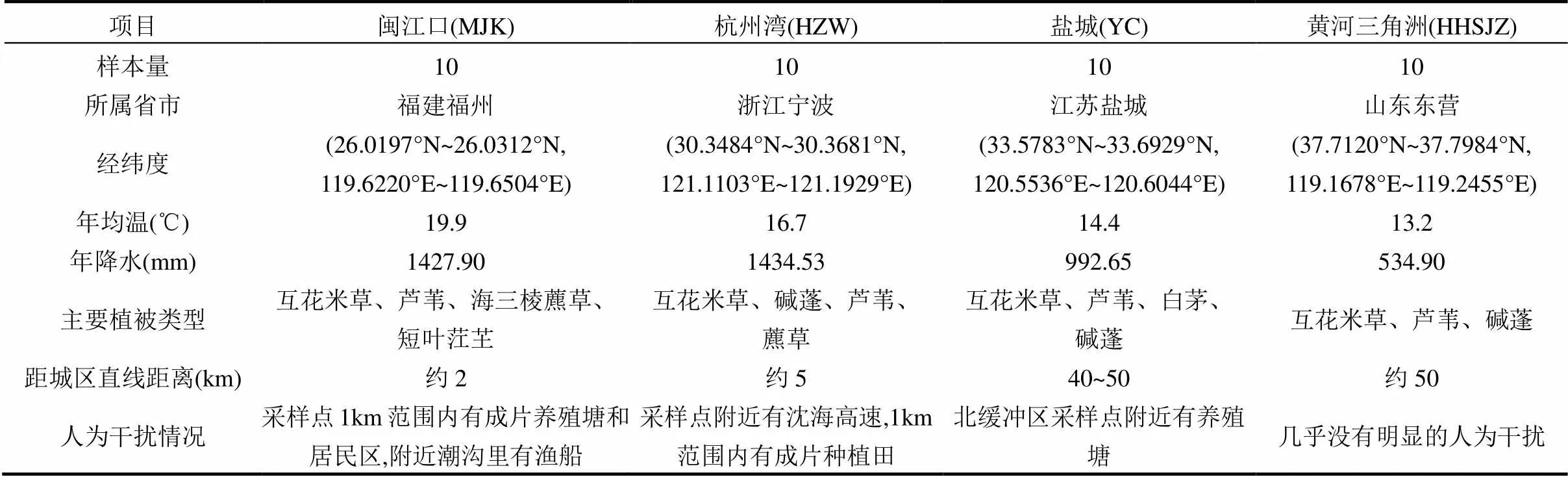
表1 研究区气候、植被及干扰情况
注:从国家气象信息中心(http://www.cma.gov.cn/2011qxfw/2011qsjgx/)下载离采样点最近台站的地面累年值数据集(1981~2010年),获取年均温(MAT)和年均降水(MAP)数据.
1.2 样品采集与处理
于2018年7~8月分别在4个研究区采集土壤样品,并进行地上植被调查.每个研究区设置10个采样点,其中5个为互花米草单优群落样点(互花米草湿地),另5个对照点为没有互花米草的本地种单优或者共优群落样点(其它盐沼湿地),尽量保证每一对试验样点和对照样点与海岸线的距离一致,且样点两两之间的间隔大于150m.取样时,在每个样点设置1m×1m样方、在样方内按照5点梅花取样法采集0~ 20cm深度的土样约1kg,混合均匀,同时调查地上植被的种类、丰度、盖度和多度.采集完的土样装入塑封袋后快速低温运回实验室,剔除枯落物和石子,自然风干,研磨过筛.
1.3 样品测定
土壤理化性质主要参照《土壤农业化学分析方法》[35]中的方法进行测定.土壤pH值采用pH计测定(水、土体积比为2.5:1);土壤有机质(SOM)采用低温外热重铬酸钾氧化-比色法测定;土壤电导率(EC)采用土壤电导率仪测定(水、土体积比为5:1);土壤总氮(TN)采用凯氏定氮法测定;氨氮(NH4+-N)采用氯化钾浸提,水杨酸分光光度法测定;含水率(MC)采用烘干法测定;总磷(TP)和总铁(TFe)采用硝酸、高氯酸、氢氟酸微波消解,ICP(IRIS IntrepidⅡXSP, Thermo)测定.
总汞(THg)采用湿法消解-冷原子荧光法测定,HNO3-HCl混合液沸水浴消解[36],智能冷原子荧光测汞仪(SYG-Ⅱ型,浙江光学仪器厂)测定.甲基汞(MeHg)采用质量分数为25% KOH-甲醇溶液振荡萃取,加四乙基硼化钠溶液反应,用MERX-M全自动烷基汞分析仪(Model Ⅲ, Brooks Rand Labs)测定[37].在甲基汞的测定过程中,采用平行实验、加标回收进行质量控制,样品的加标回收率在80%~ 105%之间.
%MeHg用甲基汞(MeHg)比上总汞(THg)求得,用来表示土壤中汞的甲基化程度,由于一般土壤中甲基汞的去甲基化速率较低[38],%MeHg也可以用来表示土壤汞的甲基化率.
1.4 数据分析
采用SPSS 22.0进行-检验和方差分析,用-检验检测同一研究区不同湿地类型THg、MeHg和%MeHg的差异,用单因素方差分析比较不同研究区THg、MeHg和%MeHg的差异,以及不同研究区不同湿地类型的基本土壤理化性质间的差异,用多因素方差分析研究区、湿地类型以及二者交互作用对THg、MeHg和%MeHg的影响.采用Origin2017对%MeHg和THg进行曲线拟合和作图.采用R的corrplot包进行相关分析和作图.
2 结果与分析
2.1 不同研究区不同湿地类型土壤基本理化性质
不同研究区土壤理化性质表现出一定差异(表2).主要体现在闽江口的土壤pH值显著低于其它3个区域(<0.05),土壤呈中性或接近中性的状态,而其它3个地区的土壤为碱性;闽江口的有机质、总氮和总铁则显著高于其他3个区域.黄河三角洲的电导率(即盐度)显著高于其它3个区域.
互花米草入侵对土壤的理化性质也产生了显著影响,显著降低了pH值(YC)、有机质(MJK)和电导率(HHSJZ),显著增加了含水率(YC和HHSJZ)和总磷(YC).在闽江口地区,互花米草湿地的有机质相对于其它盐沼湿地降低了35.6%;在盐城地区,互花米草的入侵使pH值降低,土壤含水率增加了30.4%,总磷增加了49.3%;在黄河三角洲地区,互花米草的入侵使电导率降低了28.5%,含水率增加了37.1%.
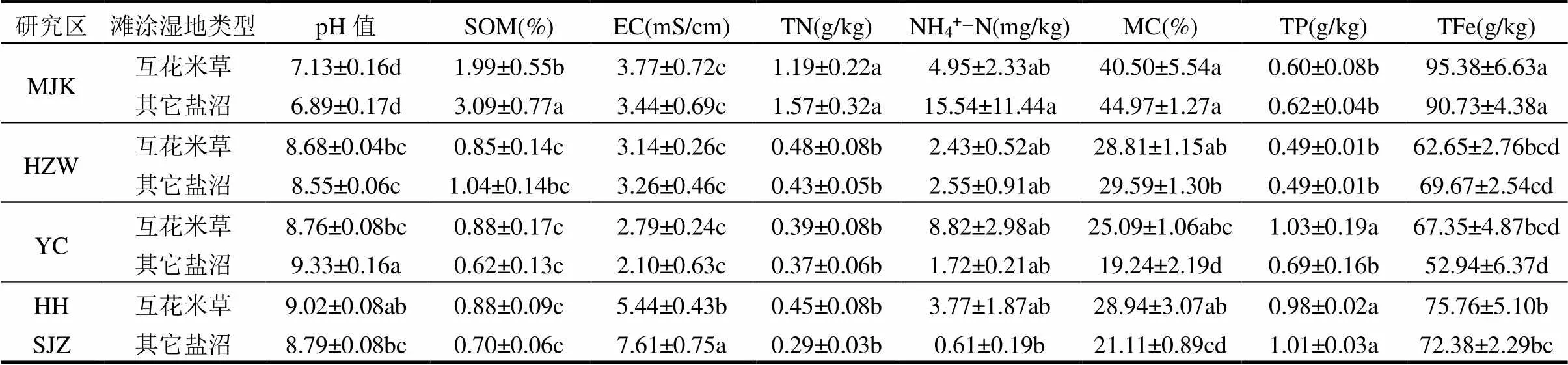
表2 不同研究区不同类型湿地土壤理化指标
注:同一列数据后不同字母表示差异显著(<0.05),“±”后的数字表示标准误差,即“平均值±标准误差”.“SOM”表示有机质“EC”表示电导率,“TN”表示总氮,“NH4+-N”表示氨氮,“MC”表示含水率,“TP”表示总磷,“TFe”表示总铁,下同.
2.2 不同研究区土壤汞、甲基汞和甲基化率特征
纬度梯度对THg、MeHg、%MeHg均产生了极显著的影响(<0.01)(表3),不同研究区间的THg和MeHg存在显著差异(图2).闽江口的THg相对最高,其含量为(115.327±18.220)μg/kg,显著高于杭州湾((37.792±3.761)μg/kg)、盐城((8.843±1.688)μg/kg)和黄河三角洲((27.690±4.359)μg/kg)地区(<0.05)(图2a).盐城地区的MeHg相对最低,其含量为(0.191±0.027)μg/kg,显著低于闽江口(0.361±0.065μg/kg)、杭州湾((0.589±0.134)μg/kg)和黄河三角洲((0.511±0.059)μg/kg)地区(图2b).盐城地区的THg和MeHg都较低,但是%MeHg比较高,平均接近3%,显著高于闽江口和杭州湾地区(图2c).
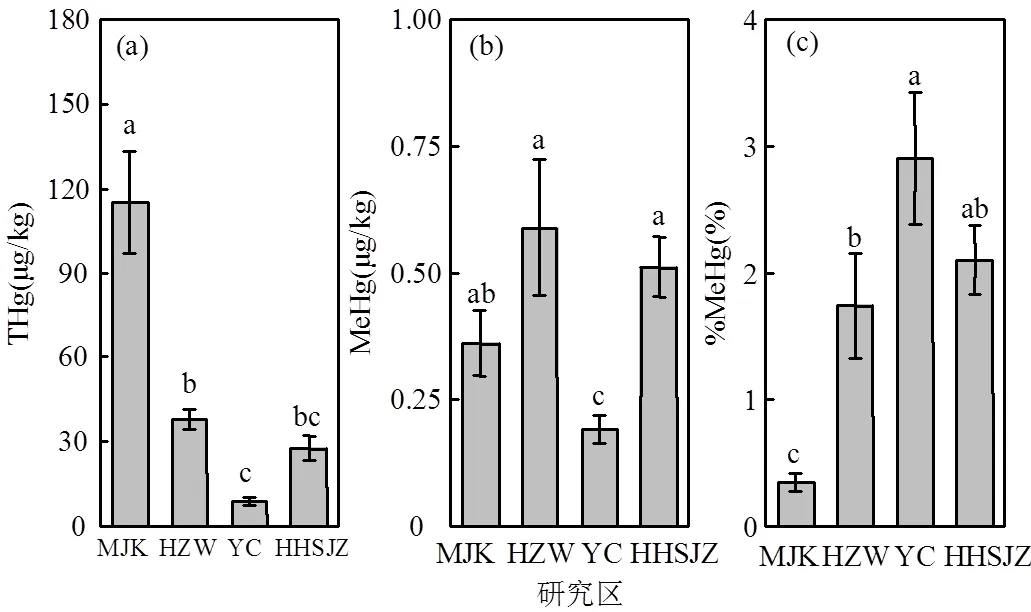
图2 不同研究区土壤汞(THg)、甲基汞(MeHg)和甲基化率(%MeHg)
不同小写字母表示不同研究区间的显著差异(<0.05)
2.3 不同湿地类型土壤汞、甲基汞和甲基化率特征
综合4个研究区进行分析,互花米草入侵(湿地类型)均未对THg、MeHg、%MeHg产生显著影响(表3).但是从单个研究区来看,除了在闽江口表现出互花米草湿地的THg显著低于其它盐沼湿地的THg外(<0.05),其它地区互花米草湿地的THg均高于其它盐沼湿地,其中黄河三角洲达到显著水平(图3a).在闽江口和杭州湾地区,互花米草湿地MeHg均低于其它盐沼湿地的MeHg,但未达到显著水平;在盐城和黄河三角洲地区,互花米草湿地的MeHg均高于其它盐沼湿地的MeHg,且黄河三角洲达到显著水平(图3b),黄河三角洲互花米草湿地的MeHg相对于盐沼湿地增加了95.0%.闽江口和黄河三角洲的互花米草和盐沼湿地的%MeHg相当,但杭州湾和盐城互花米草湿地的%MeHg均低于其它盐沼湿地,不过均没有达到显著水平(图3c).
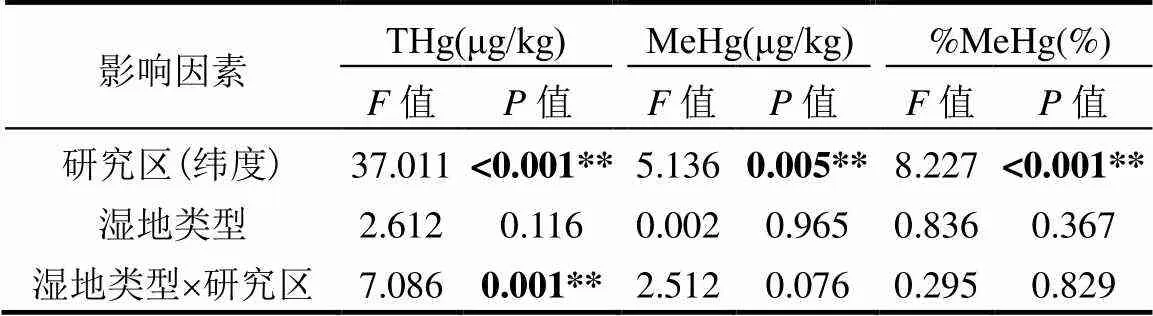
表3 研究区和湿地类型对土壤汞(THg)、甲基汞(MeHg)和甲基化率(%MeHg)的影响
注:**表示极显著相关,0.01;值表示检验统计量值.
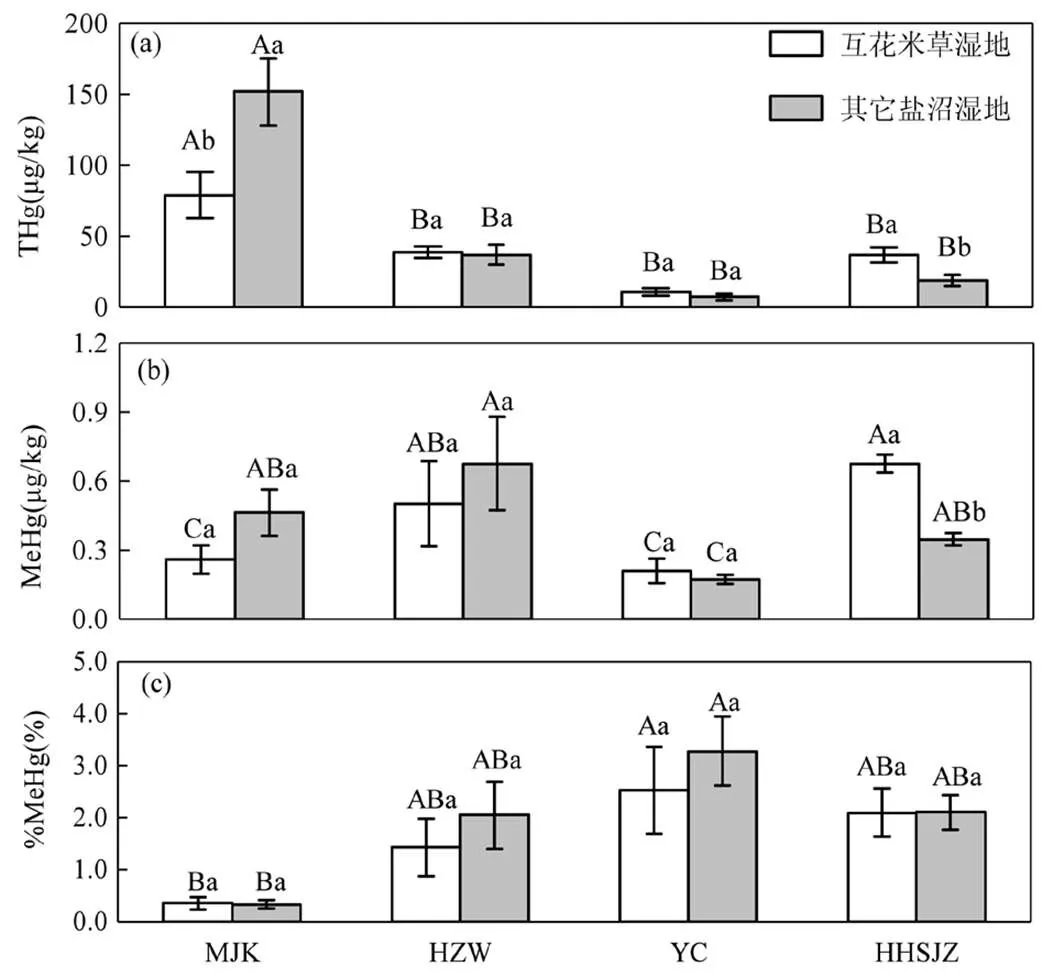
研究区
同一湿地类型不同研究区的显著差异(<0.05)用大写字母表示,同一研究区不同湿地类型间的显著差异(<0.05)用小写字母表示,误差棒表示标准误差
在互花米草和其他盐沼湿地,MeHg和THg均没有显著的相关关系(图4a),而%MeHg和THg之间均呈现显著的负相关关系(0.01),且二者之间的关系存在一个临界值(20~30μg/kg之间),当THg小于这个临界值时,随着THg含量的增加,%MeHg快速降低,而当THg大于这个临界值时,%MeHg缓慢逐渐降低(图4b).与其他盐沼湿地相比,互花米草湿地的THg临界值略微增加.以THg含量30μg/kg为界限对所有样本进行划分,THg<30μg/kg的样本数量为19个(其中互花米草样本8个,其他盐沼样本11个), THg>30μg/kg的样本数量为21个(其中互花米草样本12个,其他盐沼样本9个),然后分别对两部分的%MeHg与环境因子的相关性进行分析.发现当THg<30μg/kg时,%MeHg与THg关系密切,而与环境因子的相关性较弱,只与pH值显著正相关(0.05);而当THg>30μg/kg时,%MeHg不仅与THg相关,还与环境因子年均温、pH值、总氮、含水率和总铁显著相关(表4).
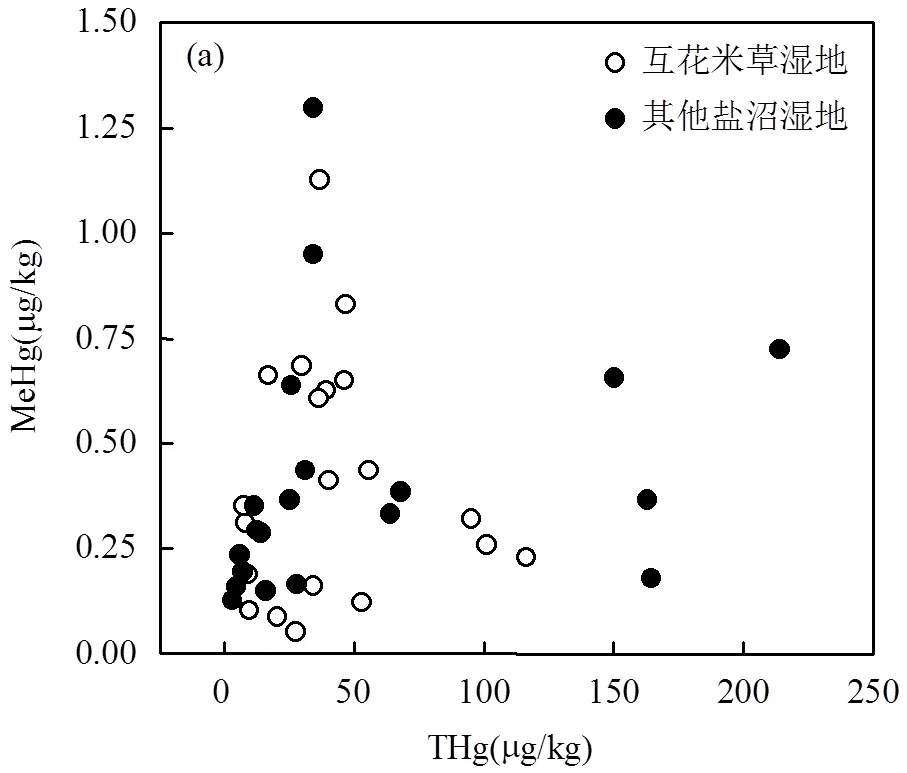
虚线代表互花米草湿地,实线代表其它盐沼湿地

表4 不同汞浓度下盐沼湿地土壤汞甲基化率(%MeHg)与环境因子的相关系数
注:1.“总体”表示所有样本%MeHg与环境因子的相关程度;“THg<30”表示THg<30μg/kg时%MeHg与环境因子的相关程度;“THg>30”表示THg>30μg/kg时%MeHg与环境因子的相关程度.2.*表示显著相关,0.05;**表示极显著相关,0.01.
2.4 不同湿地类型土壤甲基汞和甲基化率与环境因子的关系
在互花米草和其他盐沼湿地,MeHg与各环境因子的相关性较弱,只有互花米草湿地的MeHg与电导率的相关关系达到显著水平(<0.05)(图5a).影响两种湿地类型土壤%MeHg的环境因子存在较大的差异,在互花米草湿地,%MeHg只与纬度、年均温、pH值和总铁显著相关(图5a),但是在其他盐沼湿地,%MeHg与纬度、年均温、pH值、有机质、总氮、含水率和总铁均显著相关(图5b).通过对比图5a和b可以发现,与其他盐沼湿地相比,互花米草湿地% MeHg与环境因子的相关性有所减弱.
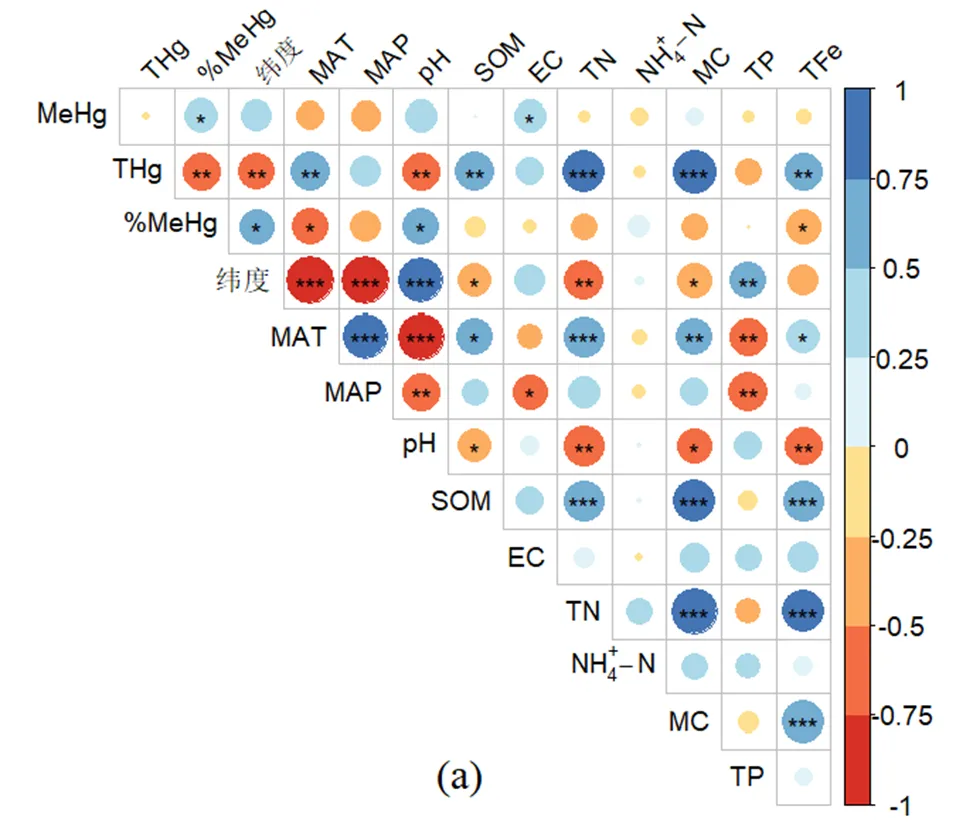
a为互花米草湿地,b为其它盐沼湿地.圆面积的大小表示Pearson相关系数(圆面积越大相关系数越大),椭圆的颜色表示负(红色)或正(蓝色)相关,图右边为相关系数标度;*表示<0.05,**表示<0.01,***表示<0.001
3 讨论
3.1 不同研究区土壤甲基汞和甲基化率特征
在4个研究区中,MeHg含量高低顺序表现为杭州湾>黄河三角洲>闽江口>盐城,该结果由多方面因素导致.其中一个重要的原因是生物可利用态汞的含量,生物可利用态汞含量在一定程度上决定了土壤中的甲基汞含量[39].盐城地区的THg很低,生物可利用态汞也相应较少,产生的MeHg总量也相对较少.在闽江口地区,虽然THg的含量相对较高,但是由于有机质含量也很高(表2),有机质与二价汞结合降低了汞的生物可利用性,从而抑制了汞的甲基化过程[40-41].地上植被的种类也可能是一个十分重要的因素.闽江口相对其它地区特有海三棱藨草和短叶茳芏两种植物,而目前有研究表明海三棱藨草对重金属的累积能力要强于芦苇[42],可能对MeHg的吸收累积能力也要更强,从而使闽江口土壤中的MeHg含量相对较少.%MeHg则表现为盐城>黄河三角洲>杭州湾>闽江口,正好与THg含量顺序呈现出完全相反的情况,这也很好地印证了%MeHg与THg的负相关关系.%MeHg受到THg含量的强烈影响,而不同研究区的THg含量主要受到污染源强度的影响.%MeHg与THg呈现出负相关关系,主要是因为THg含量越低,与微生物接触越充分,能被转化成MeHg的THg比率越高.
3.2 互花米草入侵对盐沼湿地土壤甲基汞的影响
本研究通过对跨纬度的4个研究区进行分析发现,互花米草入侵对盐沼湿地土壤的MeHg没有显著影响(表3),只有黄河三角洲的互花米草湿地和其它盐沼湿地MeHg含量呈现显著差异(图3).这是因为互花米草入侵对于土壤中MeHg含量的影响途径是十分复杂的.一方面,互花米草由于其发达的根系能促进湿地土壤中重金属Hg等的累积[23,43],从而增加土壤中MeHg的含量.互花米草还能通过增加土壤中的产甲烷菌数量[31-32],从而间接促进MeHg的生成.而另一方面,互花米草又由于地上部分的养分库和重金属库均大于芦苇和海三棱藨草等本地种,其叶子在生长过程中能持续积累重金属[44],所以能通过增加植物体内的MeHg从而减少土壤中MeHg含量.此外,互花米草入侵还会显著降低或增高土壤pH值、有机质、含水率等理化指标[24-30],从而影响MeHg含量.多种途径共同作用,相互影响和抵消,从而导致整体上互花米草入侵对盐沼湿地土壤MeHg含量的影响较弱.黄河三角洲相对其他区域的特别之处在于其纬度相对最高(图1),以及电导率(盐度)显著较高(表2).生物量是影响植物体重金属累积量的关键因素[45],而黄河三角洲由于纬度较高,互花米草生长相对较差,植株盖度和高度较小,其植株体对Hg和MeHg的累积作用相对减小,所以对土壤中MeHg的减少作用较小.又由于黄河三角洲其他盐沼湿地电导率(盐度)较高(表2),虽然适当的增加盐度能促进汞的甲基化作用,但是过高的盐度对汞甲基化有显著的抑制作用[46-47],所以盐度成为该地汞甲基化的一个限制因子.互花米草入侵显著降低了电导率(表2),从而使抑制作用降低,MeHg含量增加.所以在黄河三角洲地区,互花米草入侵对土壤中MeHg的增加作用比较显著.
本研究发现,无论是互花米草湿地还是其它盐沼湿地,MeHg和THg之间均缺乏线性相关关系(图4a),说明互花米草入侵并没有改变MeHg和THg之间的关系.另外,Canário等[48]和周心劝等[37]对河口盐沼湿地和沼泽湿地的研究也表明MeHg和THg之间缺乏线性相关关系.而Holloway等[14]对加利福尼亚历史汞矿区土壤和沉积物的研究则认为THg与MeHg的关系存在一个阈值,当THg含量低于20mg/kg时,MeHg含量随THg含量的增加而增加,当THg含量高于20mg/kg时,MeHg和THg之间相关关系减弱.这可能是由于研究对象和研究时间的差异导致.
3.3 互花米草入侵对盐沼湿地土壤汞甲基化率的影响
%MeHg主要与pH值显著正相关,与总氮、含水率、有机质和总铁显著负相关(表4),而其中pH值、含水率和有机质都受到了互花米草入侵的显著影响(表2).但是通过进一步比较互花米草湿地和其它盐沼湿地中影响%MeHg的环境因子发现,互花米草湿地的%MeHg与环境因子的相关关系减弱,原本对盐沼湿地土壤%MeHg影响显著的有机质、总氮、含水率不再产生显著影响,原本极显著相关的总铁变成显著相关(图5).这说明互花米草的入侵可以通过影响土壤环境因子进而影响到%MeHg,但是由于存在与化学平衡中“勒夏特列”原理[49]相似的机制存在,汞和甲基汞的相互转化过程会趋向于减弱环境因子改变造成的影响,这可能是导致互花米草对盐沼湿地土壤%MeHg影响较弱的重要原因之一.此外,互花米草入侵引起的土壤微生物群落结构与环境因子相关性减弱[50]也可能是导致%MeHg与环境因子相关性减弱,从而导致互花米草对盐沼湿地土壤%MeHg影响较弱的重要原因.
本研究发现在互花米草和其它盐沼这两类湿地中%MeHg和THg均呈现极显著的负相关关系(图4),且二者之间的关系存在一个临界值(20~30μg/kg之间).互花米草的入侵会造成临界值的略微增加,但不改变整体趋势.通过以THg含量30μg/kg为界,进一步对临界值两侧样本的%MeHg与环境因子的相关性进行分析,发现当THg小于临界值时,%MeHg与THg含量关系密切,与环境因子的相关性较弱;而当THg大于临界值时,%MeHg不仅与THg相关,还受到pH值、总氮、含水率和总铁等环境因子显著影响(表4).这说明汞的甲基化是一个微生物驱动但受THg含量和环境因子影响的过程,当THg低于临界值时,汞的甲基化程度主要取决于THg含量,与环境因子的相关性较弱;而当THg高于临界值时,汞源相对充足,汞的甲基化程度则受到环境因子和微生物因素的显著影响.THg的临界值可能取决于微生物对汞胁迫产生响应时的THg含量,因为低浓度的汞胁迫会增加有甲基化作用的微生物的数量,促进汞的甲基化.Liu等[51]研究表明总汞含量与厚壁菌的数量存在极显著的正相关关系,而厚壁菌中的许多菌种具有甲基化能力[18].互花米草入侵造成THg临界值的变化可能是因为在不同的环境中对土壤微生物产生胁迫的THg值有所差异.要想十分清楚地解释互花米草入侵对汞甲基化影响的机理,需要综合考虑环境因子、Hg、MeHg和微生物之间的相互关系,所以后期的相关研究需要更多考虑土壤微生物,尤其是具有汞甲基化功能的微生物.
4 结论
4.1 4个研究区THg含量高低顺序为闽江口(115.327±18.220μg/kg)>杭州湾(37.792±3.761μg/ kg)>黄河三角洲(27.690±4.359μg/kg)>盐城(8.843± 1.688μg/kg);MeHg含量为杭州湾(0.589±0.134μg/ kg)>黄河三角洲(0.511±0.059μg/kg)>闽江口(0.361± 0.065μg/kg)>盐城(0.191±0.027μg/kg);%MeHg为盐城(2.90%±0.52)>黄河三角洲(2.10%±0.27%)>杭州湾(1.74%±0.41%)>闽江口(0.35%±0.06%).
4.2 综合4个研究区进行分析发现,互花米草入侵对盐沼湿地土壤的MeHg和%MeHg没有显著影响,只有在黄河三角洲地区,互花米草的入侵显著增加了MeHg含量(95.0%).无论在互花米草还是其它盐沼湿地,MeHg和THg间均缺乏线性相关关系.
4.3 互花米草入侵会显著影响盐沼湿地土壤的pH值、有机质、总磷、含水率和电导率,%MeHg与pH值、有机质、总氮、含水率和总铁显著相关,但是互花米草入侵对%MeHg的影响较弱.在两种湿地类型中,%MeHg和THg均呈现极显著的负相关关系,且二者之间的关系存在一个临界值(20~30μg/kg之间),当THg小于临界值时,%MeHg与环境因子相关性较弱;当THg大于临界值时,%MeHg与环境因子显著相关.
[1] 冯新斌,仇广乐,付学吾,等.环境汞污染[J]. 化学进展, 2009,21(2): 436-457.Feng X B, Qiu G L, Fu X W, et al. Mercury pollution in the environment [J]. Chemical Progress, 2009,21(2):436-457.
[2] 杨永奎,王定勇.大气汞的时空分布研究进展[J]. 四川环境, 2007,25(6):91-95. Yang Y K, Wang D Y. Research progress in temporal and spatial distribution of atmospheric mercury[J]. Sichuan Environment, 2007, 25(6):91-95.
[3] Dunagan S C, Gilmore M S, Varekamp J C. Effects of mercury on visible/near-infrared reflectance spectra of mustard spinach plants (Brassica rapa P.) [J]. Environmental Pollution, 2007,148(1):301-311.
[4] Selin, Noelle E. A proposed global metric to aid mercury pollution policy [J]. Science, 2018,360(6389):607-609.
[5] United Nations Environment Programme (UNEP). Global Mercury Assessment [R]. 2018:12-13.
[6] Bachand P A M, Bachand S M, Fleck J A, et al. Reprint of “Methylmercury production in and export from agricultural wetlands in California, USA: The need to account for physical transport processes into and out of the root zone”[J]. Science of The Total Environment, 2014,484:249-262.
[7] 王 锐,任 锐,刘世凯.甲基汞的生殖毒性及其研究进展[J]. 环境卫生学杂志, 2001,28(4):215-217. Wang R, Ren R, Liu S K. Reproductive toxicity of methylmercury and its research progress [J]. Journal of Environmental Hygiene, 2001, 28(4):215-217.
[8] 王 丽,贾 光.甲基汞的发育毒性及其研究进展[J]. 卫生研究, 2005,34(5):633-635. Wang L, Jia G. Progress in developmental toxicity of methylmercury [J]. Health Research, 2005,34(5):633-635.
[9] Parks J M, Johs A, Podar M, et al. The genetic basis for bacterial mercury methylation [J]. Science, 2013,339(6125):1332-1335.
[10] Gilmour C C, Podar M, Bullock A L, et al. Mercury methylation by novel microorganisms from new environments [J]. Environmental Science & Technology, 2013,47(20):11810-11820.
[11] Schaefer J K, Rocks S S, Zheng W, et al. Active transport, substrate specificity, and methylation of Hg (II) in anaerobic bacteria [J]. Proceedings of the National Academy of Sciences, 2011,108(21): 8714-8719.
[12] King J K, Kostka J E, Frischer M E, et al. Sulfate-reducing bacteria methylate mercury at variable rates in pure culture and in marine sediments [J]. Applied and Environmental Microbiology, 2000,66(6): 2430-2437.
[13] Biswas A, Brooks S C, Miller C L, et al. Bacterial growth phase influences methylmercury production by the sulfate-reducing bacterium Desulfovibrio desulfuricans ND132 [J]. Science of the Total Environment, 2011,409(19):3943-3948.
[14] Holloway J A M, Goldhaber M B, Scow K M, et al. Spatial and seasonal variations in mercury methylation and microbial community structure in a historic mercury mining area, Yolo County, California [J]. Chemical Geology, 2009,267(2):85-95.
[15] Kotnik J, Horvat M, Fajon V, et al. Mercury in small freshwater lakes: A case study: Lake Velenje, Sovenia [J]. Water, Air, and Soil Pollution, 2002,134(4):319-339.
[16] Ullrich S M, Tanton T W, Abdrashitova S A. Mercury in the aquatic environment: A review of factors affecting methylation [J]. Critical Reviews in Environmental Science and Technology, 2001,31(3): 241-293.
[17] Bravo A G, Kothawala D N, Attermeyer K, et al. The interplay between total mercury, methylmercury and dissolved organic matter in fluvial systems: A latitudinal study across Europe [J]. Water Research, 2018,144:172-182.
[18] 任家盈,姜 霞,陈春霄,等.太湖营养状态对沉积物中总汞和甲基汞分布特征的影响[J]. 中国环境科学, 2013,33(7):1290-1297. Ren J Y, Jang X, Chen C X, et al. The Effect of nutrition status on sediments distribution characteristics of total mercury and methylmercury in Lake Taihu [J]. Chinese Environmental Science, 2013,33(7):1290-1297.
[19] 毕 丽,贺纪正,张丽梅,等.环境中汞微生物转化研究进展[J]. 环境化学, 2018,37(11):2358-2367. Bi L, He J Z, Zhang L M, et al. Microbial transformations of mercury in the environment [J]. Environmental Chemistry, 2018,37(11):2358- 2367.
[20] Podar M, Gilmour C C, Brandt C C, et al. Global prevalence and distribution of genes and microorganisms involved in mercury methylation [J]. Science Advances, 2015,1(9):e1500675-e1500675.
[21] 宋连清.互花米草及其对海岸的防护作用[J]. 东海海洋, 1997,15(1): 11-19.Song L Q.and its effects of the coastal protection [J]. East China Sea Ocean, 1997,15(1):11-19.
[22] Chen L, Gao J H, Zhu Q G, et al. Accumulation and output of heavy metals by the invasive plantin a coastal salt marsh [J]. Pedosphere, 2018,28(6):884-894.
[23] 陈 权,马克明.互花米草入侵对红树林湿地沉积物重金属累积的效应与潜在机制[J]. 植物生态学报, 2017,41(4):26-34. Chen Q, Ma K M. Effects ofinvasion on enrichment of sedimental heavy metals in a mangrove wetland and the underlying mechanisms [J]. Journal of Plant Ecology, 2017,41(4): 26-34.
[24] 白 静,严锦钰,何东进,等.互花米草入侵对闽东滨海湿地红树林土壤理化性质和酶活性的影响[J]. 北京林业大学学报, 2017,39(1): 70-77. Bai J, Yan J Y, He D J, et al. Effects ofinvasion in eastern Fujian coastal wetland on the physicochemical properties and enzyme activities of mangrove soil [J]. Journal of Beijing Forestry University, 2017,39(1):70-77.
[25] 金宝石,闫鸿远,王维奇,等.互花米草入侵下湿地土壤碳氮磷变化及化学计量学特征[J]. 应用生态学报, 2017,28(5):1541-1549.Jin B S, Yan H Y, Wang W Q, et al. Changes of soil carbon, nitrogen and phosphorus and stoichiometry characteristics in marsh invaded by[J]. Chinese Journal of Applied Ecology, 2017, 28(5):1541-1549.
[26] 金宝石,闫鸿远,章文龙,等.互花米草入侵下闽江河口沼泽土壤中各形态氮含量和储量[J]. 湿地科学, 2017,15(3):375-384. Jin B S, Yan H Y, Zhang W L, et al. Contents and storages of various forms of nitrogen in soils of wetlands in the Min river estuary underinvasion [J]. Wetland Science, 2017,15(3):375- 384.
[27] 布乃顺,胡 悦,杨 骁,等.互花米草入侵对长江河口湿地土壤理化性质的影响[J]. 长江流域资源与环境, 2017,26(1):102-111. Bu N S, Hu Y, Yang X, et al. Effects ofinvisio non soil physical and chemical properties in wetlands of the Yangtz eriver estuary [J]. Resources and Environment of the Yangtze River Basin, 2017,26(1):102-111.
[28] 布乃顺,杨 骁,黎光辉,等.互花米草入侵对长江口湿地土壤碳动态的影响[J]. 中国环境科学, 2018,38(7):2671-2679. Bu N S, Yang X, Li G H, et al. Effects ofinvasion on soil carbon dynamics in wetlands of the Yangtze River estuary [J]. Chinese Environmental Science, 2018,38(7):2671-2679.
[29] Liao C Z, Luo Y Q, Fang C M, et al. Litter pool sizes, decom- position,and nitrogen dynamics in-invadedand native coastal marshlands of the Yangtze Estuary, China [J]. Oecologia, 2008,156(3):589-600.
[30] Tong C, Zhang L H, Wang W Q, et al. Contrasting nutrient stocks and litter decomposition in stands of native invasive species in a sub- tropical estuarine marsh [J]. Environmental Research, 2011,111(7): 909-916.
[31] 项 剑,刘德燕,袁俊吉,等.互花米草入侵对沿海湿地甲烷排放的影响[J]. 生态学杂志, 2012,31(6):1361-1366. Xiang J, Liu D Y, Yuan J J, et al. Effects ofinvasion on methane emission from coastal brackish marsh. Chinese Journal of Ecology, 2012,31(6):1361-1366.
[32] Zeleke J, Sheng Q, Wang J G, et al. Effects ofinvasion on the communities of methanogens and sulfate-reducing bacteria in estuarine marsh sediments [J]. Frontiers in Microbiology, 2013,4:1-13.
[33] 布乃顺,杨 骁,郭 昊,等.互花米草入侵对长江河口湿地CH4排放的影响[J]. 中国环境科学, 2018,38(10):3949-3958. Bu N S, Yang X, Guo H et al. Effects ofinvasion on CH4emissions from wetlands of the Yangtze River estuary, China [J]. Chinese Environmental Sciences, 2018,38(10):3949-3958.
[34] 潘小翠,管 铭,张崇邦,等.互花米草入侵对滩涂湿地甲烷排放的影响[J]. 应用生态学报, 2016,27(4):1145-1152. Pan X C, Guan M, Zhang C B, et al. Effects ofinvasion on methane emission in coastal salt marsh Chinese [J]. Chinese Journal of Applied Ecology, 2016,27(4):1145- 1152.
[35] 鲁如坤.土壤农业化学分析方法[M]. 北京:中国农业科技出版社, 2000. Lu R K. Soil agricultural chemical analysis method [M]. Beijing: China Agricultural Science and Technology Press, 2000.
[36] 张海谷,张 杰.冷原子荧光光度法测定土壤中汞[J]. 绿色科技, 2011,(5):9-10. Zhang H G, Zhang J. Analysis of Cold Vapor Atomic Fluorescence Spectrometry determination of mercury in soil [J]. Journal of Green Science and Technology, 2011,(5):9-10.
[37] 周心劝,刘玉荣,李 晶,等.大兴安岭南瓮河湿地类型对土壤中甲基汞分布的影响[J]. 环境科学, 2018,39(12):5480-5486. Zhou X Q, Liu Y R, Li J, et al. Effects of wetland types on distribution of soil methylmercury based on the region of Nanweng River in the Greater Xing’an Mountains [J]. Environmental Science, 2018,39(12):5480-5486.
[38] 钟顺清,仇广乐,冯新斌,等.铁硫耦合影响甲基汞在土壤-水稻系统中迁移转化的研究进展[J]. 生态学杂志, 2017,36(8):2351-2357. Zhong S Q, Qiu G L, Feng X B, et al. Coupling of iron and sulfur on the migration and transformation of methylmercury in soilrice system: A review [J]. Chinese Journal of Ecology, 2017,36(8):2351-2357.
[39] 孟其义,钱晓莉,陈 淼,等.稻田生态系统汞的生物地球化学研究进展[J]. 生态学杂志, 2018,37(5):1556-1573. Meng Q Y, Qian X L, Chen M, et al. Biogeochemical cycle of mercury in rice paddy ecosystem: A critical review [J]. Chinese Journal of Ecology, 2018,37(5):1556-1573.
[40] 张怀静,翟世奎,周勇华,等.闽浙沿岸海域沉积物中汞和甲基汞的含量分布及其影响因素[J].海洋地质与第四纪地质, 2016,36(6): 163-174. Zhang H J, Zhai S K, Zhou Y H, et al. Distributions of mercury and methylmercury in sediments of Min-Zhe coastal area and influencing factors [J]. Marine geology and Quaternary geology, 2016,36(6):163- 174.
[41] 胡海燕,冯新斌,曾永平,等.汞的微生物甲基化研究进展[J]. 生态学杂志, 2011,30(5):874-882. Hu H Y, Feng X B, Zeng YP, et al. Progress in research on microbial methylation of mercury [J]. Chinese Journal of Ecology, 2011,30(5): 874-882.
[42] 毕春娟,陈振楼,许世远.芦苇与海三棱藨草中重金属的累积及季节变化[J]. 海洋环境科学, 2003,22(2):6-9.Bi C J, Chen Z L, Xu S Y. Accumulation and seasonal variation of heavy metals inand[J]. Marine Environmental Science, 2003,22(2):6-9.
[43] 张龙辉,杜永芬,王丹丹,等.江苏如东互花米草盐沼湿地重金属分布及其污染评价[J]. 环境科学, 2014,35(6):2401-2410. Zhang L H, Du Y F, Wang D D, et al. Distribution patterns and pollution assessments of heavy metals in theSalt-Marsh Wetland of Rudong, Jiangsu Province [J]. Environmental Science, 2014,35(6):2401-2410.
[44] 杨 东,万福绪.外来入侵种互花米草的研究进展[J]. 植物保护, 2014,40(2):5-10. Yang D, Wan F X. Research progress on invasive alien species[J]. Plant Protection, 2014,40(2):5-10.
[45] 李富荣,段琳琳,王富华.盐沼植物互花米草的重金属富集特性研究进展[J]. 生态环境学报, 2013,22(7):1263-1268. Li F R, Duan L L, Wang F H. Research progress in heavy metal accumulation of the halophyte[J]. Journal of Ecological Environment, 2013,22(7):1263-1268.
[46] De oliveira D C M, Correia R R S, Marinho C C, et al. Mercury methylation in sediments of a Brazilian mangrove under different vegetation covers and salinities [J]. Chemosphere, 2015,127:214-221.
[47] 郑顺安,周 玮,薛颖昊,等.污灌区盐分累积对外源汞在土壤中甲基化的影响[J]. 中国环境科学, 2017,37(11):197-203. Zheng S A, Zhou W, Xue Y H, et al. Investigating effect of salinity on methylation of exogenous mercury of soil in wastewater-irrigated area by labeling with stable isotopically enriched tracers [J]. Chinese Environmental Science, 2017,37(11):197-203.
[48] Canário J, Vale C, Poissant L, et al. Mercury in sediments and vegetation in a moderately contaminated salt marsh (Tagus Estuary, Portugal) [J]. Journal of Environmental Sciences, 2010,22(8):1151- 1157.
[49] 熊双贵,高之清.无机化学[M]. 武汉:华中科技大学出版社, 2011:63. Xiong S G, Gao Z Q. Inorganic chemistry [M]. Wuhan: Huazhong University of Science and Technology Press, 2011:63.
[50] Zhang Y Z, Pennings S C, Li B, et al. Biotic homogenization of wetland nematode communities by exotic Spartina alterniflora in China [J]. Ecology, 2019,100(4):e02596.
[51] Liu Y R, Delgado-Baquerizo M, Bi L, et al. Consistent responses of soil microbial taxonomic and functional attributes to mercury pollution across China [J]. Microbiome, 2018,6(1):183.
Effects ofinvasion on soil methylmercury in coastal salt marshes.
LONG Song-yuan1,2, ZHANG Man-yin1,2*, LIU Wei-wei1,2, HU Yu-kun1,2, LI Jing1
(1.Beijing Key Laboratory of Wetland Services and Restoration, Institute of Wetland Research, Chinese Academy of Forestry, Beijing 100091, China;2.Heibei Hengshuihu National Wetland Ecosystem Research Station, Hengshui 053000, China)., 2019,39(12):5200~5209
Four coastal salt marshes invaded byspanning 11 degrees of latitudes were selected, and soil totalmercury (THg), methylmercury (MeHg) contents and environmental factors were compared and analyzed betweenmarshes and other salt marshes (native specieswith no mutual growth of). The aim was to explore the effects ofinvasion on the characteristics of soil methylmercury in coastal salt marshes in China. First, among four study sites, the rank of THg content was Minjiang Estuary ((115.327±18.220) μg/kg)> Hangzhou Bay ((37.792±3.761) μg/kg)> Yellow River Delta ((27.690±4.359) μg/kg)> Yancheng ((8.843±1.688) μg/kg); the rank of MeHg content was Hangzhou Bay ((0.589±0.134) μg/kg)>Yellow River Delta ((0.511±0.059) μg/kg)>Minjiang Estuary ((0.361±0.065) μg/kg)>Yancheng (0.191±0.027 μg/ Kg). Second, the overall effect ofinvasionhad no significant effect on soil MeHg and %MeHg of coastal salt marshes except for the Yellow River Delta whereinvasion increased the MeHg content(95.0%). Third, among those two types of salt marshes, the correlation between %MeHg and THg was highly negative, and there was a threshold for this relationship (20~30μg/kg): when THg was lower than the threshold, the correlation between %MeHg and environmental factors was weak; while when THg was higher than the threshold, %MeHg was significantly correlated with environmental factorsThis study investigated the effects ofinvasion on soil methylmercury of coastal salt marshes with a large spatial span. Out study provided data supports for a more comprehensive evaluation of the impacts ofinvasion on China's coastal areas, and also provided a basis for studying the migration and transformation of mercury in coastal wetlands.
;salt marshes;mercury;methylmercury;environmental factors
X53
A
1000-6923(2019)12-5200-10
龙颂元(1995-),女,湖南衡阳人,中国林业科学研究院硕士研究生,主要研究方向为湿地生态学.
2019-05-08
国家重点研发计划(2017YFC0506205)
* 责任作者, 副研究员, cneco@126.com
