不同源胡敏酸对磺胺嘧啶紫外光降解的影响及作用机制
2019-12-26朱静平
申 霞,王 彬*,朱静平,曾 丹,谌 书,任 东,黄 莎
不同源胡敏酸对磺胺嘧啶紫外光降解的影响及作用机制
申 霞1,2,王 彬1,2*,朱静平1,曾 丹1,2,谌 书1,2,任 东3,黄 莎1,2
(1.西南科技大学环境与资源学院,四川 绵阳 621010;2.西南科技大学,固体废物处理与资源化教育部重点实验室,四川 绵阳 621010;3.西华师范大学环境科学与工程学院,四川 南充 637009)
研究了紫外光照条件下不同来源的胡敏酸(HA),包括标准品胡敏酸(SPHA)、水稻土胡敏酸(SDHA)、泥炭土胡敏酸(NTHA)和落叶覆盖地胡敏酸(LYHA)对抗生素磺胺嘧啶(SDZ)光降解的影响以及主要活性物种对其光降解效能的贡献.结果表明:SDZ在纯水中及与HA共存条件下,其光降解过程均符合一级动力学模型,且HA对SDZ的光降解具有促进作用,其促进效果从大到小为SPHA> SDHA > NTHA >LYHA. 通过羟基自由基(×OH)和单线态氧(1O2)淬灭实验发现,不同来源HA产生×OH和1O2的能力具有一定差异性.同等背景条件下,SPHA产生的×OH量相对较多,其对SDZ光降解的贡献率(26.97%)最大,而LYHA贡献相对较小(9.33%).同时,1O2对SDZ光降解起主导作用,其降解贡献率为41.33%~51.95%.
胡敏酸;磺胺嘧啶;光解动力学;羟基自由基;单线态氧
近年来,磺胺类抗生素(SAs)由于其优秀的抗菌性和便宜的价格,被广泛应用于畜牧业及人类疾病的治疗中[1-2].目前,中国已经成为世界SAs的主要生产国和出口国之一[3].磺胺嘧啶(SDZ)分子上对氨基苯酰胺的结构在人体和动物体内不能完全代谢[4],代谢不完全的部分会被排放到环境中,进入水环境中浸出的SDZ可直接导致肾脏的严重疾病,并对人体神经系统造成极大的危害[5];进入土壤环境中的SDZ及其残留物可以通过各种可逆和不可逆过程与土壤有机质(SOM)[6]相互作用,决定了SDZ在土壤中的迁移、吸附和降解,对环境风险和持久性环境评估具有重要作用[7-8].
研究表明,光化学反应是SAs降解的重要途径,其中包括直接降解和间接降解[9-10].SAs的直接光解要么通过SO2脱除[11],或者通过羟基的加入[12],从而使其发生降解;间接光化学是由天然有机质(NOM)、硝酸盐和亚硝酸盐离子等作为光敏剂[13],在阳光吸收后生成一些活性氧化物种(如羟基自由基、单线态氧、超氧自由基等),从而间接地对有机污染物实现降解的方法. SAs难以被生物降解,光降解是其在环境中的重要转化方式,这直接影响了其环境归趋和生态风险.
在土壤环境中,腐殖质(HS)是广泛存在的一类天然有机质(NOM),抗生素光化学性质受背景腐殖质(HS)的影响较大[14-15].一方面,HS是一种重要的光敏剂,它可以通过生成羟基自由基(×OH)、单线态氧(1O2)、过氧自由基(OOR)和超氧化物(O2-×)等活性氧(ROS),影响有机污染物的间接光解[15-17].另一方面,HS可以作为一个内部过滤器,竞争性地吸收光子,从而抑制有机污染物的降解[15,18].此外,HS还可能抑制ROS生成,并对有机化合物的光解和光催化降解产生不利影响[19-20].因此,HS增强[15,21-22]或者抑制[14,18,23-24]光解和光催化降解.胡敏酸(HA)作为HS的重要组分,对SAs的光降解起着重要的作用.在土壤环境中HA的来源和特征复杂,不同的HA如何影响SAs的光降解,具体是哪种环境物种起的关键作用,这些问题都还需要深入的探讨.
因此,本文以典型SDZ为模型污染物,以标准品胡敏酸(SPHA)、水稻土胡敏酸(SDHA)、泥炭土胡敏酸(NTHA)、落叶覆盖地胡敏酸(LYHA)为典型HA,研究在紫外光下,HA对SDZ光降解的影响以及主要活性物种对其光降解的贡献,为此类研究提供理论参考.
1 材料与方法
1.1 实验材料
1.1.1 实验试剂 磺胺嘧啶(SDZ,GR,纯度³99%)购自于Sigma- Aldrich公司,化学结构如图1,分子式为C10H10N4O2S;胡敏酸(工业级)、2,2,6,6-四甲基哌啶(TEMP,纯度³99%)、5,5-二甲基-1-吡咯啉-N-氧化物(DMPO,纯度³97%)购自于Sigma-Aldrich公司;NaOH (GR,纯度³98%)购买自国药集团化学试剂有限公司;乙腈、甲醇、异丙醇(HPLC,纯度³99.9%)购自于德国默克医药公司;冰乙酸(HPLC,纯度³99.8%)、叠氮化钠(NaN3,AR,纯度³99.9%)购自成都市科隆化学品有限公司;试验用水为超纯水(TOC£0.2mg/L; 18MΩ×cm).供试土壤采自四川省绵阳市青义镇水稻土、落叶覆盖地及泥炭土.
1.1.2 实验仪器 光解实验装置采用CEL- LAB500公转数控型多位光化学反应仪,购买自北京中教金源科技有限公司,光解装置配备有冷水机(LX-1000).灯源(高压汞灯500W)位于实验装置的中心位置,灯源四周设置有滤光片插槽,配备截止可见滤光片,使有效光源为200~400nm范围内的紫外光.

图1 SDZ的分子结构式
电子顺磁共振波谱仪(EMXmicro-9.5/12,德国 Bruker);高效液相色谱仪(Agilent 1260,美国);紫外分光光度计(Evolution 300,美国Thermofisher);元素分析仪(varioMACRO cube,德国Elementar).
1.2 实验方法
1.2.1 土壤中HA的提取和纯化 以国际腐殖物质协会(IHSS)推荐的方法[25]进行HA的提取纯化.将泥炭地、水稻田、落叶覆盖地提取的HA及购买的商品HA分别标记为NTHA、SDHA、LYHA、SPHA,避光干燥保存备用.
1.2.2 HA的元素分析 采用元素分析仪分别在CHNS和O两种模式下测定NTHA、SDHA、LYHA、SPHA 4种HA中C、H、N、S和O元素含量.
1.2.3 贮备液的制备 准确称取NTHA、SDHA、LYHA、SPHA各0.05g,分别加入0.1mol/L NaOH溶解后,100mL容量瓶定容并摇匀.经有机系微孔滤膜抽滤(0.45 μm)后作为4种HA母液. 配置500mg/L的SDZ作为母液,于4℃冰箱避光储存.
1.2.4 HA共存时SDZ光降解实验 移取一定体积的SPHA母液,使用超纯水配制浓度(以DOC含量计)为50mg/L的SPHA溶液,移取3mL SPHA溶液于100mL、6mg/L的SDZ工作液中混合摇匀,调节体系pH值为(7.1±0.05) (0.1mol/L乙酸、0.1mol/L NaOH).同时,在相同条件下使用同种方法分别配制SDHA、NTHA、LYHA与SDZ的混合液.将配制的混合液常温避光振荡60min,制得光解液. 各取35mL上述溶液于50mL石英光解管中置于CEL- LAB500多位光化学反应仪内进行光解实验,并设置暗反应对照组.实验中,间隔30min取样,通过高效液相色谱仪进行SDZ定量分析.
1.2.5 主要活性物种的贡献实验 向各类HA- SDZ (其中,HA分别为SPHA、NTHA、SDHA、LYHA)溶液中分别加入异丙醇(IPA)、NaN3作为×OH、1O2的淬灭剂,体系中SDZ浓度为6mg/L,各HA浓度均为50mg/L,IPA及NaN3浓度为100mmol/L.调节溶液pH值为(7.1±0.05),常温避光振荡60min,制得光解液. 分别量取35mL各光解液进行光解实验,光解实验控制性条件与“1.2.4”中相同.
1.2.6 活性物种的鉴定 HA中光生×OH、1O2的测定采用电子顺磁共振波谱仪(EPR)进行,以DMPO和TEMP分别作为×OH和1O2的捕获剂.预先将DMPO、TEMP溶液(100mmol/L)分别与各HA溶液(50mg/L)按1:1体积比均匀混合,然后将各混合样分别转移至EPR毛细管内并用真空硅脂封闭底端,装入石英样品管置于EPR内,在紫外光辐照5min后测定DMPO和×OH的加合物(DMPO-OH)及TEMP和1O2的加合物(TEMP-1O)的EPR谱图.
EPR操作条件为:中心磁场3503G;扫场宽度100G;扫描时间57.02s;g因子2.0000;调制幅度为1G;扫描次数3;微波衰减9dB;微波功率25.18mW;微波频率9.83GHz;扫描点数1400;时间常数40.96ms.
1.3 数据处理
本文采用一级动力学模型处理实验数据,具体公式见式(1),并采用OriginPro 9.0软件拟合绘制图形,从而获得SDZ的光降解速率.于此同时,根据速率常数可由式(2)计算获得溶液中SDZ光解的半衰期1/2.
ln (C/0) = -·t (1)
1/2= ln2/(2)
式中:C为时刻光解液中测得的SDZ的浓度;0为光解开始时溶液中SDZ的浓度;为一级动力学反应速率常数;1/2为SDZ 光降解半衰期.
2 结果与讨论
2.1 HA的结构与元素分析
HA结构复杂,平均分子量为2000~5000,通常含有酚羟基、醇羟基、羟基醌、醌基、半醌基、甲氧基和羧基等多种官能团,以及少量的氨基酸、维生素、酶类和多种微量元素[26].目前,常采用Stevenson腐殖酸模型作为HA简化分子结构(图2)[27].
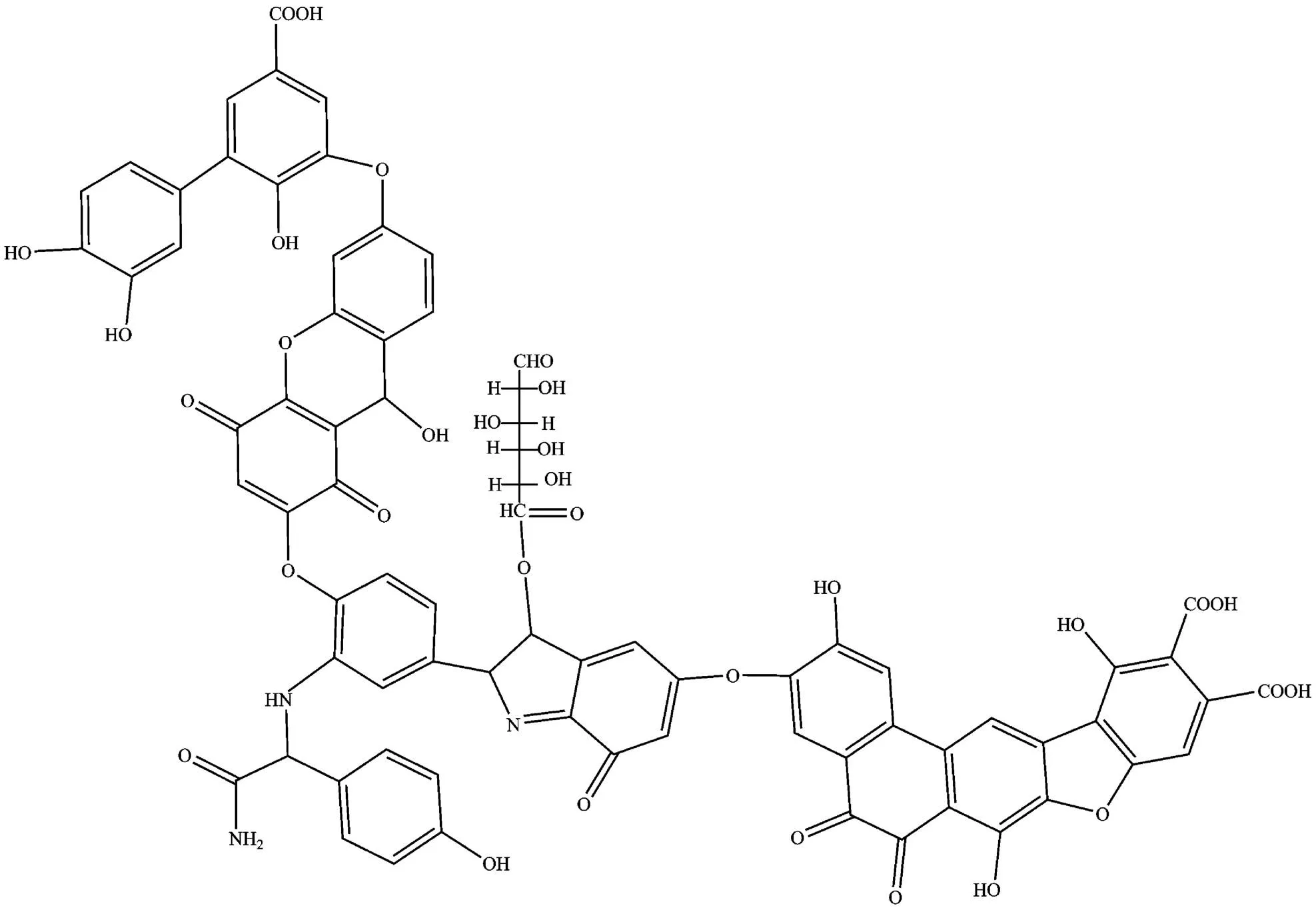
图2 Stevenson 腐殖酸模型
为了进一步了解不同源HA的结构差异,本文对HA的元素组成及原子占比进行分析,得出其化学构成及芳香化程度等基本信息(表1).结果显示,4种HA中C和O元素占主导地位,S含量普遍偏低.前期研究表明[16],C/H值与HA的缩合度呈正相关,O/C值与HA的氧化程度呈正相关,(N+O)/C值与HA的极性大小呈正相关.结合表1可知,4种HA缩合度大小为SPHA > NTHA > LYHA > SDHA,氧化程度大小为NTHA > SDHA > SPHA > LYHA,极性大小为NTHA > SDHA > SPHA > LYHA.其中,缩合度大小能够间接指示HA的芳香性及疏水性,而氧化程度则又与胡敏酸结构中碳水化合物及羧基(—COOH)等含氧官能团的数量相关.由此说明,SPHA具有最多的芳香结构及更高的疏水性,而LYHA具有最少的碳水化合物及含氧官能团.
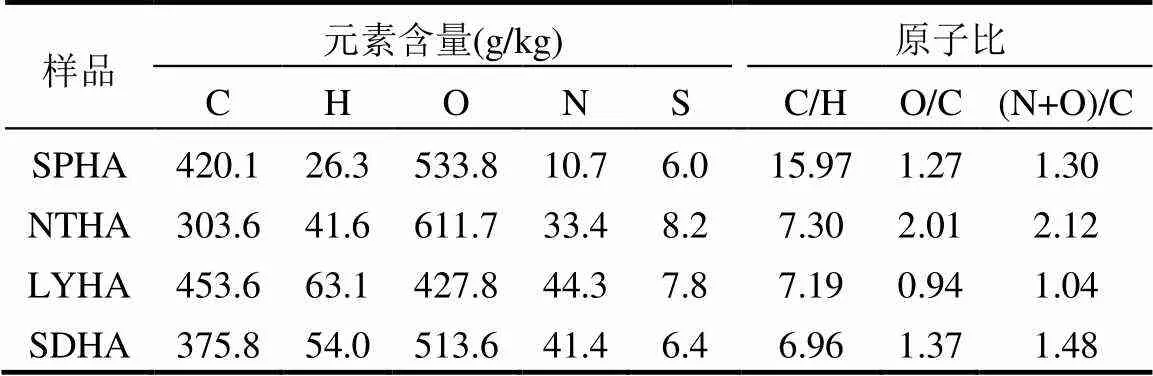
表1 不同来源HA的元素分析
2.2 黑暗对照实验
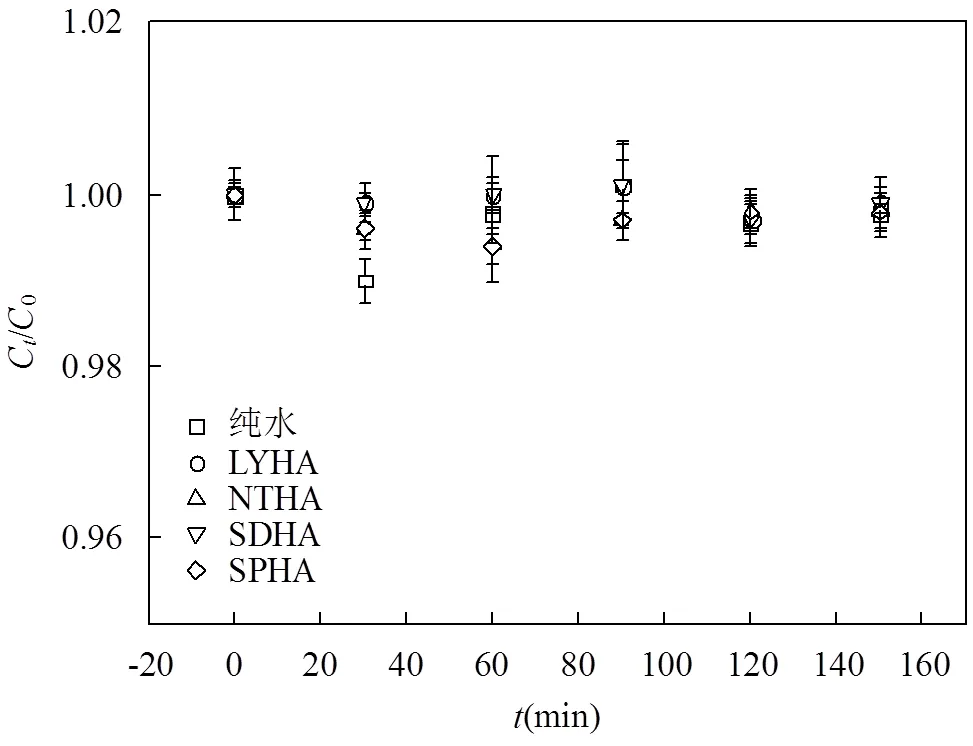
图3 黑暗对照实验中SDZ浓度随时间的变化
为了探究SDZ在黑暗环境下的稳定性,分别在纯水中和不同 HA共存时设置黑暗对照实验,结果如图3所示.在实验进行150min内SDZ溶液的浓度均变化很小,表现出良好的稳定性.说明SDZ在纯水和不同 HA共存时,均无明显的水解反应、吸附现象及微生物降解.因此,在紫外光照下SDZ浓度的变化主要是光化学反应造成.
2.3 HA对SDZ紫外光降解的影响
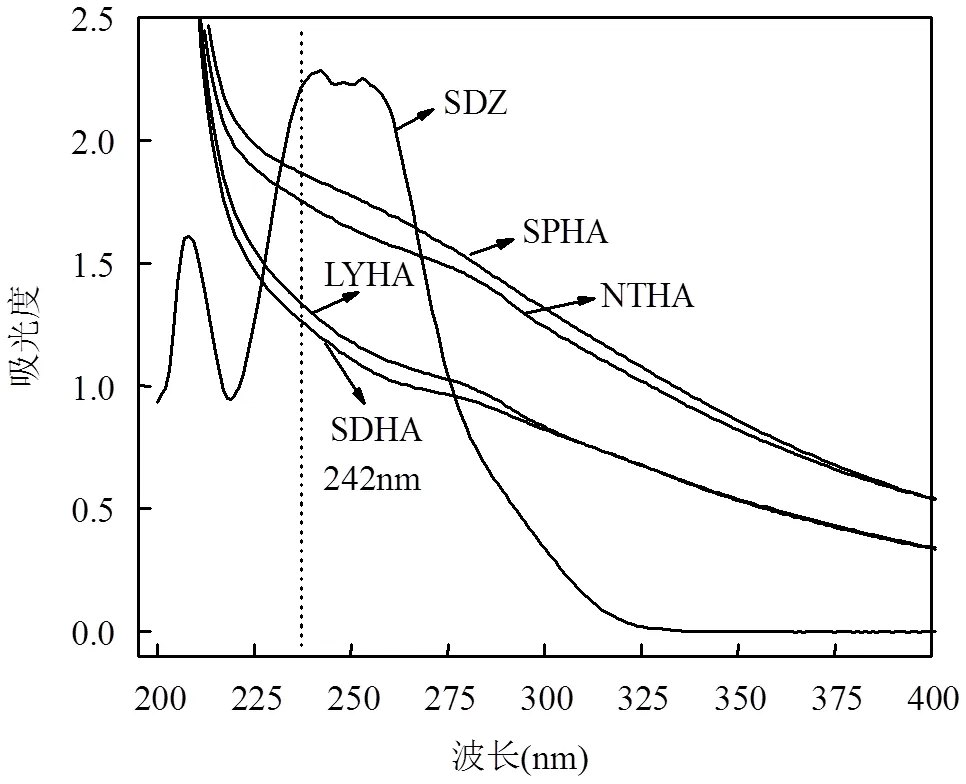
图4 不同来源HA和SDZ紫外-可见吸收光特性
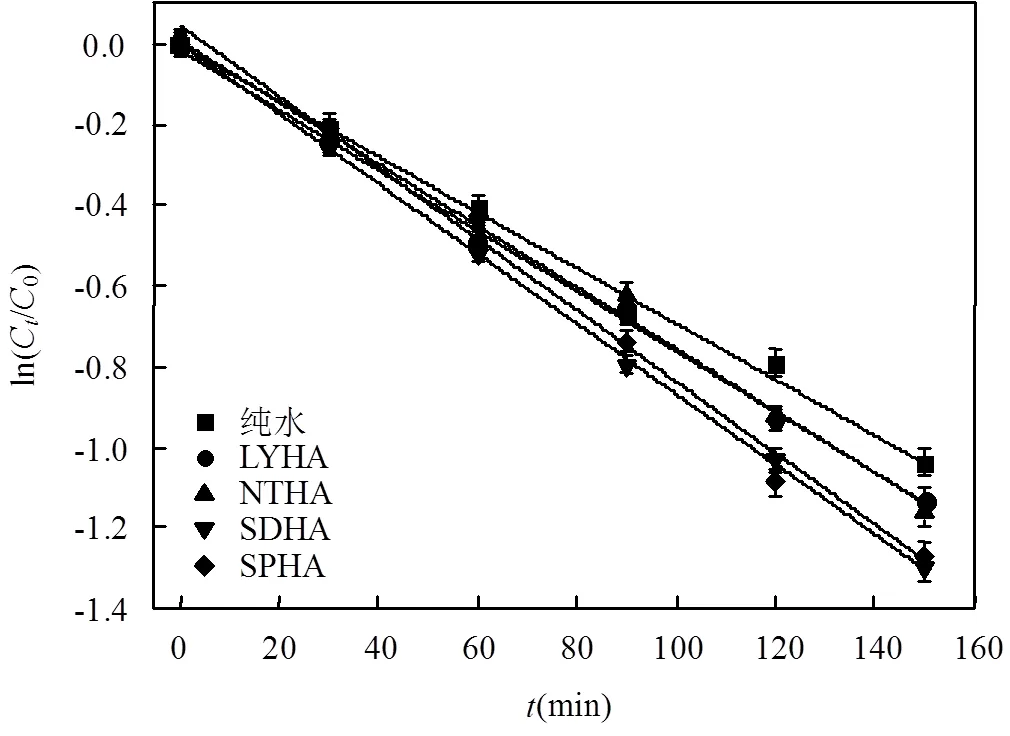
图5 不同来源HA对SDZ光降解的影响
在紫外光的照射下,SDZ和HA在200~400nm的紫外光区有较强吸收(图4),说明SDZ与4种HA在紫外光下均可发生了光降解.因此,有必要探讨不同HA对SDZ的光降解的影响.纯水中和不同 HA共存时,SDZ的光解均符合一级反应动力学,但在HA中SDZ光降解反应速率均比在纯水中高出很多(图5),表明在此条件下HA对SDZ的光降解有促进作用.与此同时,SDZ的光降解速率与HA的种类有关.由表2可以得出,SDZ在SPHA、SDHA、NTHA和LYHA共存时的表观速率常数分别0.0089, 0.0087, 0.0077, 0.0075min-1,半衰期分别为77.88, 79.67, 90.02, 92.42min.显然,当与SPHA共存时SDZ光降解最快.
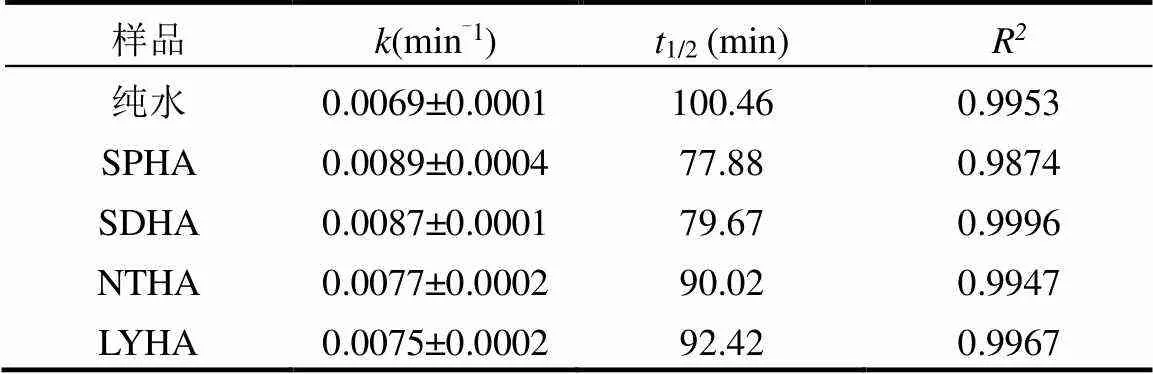
表2 SDZ-HA体系光降解动力学参数
在光照下HA中的含氧基团吸收光能产生×OH和1O2(活性氧物种),1O2和×OH具有较强的氧化性,能够与有机污染物发生反应从而加快自身的光降解[28].Batista等[29]研究发现,在254nm紫外光照射下,敏化光解对磺胺二甲嘧啶(SMZ)降解起到了重要的作用,且1O2和×OH能够促进SMZ光降解,使其C—S键和N—S键发生断裂而生成降解产物.结果表明,HA对SDZ的光降解有促进作用,其原因是HA受到紫外辐照后生成了1O2和×OH,加快了SDZ的降解速率,其降解产物和路径如图6所示[30].1O2对SDZ的光降解途径主要是氨基苯环的N位发生光氧化反应,生成硝基化合物(A).×OH对SDZ的光降解主要有两种途径:①在×OH作用下,S—N 键发生断裂,SDZ被一分为二,生成2-氨基嘧啶(B)和对氨基苯磺酸(C);②×OH进攻芳香环,在其苯环上的羟基化反应,生成羟基化产物(D)后还可进一步引发C−S键和N−S键断裂进而生成小分子量化合物,并最终生成CO2和H2O,彻底矿化母体化合物.研究发现[28,31], HA的腐殖化程度越大,其苯环结构上脂肪链降解成羧基、羰基等官能团的可能性越大.因此,在光照条件下HA产生1O2和×OH等活性氧物质能力越强,越有利于有机污染物的降解.从元素分析来看,不同来源的HA的结构组成不同,腐殖化程度必然不一样,造成其产生活性中间体的效率不同,从而使得SDZ光降解速率有所差异.
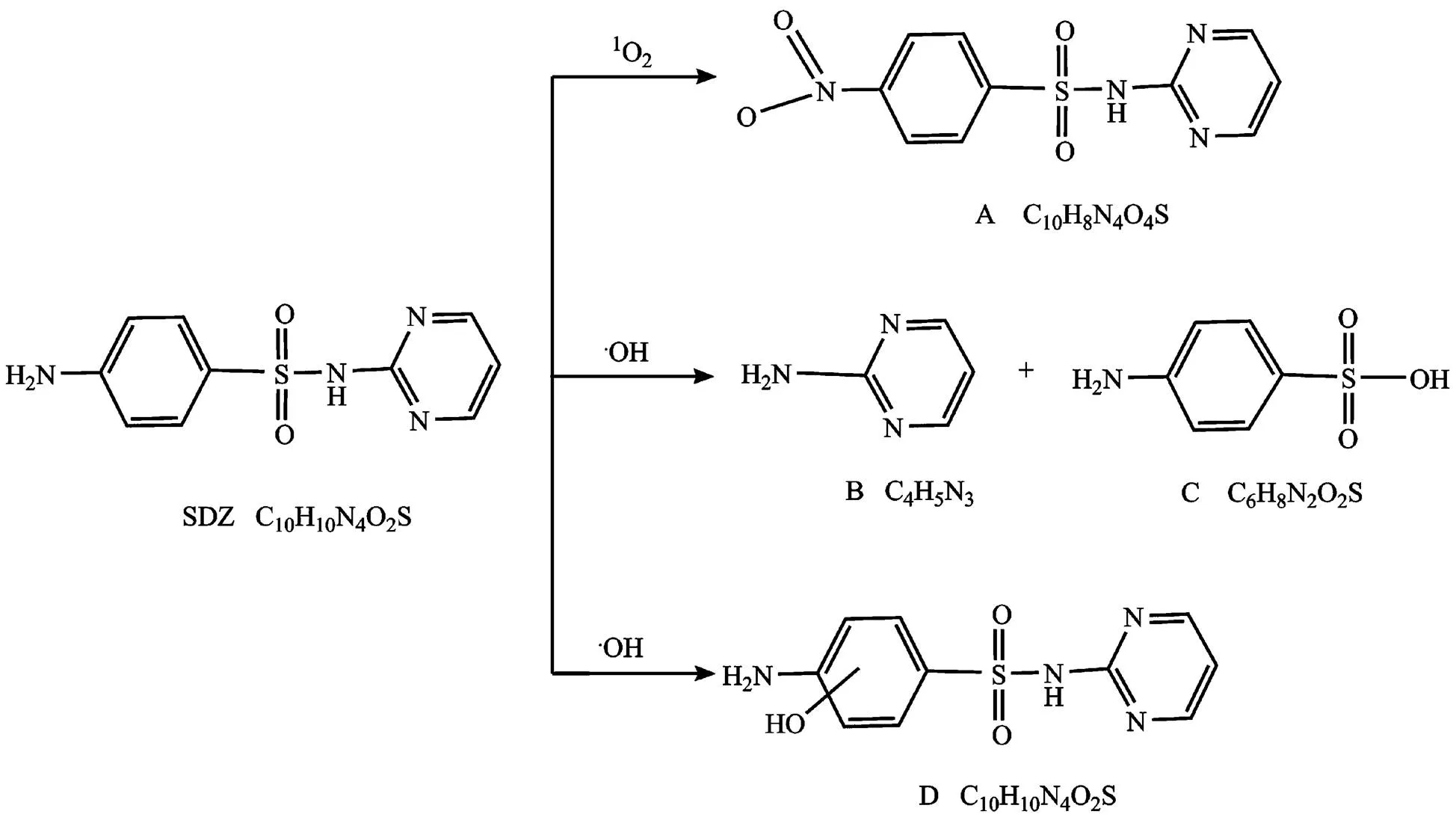
图6 磺胺嘧啶的间接光解路径
2.4 主要活性物种对SDZ紫外光降解的贡献
HA促进有机污染物的光降解的主要机理是其接受光后产生活性氧物种(ROS),间接引起有机污染物的降解[32].其生成自由基及其可能的途径如图7所示.一方面,HA在光照下,吸收一个光子生成单重激发态(1HA*),1HA*通过向外释放荧光的方式生成三重激发态(3HA*),促进有机污染物的降解;另一方面,1HA*可以释放一个电子捕获DO,进而生成超氧阴离子自由基(O2-×),然后转化生成氧化氢(H2O2). H2O2与过渡金属离子通过(类)Fenton反应生成羟基自由基(×OH).此外,3HA*通过能量转移产生单线态氧(1O2).×OH和1O2对有机污染物进行降解.因此,有必要探讨HA生产×OH和1O2对SDZ光解的贡献.根据公式(3) (4)计算×OH和1O2对SDZ光降解的贡献.
1=1/HA≈(HA-HA+IPA)/HA(3)
2=2/HA≈(HA-HA+NaN3)/HA(4)
式中:1和2为×OH与1O2对SDZ的光降解的贡献,HA为不同HA体系中,SDZ光降解的一级反应速率常数;HA+IPA为添加IPA后,不同HA体系中SDZ光降解的一级反应速率常数;HA+NaN3为添加NaN3后,不同HA体系中SDZ光降解的一级反应速率常数.1和2为×OH和1O2参与的自敏化光解速率常数.
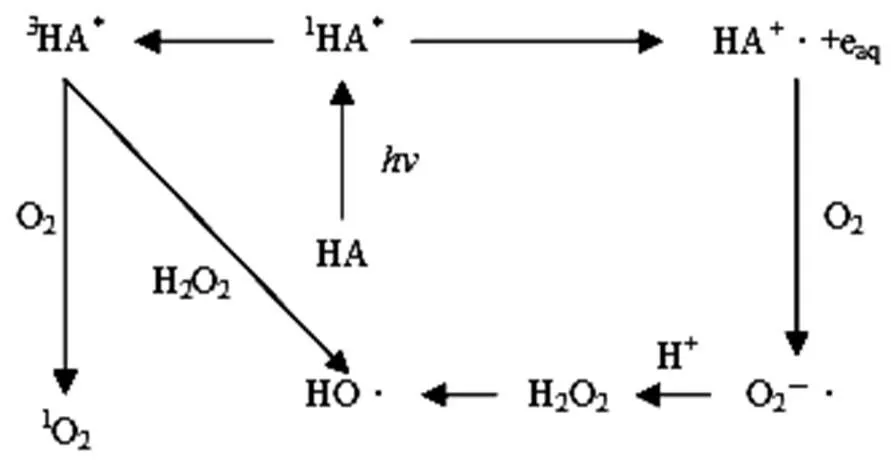
图7 HA的主要光化学过程
2.4.1×OH的贡献 有研究表明,异丙醇(IPA)对于×OH 的屏蔽率高达98.4%~99.6%[33].本文用IPA作为×OH的猝灭剂,考察×OH对SDZ的间接光降解影响.加入IPA后,SDZ的光降解符合一级反应动力学,光降解速率都明显减慢,且体系中HA不同光解情况也有所差异(图8).加入×OH的猝灭剂后,SDZ与SPHA共存时的光降解减慢的最为明显,其半衰期延长28.76min,同时在与NTHA、SDHA和LYHA共存时SDZ的半衰期分别延长13.43, 12.7, 9.51min.这说明不同的HA产生的×OH对SDZ光解的贡献率不一样.
在紫外光条件下,HA 产生×OH的的能力与其来源有关,SPHA产生的×OH对SDZ的光降解的贡献率(26.97%)最大;其次是SDHA (13.79%)和NTHA (12.99%)产生的×OH对SDZ光降解的贡献率;而LYHA产生的×OH对SDZ光降解的贡献(9.33%)最小(表3).原因可能是不同的HA产生的×OH产率和稳态浓度不同.有研究表明源溶解性有机质(DOM)的分子量大小也会影响×OH的量子产率,其产率随着DOM分子量的减小而增加[34].Lee等[35]研究发现污水来源DOM比商品化 DOM的×OH量子产率要高.因此,由元素分析可以得出,不同来源HA的分子量不同,其分子量的具体大小可能为LYHA > NTHA > SDHA > SPHA.综上所述×OH参与了SDZ的光转化过程,并且对SDZ的光转化有促进作用.此外,不同来源的HA产生×OH的能力有所差异.
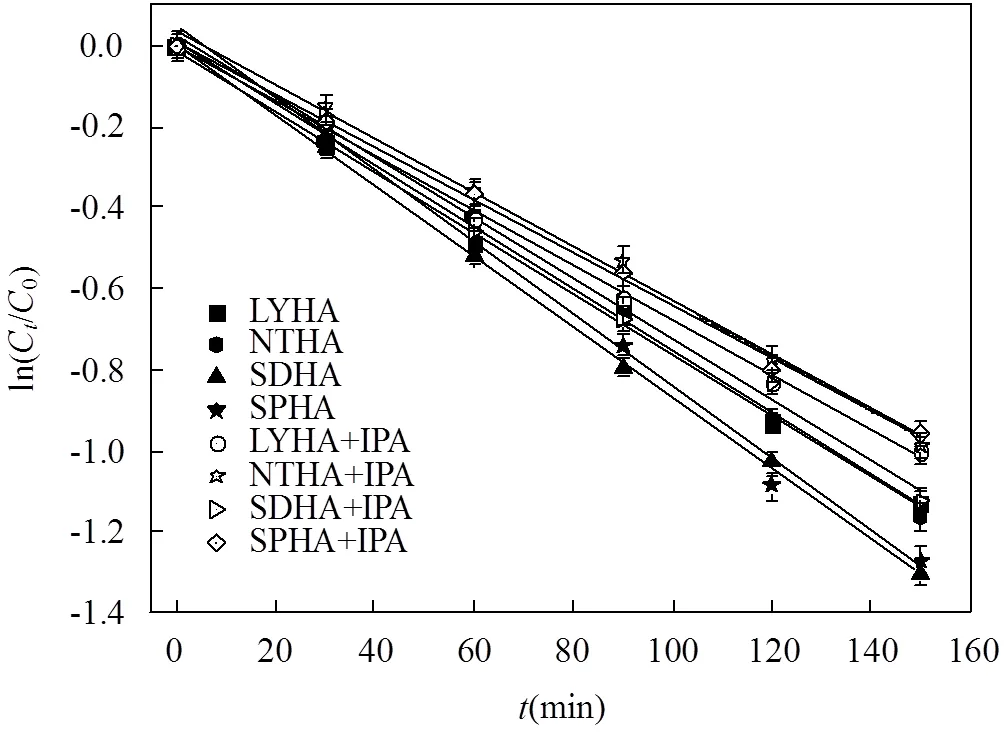
图8 异丙醇对SDZ光降解的影响
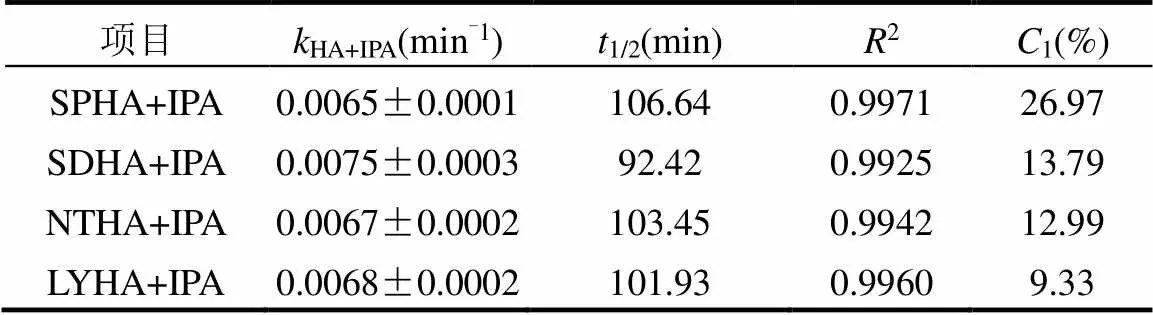
表3 SDZ的光降解动力学参数及×OH对SDZ的贡献
注:1为×OH对SDZ光降解的贡献.
2.4.21O2的贡献 加入1O2的捕获剂NaN3后,SDZ的光降解反应满足一级动力学(图9).加入NaN3后,不同来源的HA存在下SDZ光降解速率明显减慢,其减慢的速率都有所差异.这是由于HA的结构组成不一样,产生1O2的能力不同.
由表4可知,在紫外光照条件下,4种HA均产生了单线态氧,但产生1O2的能力不一样.SDZ分别与LYHA、SDHA、SPHA、NTHA共存时,1O2对SDZ光降解的贡献率分别为41.33%, 44.83%, 48.31%, 51.95%.其中在SPHA共存时,1O2对SDZ降解的贡献率最大,这主要是因为SPHA产生的1O2的稳态浓度最高.Xu 等[36]研究发现,DOM具有生成1O2的能力并可以促进SDZ的光解,其贡献率可达到 42%,这与本文的研究结果相符.Mostafa等[37]研究发现自然水体DOM的1O2量子产率(1.6%~2.1%)比污水源DOM (2.8%~4.7%)低.Zhang等[38]对污水源DOM中亲水性、疏水性和中性成分产生性氧物种(ROS)的情况进行了研究,发现亲水性成分(如多肽类和蛋白质等)可以产生更多的1O2.因此,推测不同来源HA亲水性成分的含量不一样,其含量大小为NTHA> SPHA> SDHA>LYHA.

图9 NaN3对SDZ光降解的影响
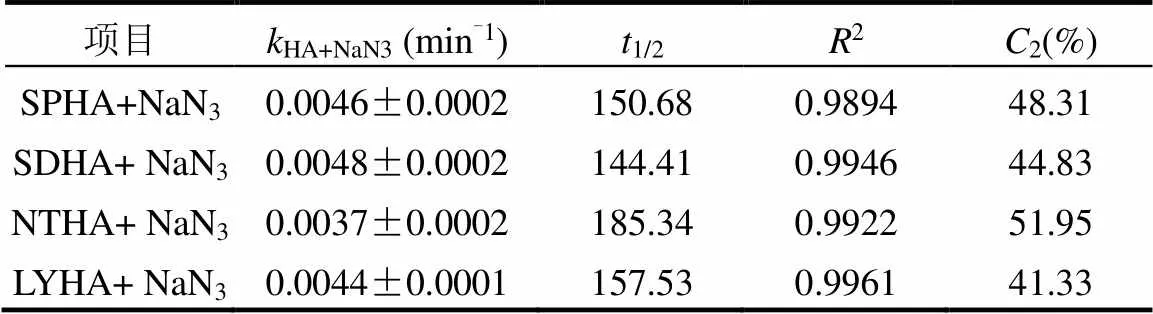
表4 SDZ的光降解动力学参数及1O2对SDZ的贡献
注:2为1O2对SDZ光降解的贡献.
综上所述,HA产生的×OH和1O2对SDZ的光降解都具有一定的促进作用,且1O2的促进作用大于×OH.来源不同HA具有的分子量、亲疏水性等不同,产生×OH和1O2的能力也有所差异.
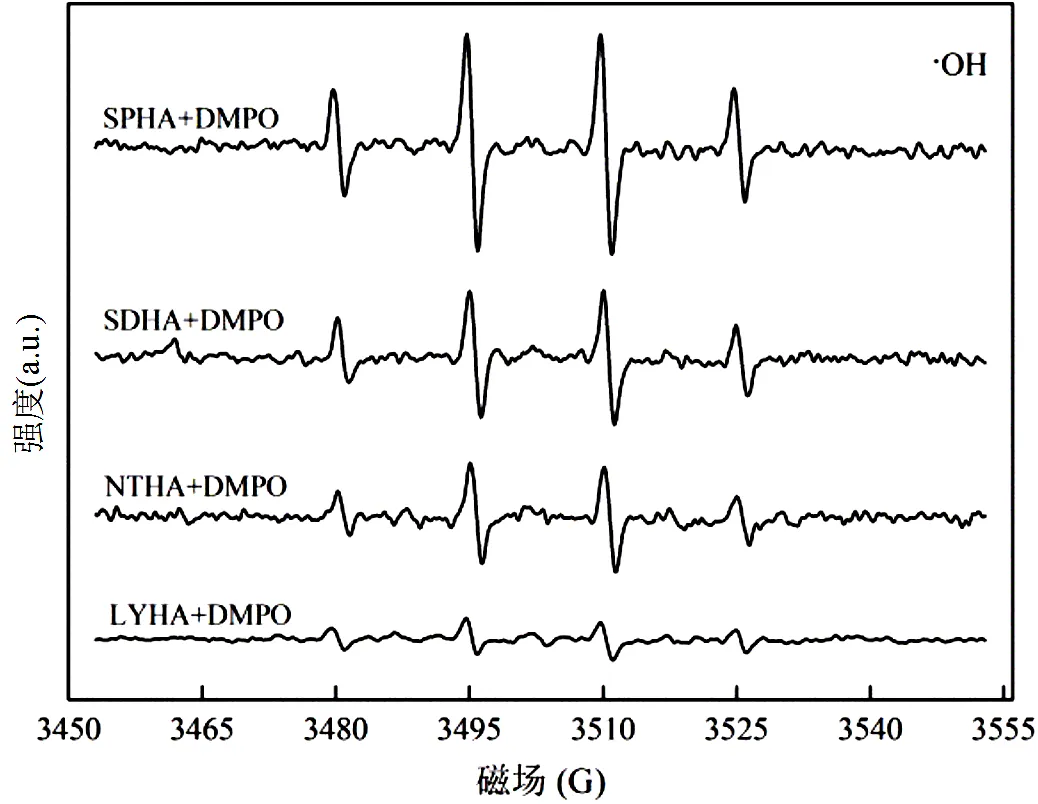
2.4.3 活性物种的鉴定 为了验证HA光解过程中确实产生了活性物种,分别以DMPO和TEMP作为×OH和1O2的捕获剂,在紫外光照下,测定不同HA反应体系的电子自旋共振波谱,如图10所示.在不同HA溶液中,检测出了属于DMPO-OH加合物的1: 2: 2: 1四重峰和属于TEMP-1O2的1: 1: 1三重峰,证实了光照射下HA溶液中产生了×OH和1O2,且各HA溶液产生×OH和1O2的能力存在差异.一方面,HA存在条件下TEMP-1O2的特征峰高比例明显高于DMPO-OH的特征峰,说明各HA溶液中产生的1O2的能力均强于×OH.另一方面,SPHA的DMPO-OH加合物信号峰明显最强,而NTHA的TEMP-1O2加合物信号峰又明显强于其他HA,分析得出不同HA溶液产生×OH的能力为SPHA > SDHA > NTHA > LYHA,产生1O2的能力为NTHA > SPHA > SDHA > LYHA.不难发现,EPR实验反映出的各HA产生×OH及1O2的能力差异,与SDZ光解实验中各HA中×OH及1O2的贡献大小情况相吻合,再次证明了HA对SDZ光解反应具有介导作用,且作用大小与其光生×OH及1O2的能力大小相关.
3 结论
3.1 不同来源的4种HA的结构不同,缩合度大小为SPHA > NTHA > LYHA > SDHA,氧化程度大小为NTHA > SDHA > SPHA > LYHA,极性大小为NTHA > SDHA > SPHA > LYHA. SPHA具有最多的芳香结构及更高的疏水性,LYHA具有最少的碳水化合物及含氧官能团且极性最小.
3.2 不同来源HA能够对SDZ的光降解产生一定干扰或者光屏蔽作用(200~400nm).在HA共存时, SDZ的光降解符合一级动力学模型,且HA对SDZ的降解具有促进作用,其促进效果从大到小为SPHA>SDHA>NTHA>LYHA.
3.1 HA具有产生×OH和1O2的能力,且×OH和1O2对SDZ光降解具有重要贡献.不同HA生产×OH对SDZ的贡献大小为SPHA > SDHA > NTHA > LYHA,产生1O2的对SDZ的贡献大小为NTHA > SPHA > SDHA > LYHA.此外,1O2对SDZ光降解的贡献大于×OH.
[1] 刘相良,张彪军,房 岐,等.海水溶解组分复合作用对磺胺吡啶光解的影响[J]. 中国环境科学, 2018,38(8):3029-3034. Liu X L, Zhang B J, Fang Q, et al. Multivariate effects of dissolved seawater components on photodegradation of sulfapyridine [J]. China Environmental Science, 2018,38(8):3029-3034.
[2] 张 迪,吴 敏,李 浩,等.土壤有机碳对磺胺甲噁唑吸附的影响[J]. 环境化学, 2012,31(8):1238-1243. Zhang D, Wu M, Li H, et al. Effect of organic carban on sulfamethoxazole sorption on soil [J]. Environmental Chemistry, 2012, 31(8):1238-1243.
[3] 金彩霞,高若松,吴春艳.磺胺类药物在环境中的生态行为研究综述[J]. 浙江农业科学, 2011,1(1):127-131. Jin C X, Gao R S, Wu C Y. Study on the ecological behavior of sulfonamides in the environment: a review [J]. Zhejiang Agricultural Science, 2011,1(1):127-131.
[4] Sun J C, Wang Q Y, Zhang J, et al. Degradation of sulfadiazine in drinking water by a cathodic electrochemical membrane filtration process [J]. Electrochimica Acta, 2018,277:77-87.
[5] Tan C Q, Lu X, Cui X X, et al. Novel activation of peroxymonosulfate by an easily recyclable VC@Fe3O4nanoparticles for enhanced degradation of sulfadiazine [J]. Chemical Engineering Journal, 2019, 363:318-328.
[6] Jechalke S, Heuer H, Siemens J, et al. Fate and effects of veterinary antibiotics in soil [J]. Trends in Microbiology, 2014,22(9):536-545.
[7] Silva V, Mol H G J, Zomer P, et al. Pesticide residues in European agricultural soils-A hidden reality unfolded [J]. Science of the Total Environment, 2019,653:1532-1545.
[8] Hu S Q, Zhang Y, Shen G X, et al. Adsorption/desorption behavior and mechanisms of sulfadiazine and sulfamethoxazole in agricultural soil systems [J]. Soil & Tillage Research, 2019,186:233-241.
[9] Challis J K, Carlson J C, Friesen K J, et al. Aquatic photochemistry of the sulfonamide antibiotic sulfapyridine [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2013,262:14-21.
[10] Remucal C K. The role of indirect photochemical degradation in the environmental fate of pesticides: A review [J]. Environmental Science-Processes and Impacts, 2014,16(4):618-653.
[11] Boreen A L, Arnold W A, Mcneill K. Triplet-sensitized photodegradation of sulfa drugs containing six-membered heterocyclic groups: identification of an SO2extrusion photoproduct [J]. Environmental Science & Technology, 2005,39(10):3630-3638.
[12] Gligorovski S, Strekowski R, Barbati S, et al. Environmental Implications of Hydroxyl Radicals (×OH) [J]. Chemical Reviews, 2015, 115(24):13051-13092.
[13] Oliveira C, Lima D L D, Silva C P, et al. Photodegradation behaviour of estriol: An insight on natural aquatic organic matter influence [J]. Chemophere, 2016,159:545-551.
[14] 李聪鹤,车潇炜,白 莹,等.水体中磺胺甲噁唑间接光降解作用[J]. 环境科学, 2019,40(1):273-280. Li C H, Che X W, Bai Y, et al. Indirect Photodegradation of sulfamethoxazole in Water [J]. Enviromental Science, 2019,40(1): 273-280.
[15] Caupos E, Mazeller P, Croue J P. Photodegradation of estrone enhanced by dissolved organic matter under simulated sunlight [J]. Water Research, 2011,45(11):3341-3350.
[16] 任 东,杨晓霞,马晓东,等. DOM结构特征及其对17β-雌二醇光降解的影响[J]. 中国环境科学, 2015,35(5):1375-1383. Ren D, Yang X X, Ma X D, et al. Structural characteristics of DOM and its effects on thephotodegradationof 17 β-estradiol [J]. China Environmental Science, 2015,35(5):1375-1383.
[17] Zhan M J, Yang X, Xian Q M, et al. Photosensitized degradation of bisphenol A involving reactive oxygen species in the presence of humic substances [J]. Chemosphere, 2005,63(3):378-386.
[18] Zhou L, Ji Y F, Zeng C, et al. Aquatic photodegradation of sunscreen agent p-aminobenzoic acid in the presence of dissolved organic matter [J]. Water Research, 2013,47(1):153-162.
[19] Wenk J, Von Gunten U, Canonica S. Effect of dissolved organic matter on the transformation of contaminants induced by excited triplet states and the hydroxyl radical [J]. Environmental Science & Technology, 2011,45(4):1334-1340.
[20] Zeng C, Ji Y, Zhou L, et al. The role of dissolved organic matters in the aquatic photodegradation of atenolol [J]. Journal of Hazardous Materials, 2012,239-240:340-347.
[21] Zhang Y, Zhou J L, Ning B. Photodegradation of estrone and 17β-estradiol in water [J]. Water Research, 2007,41(1):19-26.
[22] Jacobs L E, Fimmen R L, Chin Y P, et al. Fulvic acid mediated photolysis of ibuprofen in water [J]. Water Research, 2011,45(15): 4449-4458.
[23] Avisar D, Horovitz I, Lozzi L, et al. Impact of water quality on removal of carbamazepine in natural waters by N-doped TiO2photo-catalytic thin film surfaces [J]. Journal of Hazardous Materials, 2013,244-245:463-471.
[24] Babic S, Perisa M, Skoric I. Photolytic degradation of norfloxacin, enrofloxacin and ciprofloxacin in various aqueous media [J]. Chemosphere, 2013,91(11):1635-1642.
[25] 李会杰.腐殖酸和富里酸的提取与表征研究[D]. 湖北:华中科技大学, 2012. Li H J. Study on Extraction and Characterization of HA and FA [D]. Hubei: Huazhong University of Science and Technology, 2012.
[26] 陈梦妍,朱 亮,张 静.腐殖酸对高锰酸钾氧化苯酚的影响及其作用机制[J]. 中国环境科学, 2015,35(10):3041-3045. Chen M Y, Zhang L, Zhang J. Influence and mechanism of humic acids on the oxidation of phenol by permanganate [J]. China Environmental Science, 2015,35(10):3041-3045.
[27] Stevenson F J. Humus chemistry [M]. New York: John Wiley Interseience, 1982.
[28] Maddigapu P R, Minella M, Vione D, et al. Modeling Phototrans formation Reactions in Surface Water Bodies: 2,4-Dichloro-6- Nitrophenol As a Case Study [J]. Environmental Science Technology, 2011,45(1):209-214.
[29] Batista A P S, Pires F C C, Teixeira A C S C. The role of reactive oxygen species in sulfamethazine degradation using UV-based technologies and products identification [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2014,290:77-85.
[30] Song Y L, Tian J Y, Gao S S, et al. Photodegradation of sulfonamides by g-C3N4under visible light irradiation: Effectiveness, mechanism and pathways [J]. Applied Catalysis B: Environmental, 2017,210:88- 96.
[31] 王 朋,吴 敏,李 浩,等.环境持久性自由基对有机污染物环境行为的影响研究进展[J]. 化工进展, 2017,36(11):4243-4249. Wang P, Wu M, Li H. Formation of environmental persistent free radicals and its influence on organic pollutant behavior: a review [J]. Chemical Industry Engineering Progess, 2017,36(11):4243-4249.
[32] 孙昊婉,张立秋,封 莉.光诱导腐殖酸产生自由基对天然水中雌二醇光降解效能的影响[J]. 环境工程学报, 2017,11(11):5794-5798. Sun H W, Zhang L Q, Feng L. Influence of free radicals produced by photo-induced humic acid on photodeg-radation of 17β-estradiol in natural water [J]. Chinese Journal of Environmental Engineering, 2017,11(11):5794-5798.
[33] Bahnmuller S, Gunten U V, Canonica S. Sunlight-induced transformation of sulfadiazine and sulfamethoxazole in surface waters and wastewater effluents [J]. Water Research, 2014,57:183-192.
[34] Dong M M, Rosario-Ortiz F L. Photochemical formation of hydroxyl radical from effluent organic matter [J]. Environmental Science Technology, 2012,46(7):3788-3794.
[35] Lee E, Glover C M, Rosario-Ortiz F L. Photochemical formation of hydroxyl radical from effluent organic matter: Role of Composition [J]. Environmental Science and Technology, 2013,47(21):12073-12080.
[36] Xu J, Hao Z N, Guo C S, et al. Photodegradation of sulfapyridine under simulated sunlight irradiation: Kinetics, mechanism and toxicity evolvement [J]. Chemosphere, 2014,99:186-191.
[37] Mostafa S, Rosario-Ortiz F L. Singlet oxygen formation from wastewater organic matter [J]. Environmental Science and Technology, 2013,47(15):8179-8186.
[38] Zhang D N, Yan S W, Song W H. Photochemically induced formation of reactive oxygen species (ROS) from effluent organic matter [J]. Environmental Science and Technology, 2014,48(21):12645-12653.
Influence and mechanism of humic acid from different sources on ultraviolet photodegradation of sulfadiazine.
SHEN Xia1,2, WANG Bin1,2*, ZHU Jing-ping1, ZENG Dan1,2, CHEN Shu1,2, REN Dong3, HUANG Sha1,2
(1.School of Environment and Resource, Southwest University of Science and Technology, Mianyang 621010, China;2.Key Laboratory of Solid Waste Treatment and Resource Recycle, Ministry of Education, Southwest University of Science and Technology, Mianyang 621010, China;3.College of Environmental Science and Engineering, China West Normal University, Nanchong 637009, China)., 2019,39(12):5210~5218
The effects of different humic acids (HA), including standard humic acid (SPHA), Paddy soil humic acid (SDHA), Peat soil humic acid (NTHA) and Deciduous soil humic acid (LYHA), on the photodegradation of sulfadiazine (SDZ), and corresponding contribution of primary reactive species was investigated. The results indicated that the photodegradation process of SDZ in pure water and HA solution was consistent with the first-order photodegradation kinetic model. The photodegradation of SDZ was promoted by HA, in order of promoting effects: SPHA > SDHA > NTHA > LYHA. Based on the quenching experiment of hydroxyl radical (×OH) and singlet oxygen (1O2), the capacity to produce×OH and1O2of HA was been influenced by its own source. Under the same conditions, the amount of×OH produced by SPHA was relatively higher, and its contribution rate to SDZ photodegradation was the largest (26.97%), while LYHA contribution was relatively smaller at 9.33%. Meanwhile,1O2was found to play the most important role in the photodegradation of SDZ, with the contribution rate ranging from 41.33% to51.95%.
humic acid;sulfadiazine;photodegradation kinetics;hydroxyl radical;singlet oxygen
X142
A
1000-6923(2019)12-5210-09
申 霞(1993-),女,四川蓬溪人,西南科技大学硕士研究生,主要从事土壤有机污染物光降解研究.
2019-05-24
四川省国际科技创新合作项目(2019YFH0175);国家自然科学基金资助项目(41403081);四川省环境治理与生态保护重大科技专项(2018SZDZX0020);四川省重点研发项目(2017SZ0178)
* 责任作者, 副教授, greenworldwb@swust.edu.cn
