泰山紫草不同提取部位抗氧化性研究*
2019-12-25侯廷花代莉莉赵浩男曲晓兰
侯廷花 代莉莉 赵浩男 曲晓兰
药学院,山东第一医科大学(山东省医科院),山东 泰安 271016
紫草(Lithhospermum erythrorhizon Sieb.et.Zucc)为多年生的草本植物,根入药,具有清热解毒、活血凉血,利尿、解毒透疹等功能[1],主治疹出不畅、血热毒盛,丹毒、黄疸、大便温闭等症。紫草的药理作用十分广泛,具有抗菌、抗炎、抗病毒、抗肿瘤、疏肝保胆等作用[2-3],其中抗肿瘤作用尤为显著[4]。紫草中总萘醌类化合物,易溶于石油醚、氯仿,可溶于乙醇、植物油,微溶于水[5]。紫草根中的紫草素及衍生物具有显著的抗菌、抗病毒、抗炎、抗肿瘤、保肝降酶和抗生育作用[6],还可作为天然色素,应用于食品饮料、化妆品、纺织等行业[7]本研究采用DPPH·法测定泰山紫草不同活性部位的抗氧化性,采用统计分析总黄酮含量与抗氧化性之间的相关性,希望能够为泰山紫草开发利用和质量的评价提供实验依据。
1 仪器与试剂
1.1 仪器
S-54型紫外分光光度计(上海棱光技术有限公司);RE-52A 型 旋转蒸发仪(上海亚荣生化仪器厂) ;KQ-5200DE 型超声波清洗器(昆山市超声仪器有限公司);电热恒温干燥箱;电子分析天平(上海恒平科技有限公司);SHB-III循环水式多用真空泵;FW-135 粉碎机。
1.2 材料和试剂
泰山紫草购自泰山四大名药开发有限公司,经山东第一医科大学(山东省医科院)药学院苏延友教授鉴定为紫草科植物紫草 Lithospermum erythrorhizon Sieb.et Zucc.的干燥根。实验其他所用的试剂均为分析纯。
2 方法与结果
2.1 溶液的配制
2.1.1紫草乙醇的提取物制备 取约5.0 g泰山紫草的干燥粉末置于500 ml圆底烧瓶中,溶于50ml 95%乙醇中,25 ℃超声提取20 min,减压抽滤,滤渣再用50ml 95%乙醇,25 ℃超声提取20 min,再次减压抽滤,合并两次滤液。将滤液旋转蒸发浓缩至约50 ml,将浓缩滤液转移至50 ml容量瓶,用95%乙醇定容至刻度,摇匀,即得供试品溶液。
2.1.2紫草丙酮提取物制备 取约5.0 g泰山紫草根的干燥粉末置于500 ml圆底烧瓶中,溶于50ml丙酮中,25 ℃超声提取20 min,减压抽滤,滤渣再用50 ml丙酮,25 ℃超声提取20 min,再次减压抽滤,合并两次滤液。将滤液旋转蒸发浓缩至约50 ml,将浓缩滤液转移至50 ml容量瓶,用丙酮定容至刻度,摇匀,即得供试品溶液。
2.1.3紫草乙酸乙酯的提取物制备 取约5.0 g泰山紫草干燥粉末置于500 ml圆底烧瓶中,溶于50ml乙酸乙酯中,25 ℃超声提取20 min,减压抽滤,滤渣再用50 ml乙酸乙酯,25 ℃超声提取20 min,再次减压抽滤,合并两次滤液。将滤液旋转蒸发浓缩至约50 ml,将浓缩滤液转移至50 ml容量瓶,用乙酸乙酯定容至刻度,摇匀,即得供试品溶液。
2.1.4紫草水提取物制备 取约5.0 g泰山紫草的干燥粉末置于500 ml圆底烧瓶中,溶于50 ml蒸馏水中,25 ℃超声提取20 min,减压抽滤,滤渣再用50 ml蒸馏水 ,25 ℃超声提取20 min,再次减压抽滤,合并两次滤液。将滤液旋转蒸发浓缩至约50ml,将浓缩滤液转移至50 ml容量瓶,用蒸馏水定容至刻度,摇匀,即得供试品溶液。
2.1.5DPPH·溶液的配置 用分析天平准确称取4.0 mgDPPH·置于100 ml的容量瓶中,加入无水乙醇溶解,定容,避光保存。
2.2 DPPH·自由基清除率的测定
2.2.1测定条件 依据紫外-可见分光光度法[9]含量测定的条件,以无水乙醇作为空白对照,于400~800 nm波长扫描,在516 nm处测定吸光度。
2.2.2紫草乙醇提取物清除DPPH·活性能力的测定 参考林恋竹[10]等的方法,量取紫草不同体积的乙醇提取物,定容至25 ml容量瓶,配置一定浓度的溶液。吸取样品待测液2.0 ml加入0.01 mmolDPPH·,摇匀,放置30 min,用乙醇调零,在516 nm波长处测定吸光度(A样品),测定样品待测液2.0ml与乙醇溶液2.0 ml混合液在516 nm处的吸光率(A对照),在测定2.0 mlDPPH·溶液与2.0 ml乙醇溶液在516 nm波长处的吸光度(A空白)。
DPPH·清除率(%)=[1-(A样品-A对照)/A空白]×100%
2.2.3紫草丙酮提取物清除DPPH·活性能力的测定 量取紫草不同体积的丙酮提取物,定容至25ml容量瓶,配置一定浓度的溶液。吸取样品待测液2.0 ml加入0.01 mmol DPPH·,摇匀,放置30 min,用丙酮调零,在516 nm波长处测定吸光度(A样品),测定样品待测液2.0 ml与丙酮溶液2.0 ml混合液在516 nm处的吸光率(A对照),在测定2.0ml DPPH·溶液与2.0 ml丙酮溶液在516 nm波长处的吸光度(A空白)。
2.2.4紫草乙酸乙酯提取物清除DPPH·活性能力的测定 量取紫草不同体积的乙酸乙酯提取物,定容至25 ml容量瓶,配置一定浓度的溶液。吸取样品待测液2.0 ml加入0.01 mmolDPPH·,摇匀,放置30 min,用乙酸乙酯调零,在516nm波长处测定吸光度(A样品),测定样品待测液2.0 ml与乙酸乙酯溶液2.0ml混合液在516nm处的吸光率(A对照),在测定2.0ml DPPH·溶液与2.0 ml乙酸乙酯溶液在516 nm波长处的吸光度(A空白)。
2.2.5紫草水提取物清除DPPH·活性能力的测定 量取紫草不同体积的蒸馏水提取物,定容至25 ml容量瓶,配置一定浓度的溶液。吸取样品待测液2.0 ml加入0.01mmol DPPH·,摇匀,放置30 min,用蒸馏水调零,测定516nm波长处的吸光度(A样品),测定样品待测液2.0 ml与蒸馏水溶液2.0 ml混合液在516 nm处的吸光率(A对照),在测定2.0ml DPPH·溶液与2.0 ml蒸馏水溶液在516 nm波长处的吸光度(A空白)。
2.2.6线性关系考察 采用统计法对紫草不同萃取部位抗氧化性和总黄酮含量作相关性分析,分析两者之间的关系。
2.3 紫草中DPPH·清除率的测定结果
由表1、2、3可知,乙醇相提取物中含有较丰富的黄酮类化合物,而水相提取物中黄酮类化合物含量较少。比较不同部位DPPH·清除率可得不同部位提取物对DPPH·均有一定程度的清除作用,但其清除能力不同,乙醇相清除率最高,水相清除率最低。
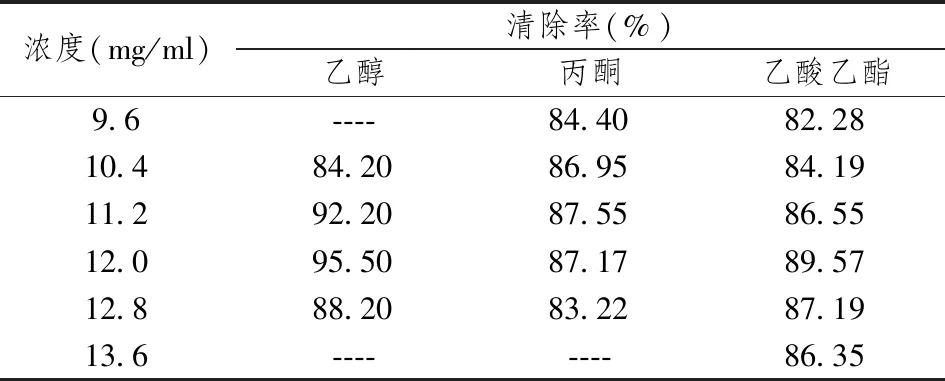
表1 泰山紫草不同部位抗氧化性

表2 泰山紫草水提取液抗氧化性
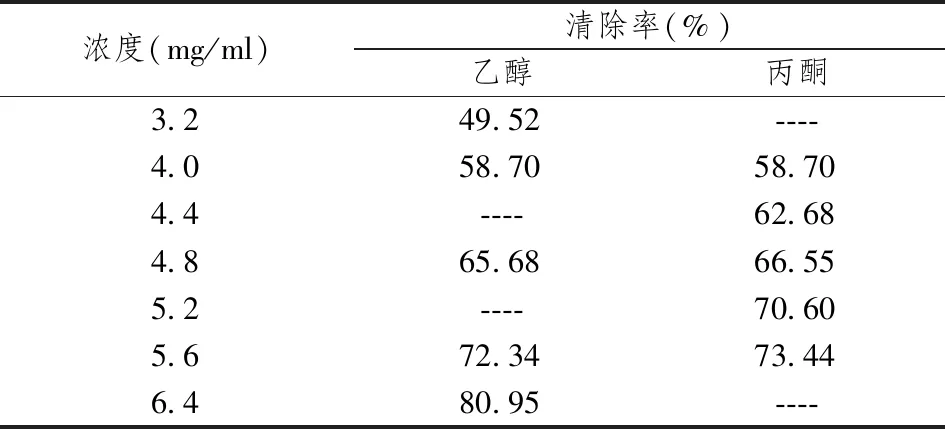
表3 泰山紫草不同部位总黄酮线性关系
比较紫草乙醇提取物抗氧化性,当浓度为12.0 mg/ml时,清除率最高为95.50%,见图1。
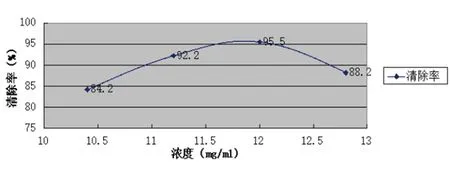
图1 泰山紫草乙醇提取液黄酮含量测定
比较紫草丙酮提取物抗氧化性,当浓度为11.2 mg/ml时,其清除率最高为87.55%,见图2。
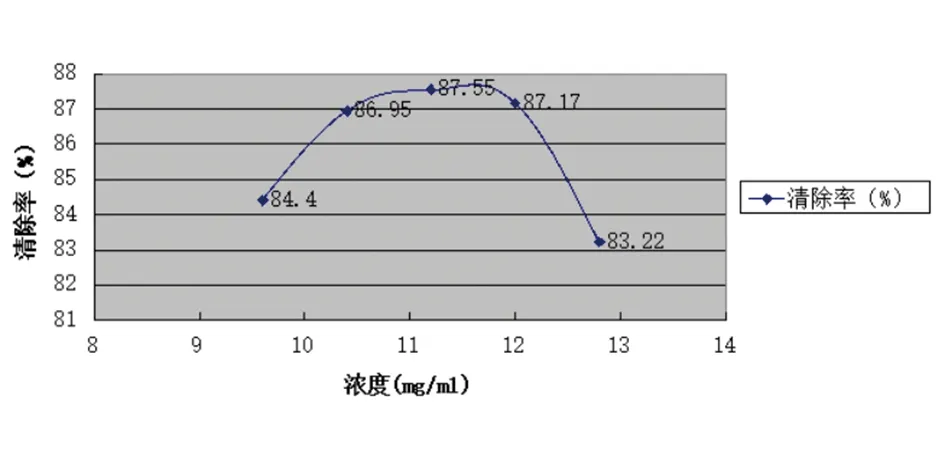
图2 泰山紫草丙酮提取液黄酮含量测定
比较紫草乙酸乙酯提取物抗氧化性,当浓度为12.0 mg/ml时,清除率最高为80.57%,见图3。
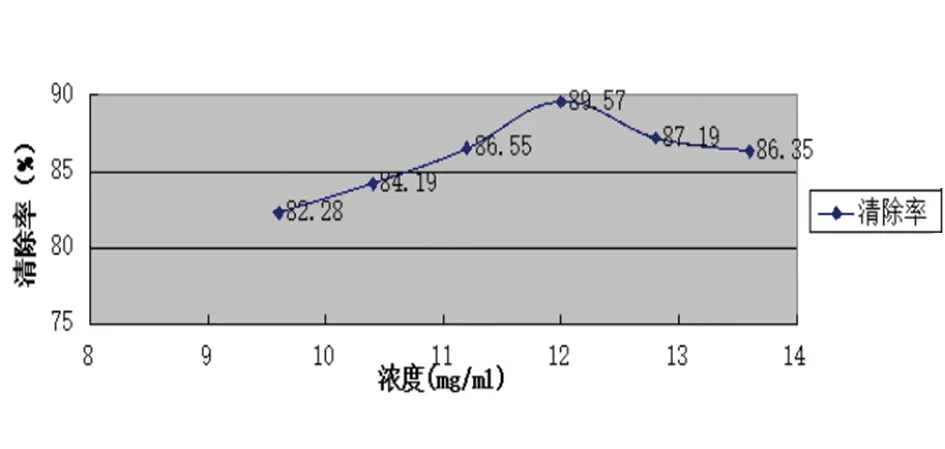
图3 泰山紫草乙酸乙酯提取液总黄酮含量测定
比较紫草水提取物抗氧化性,当浓度为18mg/ml时,清除率最高为53.86%,见图4。
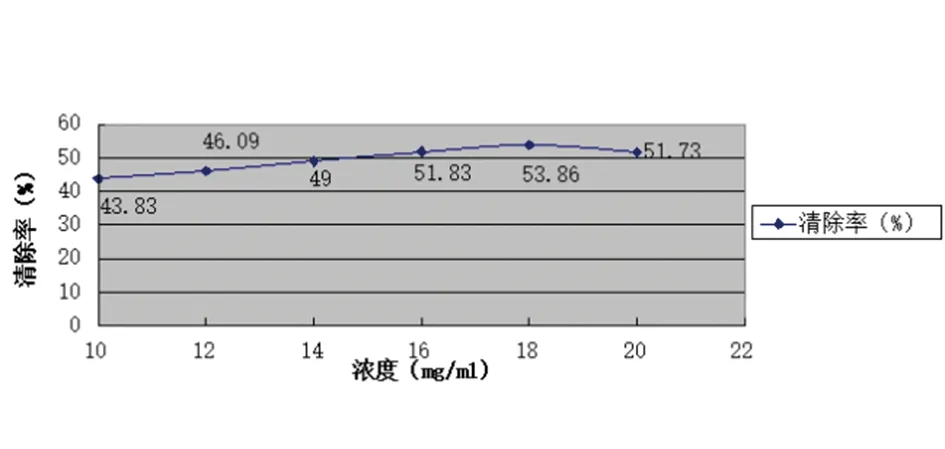
图4 泰山紫草水提取液黄酮含量测定
2.4 总黄酮含量与DPPH·清除率的相关性分析
由图5、6可以看出,总黄酮含量同DPPH·清除率呈正相关性关系,泰山紫草乙醇提取液黄酮含量回归方程A=95.625C+0.1954,r=0.9968,线性关系良好。丙酮提取液黄酮含量的回归方程A=98.741C+0.1926,r=1.0000,线性关系较好。
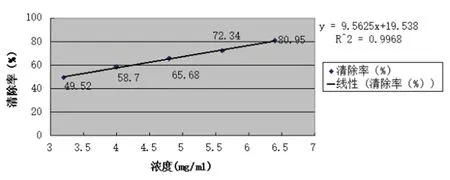
图5 泰山紫草乙醇提取液总黄酮线性关系
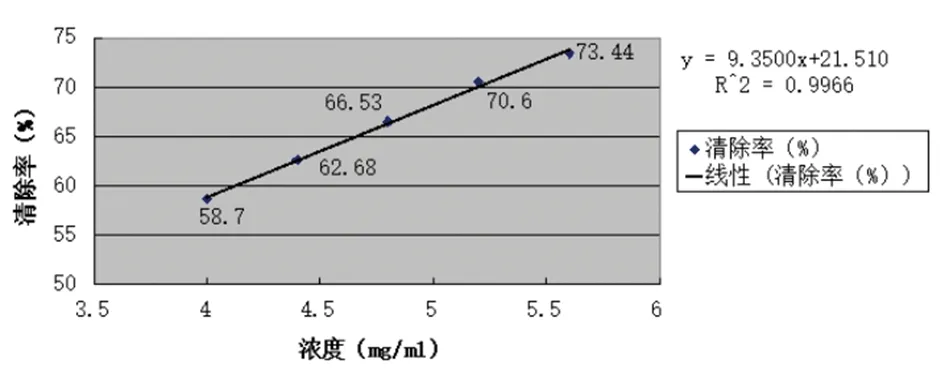
图6 泰山紫草丙酮提取物总黄酮线性关系
3 结 论
光光度法对泰山紫草总黄酮的含量进行了有关的研究和探索,建立的含量测量方法步骤简单、操作合理、可靠安全、精密度比较高、重复性及线性关系比较好,且回收率比较高,能为泰山紫草的质量提供了良好的控制和研究基础。用超声提取法提取紫草总黄酮,以乙醇、丙酮、乙酸乙酯、水进行不同部位提取,料液比1∶10,提取2次,每次提取时间为20 min,实验结果表明:不同提取部位的总黄酮含量有明显的差别,乙醇相黄酮类成分含量最高,水相黄酮类成分含量最少,其中不同提取部位总黄酮含量高低顺序为:乙醇>丙酮>乙酸乙酯>水相。泰山紫草根茎总黄酮对DPPH·自由基有较好的清除作用,在一定的浓度范围内,总黄酮含量同DPPH·清除率呈正相关性关系。
