大豆7S球蛋白α'亚基缺失新种质中黄608的分子鉴定
2019-12-25李俊英孙如建李忠峰魏中艳任玉龙俊邱丽娟
李俊英 孙如建 李忠峰 魏中艳 任玉龙 王 俊邱丽娟,*
大豆7S球蛋白α'亚基缺失新种质中黄608的分子鉴定
李俊英1,2,**孙如建2,3,**李忠峰2魏中艳2任玉龙2王 俊1,*邱丽娟2,*
1长江大学农学院, 湖北荆州 434025;2中国农业科学院作物科学研究所/ 国家农作物基因资源与遗传改良重大科学工程/ 农业部种质资源利用重点实验室, 北京 100081;3呼伦贝尔市农业科学研究所, 内蒙古扎兰屯 162650
大豆7S球蛋白α'亚基含量与大豆的营养品质和加工特性关系密切。本研究利用聚丙烯酰胺凝胶电泳(SDS-PAGE)和免疫印迹法(Western blot)从中品661的EMS突变库中筛选出α'亚基缺失突变体中黄608。利用中黄608与登科1号创建了一个由210个个体组成的F2分离群体。遗传分析表明, α'亚基缺失由1对隐性单基因控制。利用连锁分析方法将该基因定位于第10染色体标记SSR10-1489与SSR10-1612之间, 其中, 包括控制α'亚基合成基因(), 序列分析发现, 中黄608在第1外显子第84个碱基发生单碱基突变(G84→A84), 导致氨基酸翻译提前终止。根据新发现的变异位点开发了共显性分子标记, 并检测F2个体基因型, 结果表明,基因型与α'亚基表型共分离。本研究不仅为大豆优质育种提供了新材料, 同时也为分子育种提供了技术支持。
大豆; α'亚基; 突变体; 7S球蛋白; dCAPs标记
大豆[(L.) Merr.]种子中含有约40%的蛋白, 是人类和动物食用植物蛋白的主要来源之一。大豆富含钙、铁、锌、镁和维生素B等多种重要营养元素[1], 与人体健康密切相关, 具有如降胆固醇[2-3]、降血压[4]、抗癌症[5]等功效。
根据沉降系数大小, 可将大豆蛋白分为2S、7S、11S、15S等组分[9]。大豆蛋白70%为贮藏蛋白, 主要由7S球蛋白(β-conglycinin)与11S大豆球蛋白(glycinin)构成。其中7S球蛋白约占大豆总蛋白的30%, 它的组成亚基α' (~76 kD)、α (~71 kD)、β (~52 kD)等是引起人类和动物过敏的主要致敏源[10]。已有研究发现, α' (~76 kD)蛋白亚基含硫氨基酸较少[11], α'亚基缺失型大豆比α'亚基正常型大豆的蛋白凝胶硬度大[12]。α'亚基缺失不仅有利于豆腐的加工, 而且对大豆制品营养品质、加工特性等具有积极影响[13-14],因此, 控制7S球蛋白含量、培育α'亚基缺失材料已成为近年来大豆学科的重要研究方向之一。
日本学者对大豆α'亚基缺失的研究较早。Kitamura等[15]于1981年从日本大豆种质资源中鉴定出α'亚基缺失种质“Keburi”以及α和β亚基低含量种质。Takahashi等[16]利用γ射线处理“Keburi”, 从诱变后代中筛选出α'和α亚基双缺材料及7S球蛋白低含量材料, 通过遗传分析证明, α'亚基缺失表型由一个单隐性基因控制[17]。Teraishi等[18]从野生大豆资源中发现一份包含α'亚基整个7S亚基缺失的材料“QT2”, 并认为该性状由第20染色体上的一个显性位点控制。国内学者宋波等[19]和刘珊珊[20]等利用引自日本的α'+α亚基双缺失材料日B和当地栽培品种组配, 从后代中筛选出α'亚基、α'+α缺失等亚变异类型。我国关于α'亚基缺失材料的创制和遗传分子机制研究鲜见报道。
本研究利用SDS-PAGE技术, 从中品661的EMS突变体库[21]中筛选和创制α'亚基缺失种质中黄608; 利用该突变体和登科1号构建F2遗传分离群体, 并通过连锁分析将控制α'亚基基因定位在第10染色体上物理长度为1.77 Mb区间内, 进一步序列分析发现, 该突变体的α'亚基缺失可能是由基因新的等位变异控制, 并开发了分子标记。本研究为培育α'亚基缺失大豆新品系提供了优异种质材料和技术支撑。
1 材料与方法
1.1 遗传群体的构建
2016年夏季将大豆品种中品661的1000份M5代EMS诱变家系[21]播种于中国农业科学院作物所北京顺义试验基地。同时在内蒙古呼伦贝尔农业科学研究所试验地用α'亚基缺失突变体中黄608与当地主栽品种登科1号组配杂交组合, 在北京顺义种植获得F1种子, 并于当年冬季在海南加代种植收获F2种子。
1.2 α'亚基缺失候选基因定位
从宋启建等[22]开发的SSR标记中, 随机选取均匀覆盖大豆20条染色体的540个标记。利用非变性聚丙烯酰胺凝胶电泳技术, 筛选出突变体中黄608和登科1号之间具有多态性的标记, 分别鉴定F2个体的基因型, 通过连锁分析确定α'亚基缺失相关基因的候选定位区间。
1.3 大豆贮藏蛋白亚基组成聚丙烯酰胺凝胶电泳(SDS-PAGE)
选取亲本及F2籽粒, 在种脐背部磨取豆粉。称取0.5 mg豆粉放入2.0 mL离心管中, 加入0.5 mL蛋白提取液(0.2% SDS, 0.05 mol L–1Tris-HCl pH 8.0, 0.01 mol L–1巯基乙醇, 1 g L–1溴酚蓝, 5 mol L–1Urea)并振荡混匀, 于4℃环境下15,294×离心10 min, 取上清液。蛋白电泳所需凝胶厚度为1 mm, 浓缩胶浓度和分离胶浓度分别为5%、12%。取5 μL蛋白提取液进行SDS-PAGE, 电泳结束进行考马斯亮蓝染色、脱色。后用5%甘油和玻璃纸封存、照相和分析。
1.4 DNA提取、PCR扩增反应及产物测序
取幼嫩三出复叶, 利用CTAB法提取基因组DNA[23], 加200 μL灭菌水溶解, 经浓度检测后稀释为20 ng μL–1, 置–20℃冰箱保存备用。
PCR体系包括5 μL DNA (20 ng μL–1)、2 μL dNTPs、2 μL buffer、0.2 μL Easy酶和10.8 μL灭菌水。PCR扩增程序为95℃预变性5 min后, 经过34个循环的95℃变性30 s、55℃退火温度30 s和72℃延伸 20 s, 34个循环, 再经72℃ 5 min。从每个扩增样品分别取2 μL产物进行琼脂糖凝胶电泳检测, 同时将剩余样品送公司进行PCR测序。测序结果通过在线软件Multalin等比对分析(http://multalin. toulouse.inra.fr/multalin/multalin.html)。
1.5 引物设计及dCAPS标记开发
从NCBI数据库(https://www.ncbi.nlm.nih.gov/)下载靶基因的基因组序列, 以其为模板利用Primer3 (http://bioinfo.ut.ee/primer3-0.4.0/)设计引物-A和-B, 其对应PCR扩增产物长度分别为1598 bp和1702 bp, 可以覆盖基因组序列全长(表1)。

表1 基因Cgy-1 PCR扩增引物
基于突变体中黄608在基因上存在的SNP位点, 利用在线软件dCAPS Finder 2.0 (http://helix. wustl.edu/dcaps/dcaps.html)开发一个分子标记。因含有I内切酶识别位点T↓CGA序列, 以突变体中黄608基因组为PCR模板的扩增产物可被切割为2个片段, 而野生型中品661为模板的扩增产物因不含有此识别位点, 不能为I内切酶切割, 仅有一个条带(表2)。10 μL酶切反应体系包含5 μL PCR产物、3 UI内切酶和1.5 μL Cutsmart缓冲液。将酶切反应体系混匀, 放入37℃水浴锅温浴酶切1 h后, 用琼脂糖凝胶电泳(m V–1, 2%)检测, 80 V电压下运行1.5 h。扩增所需引物及限制性内切酶相关信息如表2所示。

表2 dCAPS标记的引物序列和内切酶
1.6 Western blot
取野生型中品661和突变体中黄608籽粒样品各5 mg, 研磨成豆粉分别加入500 μL提取液(0.05 mol L–1Tris-HCl pH 8.0)提取总蛋白, 具体流程参考[24]。蛋白电泳需要凝胶厚度为0.75 mm, 分离胶(m V–1, 12.5%)和浓缩胶(m V–1, 5%)各2.5 mL。从制备好的蛋白样品中各取10 µL上样, 浓缩胶120 V电压运行半个小时, 转至140 V电压下运行1 h后结束电泳。随后, 切下分离胶并用半干转膜仪进行转膜, 所需滤纸及NC膜在转膜前用转膜液提前浸泡。25 V电压下转膜1 h, 将NC膜取出放在含有5 mL 5%牛奶的小盒中, 并放置在摇床上封闭1 h; 随后, 在盒子中加入1 μL一抗(1∶5000)(IP-IF小鼠多抗), 孵育1 h后将牛奶倒掉并加入5 mL PBST洗膜液, 置摇床上振荡(100 r min–1) 5 min, 连续洗3次。洗膜后加入5 mL的PBST和1 μL的二抗(1∶10,000), 孵育1 h后加入约5 mL的PBST冲洗, 连续冲洗3遍, 每次5 min; 最后加入光学显色剂显色, 扫描照相。
1.7 统计分析

2 结果与分析
2.1 α'蛋白亚基缺突变体筛选及表型鉴定
大豆种子总蛋白电泳(SDS-PAGE)图谱中, 通常有7个蛋白条带比较清晰(图1-a, ZP661), 它们分别对应7S球蛋白的Lox、α、α'、β亚基和11S球蛋白的A3亚基、酸性亚基(Acidic)、碱性亚基(Basic)。利用SDS-PAGE技术, 从中品661的1055份M4代EMS诱变材料中筛选到1份α'亚基缺失材料, 命名为中黄608 (图1-a)。从后代株行表型鉴定结果进一步证实, α'亚基缺失突变体表型可以稳定遗传(图1-b)。
2.2 α'亚基缺失突变体中黄608的遗传分析
为了明确中黄608 α'亚基缺失性状的遗传方式, 构建了该突变体与大豆品种登科1号的F2遗传分离群体。SDS-PAGE鉴定结果显示, 杂交F1籽粒均含有α'亚基, 表型与登科1号一致。210个F2籽粒中, α'亚基缺失材料64粒, α'亚基正常146粒。经卡方检验, F2遗传分离群体中, α'亚基正常与缺失籽粒比例符合3∶1 (χ2= 1.43,= 0.08), 证明中黄608的籽粒α'亚基缺失性状是由一对隐性单基因控制(表3)。

图1 α'亚基缺失突变体的表型鉴定
a: α'亚基缺失材料中黄608与野生型中品661的SDS-PAGE电泳结果。b: 中黄608子代株行的α'亚基表型鉴定结果, 1~8分别为8个子代。
a: protein profiles of the α' subunit deletion mutant ZH608 and the wild-type ZP661 by SDS-PAGE. b: α' subunit mutant trait of ten individuals derived from ZH608 validated by SDS-PAGE (lanes 1–8).

表3 α'亚基缺失突变体F2群体遗传分析
2.3 α'亚基缺失突变体Cgy-1基因定位与候选基因筛选
选取均匀覆盖大豆基因组20条染色体540对SSR标记, 通过PCR反应和聚丙烯酰胺凝胶电泳筛选出亲本间具有多态性的84个标记。利用集团分离分析法(BSA)和F2突变个体, 将α'亚基基因定位在第10染色体标记SSR10_0982和SSR10_1638之间(图2-a)。通过进一步的多态性标记加密和基因型检测, 将定位区间缩小至标记SSR10_1489和SSR10_1612之间, 区间物理长度为1.77 Mb (图2-b)。
查询大豆Williams 82参考基因组, 该定位区间内注释编码蛋白的基因有190个。其中基因()在NCBI数据库的功能注释为与α'亚基蛋白编码有关(https://www.ncbi.nlm.nih.gov/ gene/?term=Cgy-1), Harada等[25]研究发现是编码α'亚基的唯一基因, 而且该基因在大豆籽粒中高表达, 推测该基因可能也是引起中黄608 α'亚基缺失的候选基因。
2.4 Cgy-1基因新等位变异位点的鉴定
在参考基因组中基因全长2730 bp, 包含6个外显子和5个内含子, 其中CDS序列全长1866 bp, 编码621个氨基酸。根据基因组序列, 我们设计2对引物Cgy1-F1和Cgy1-R1, 并对野生型中品661和α'亚基缺失突变体中黄608基因组DNA分别进行PCR扩增。PCR产物测序结果显示, 中黄608与野生型在基因组序列第一外显子上第84位核苷酸发生了变异, 由G变为了A, 导致密码子TGG (色氨酸)变成TGA (终止子), 翻译出氨基酸长度为27个, 显著短于野生型621个。推测基因截短的异常氨基酸序列可能造成了大豆籽粒蛋白中α'亚基缺失(图3-a)。利用合成的抗体对野生型中品661和α'亚基缺失突变体中黄608进行免疫印迹检测(Western blot)也显示, 野生型中品661在76 kD位置有2个条带, 而α'亚基缺失突变体中黄608在76 kD对应位置缺失相应的一条α'亚基蛋白条带(图3-b), 进一步证实的基因组序列改变与中黄608 α'亚基缺失表型相关。

图2 α'亚基缺失突变体的基因定位
a: 用210个F2单株将候选基因定位到标记SSR10-0982与SSR10-1638之间。b: 通过多态性标记筛选和加密, 将候选基因定位区间缩小至SSR10-1489与SSR10-1619之间。c: 突变体中黄608在基因第1外显子的第84位碱基发生突变(核苷酸G变为A), 造成编码氨基酸序列的提前终止。蓝色方框代表外显子, 白色方框代表5'和3'UTR, 黑线代表基因的内含子。
a: the candidate genewas mapped to between SSR marker SSR10-0982 and SSR10-1638 by using 210 F2individuals. b: the candidate interval was reduced to SSR10-1489 and SSR10-1619 by SSR polymorphic markers. c: the mutation of eighty-fourth bases at the first exon ofgene in the mutant Zhonghuang 608, resulted in pre-terminating of encoding amino acid. Blue boxes, white boxes, and black lines represent exons, 5' UTR/3' UTR and introns, respectively.

图3 野生型和突变体的SDS-PAGE (a)和Western blot (b)实验结果
Fig. 3 SDS-PAGE (a) and Western blot (b) results of mutants and wild type
a: SDS-PAGE电泳结果显示突变体中黄608 (ZH608)缺少α'亚基条带。b: Western blot结果: 抗体杂交结果表明野生型(ZH608)有2条带; 突变体(ZP661)缺失了α'亚基条带。
a: the result of SDS-PAGE showed that the mutant ZH608 lacked α' subunit. b: in antibody hybridization results showed that the wild type (ZH608) had two bands and the mutant (ZP661) lacked the α' subunit band.
2.5 dCAPS分子标记开发及其在F2群体中的应用
基于中黄608中基因上新的点突变, 本研究开发了一个dCAPS分子标记(命名为GM7S-1)。利用其对应引物(表2)分别扩增中黄608和野生型中品661基因组DNA, PCR产物长度均为158 bp (图4-a), 但是中黄608 的扩增条经I限制性内切酶消化后, 产生长度为138 bp和20 bp (图4-b)的2个片段, 而野生型158 bp的PCR扩增产物不能被该内切酶所消化。因而, 该 dCAPS标记可准确区分野生型和α'亚基缺失突变体中黄608。
在此基础之上, 利用标记GM7S-1对中黄608与登科1号杂交组合的210个F2子代进行基因型检测显示, 64个α'亚基缺失个体的PCR产物均可以被酶切为2个片段, 为纯合突变基因型A; 146个α'亚基正常个体中, 80个F2的PCR产物完全不能被酶切, 为纯合野生型基因型G, 另外有66个F2的PCR产物可以部分被I酶切, 为杂合基因型G/A(H)(图5)。由前述结果可知, F2个体的基因型与α'亚基表型表现一致。因此, 该dCAPS分子标记可用于α'亚基缺失表型的分子辅助鉴定。
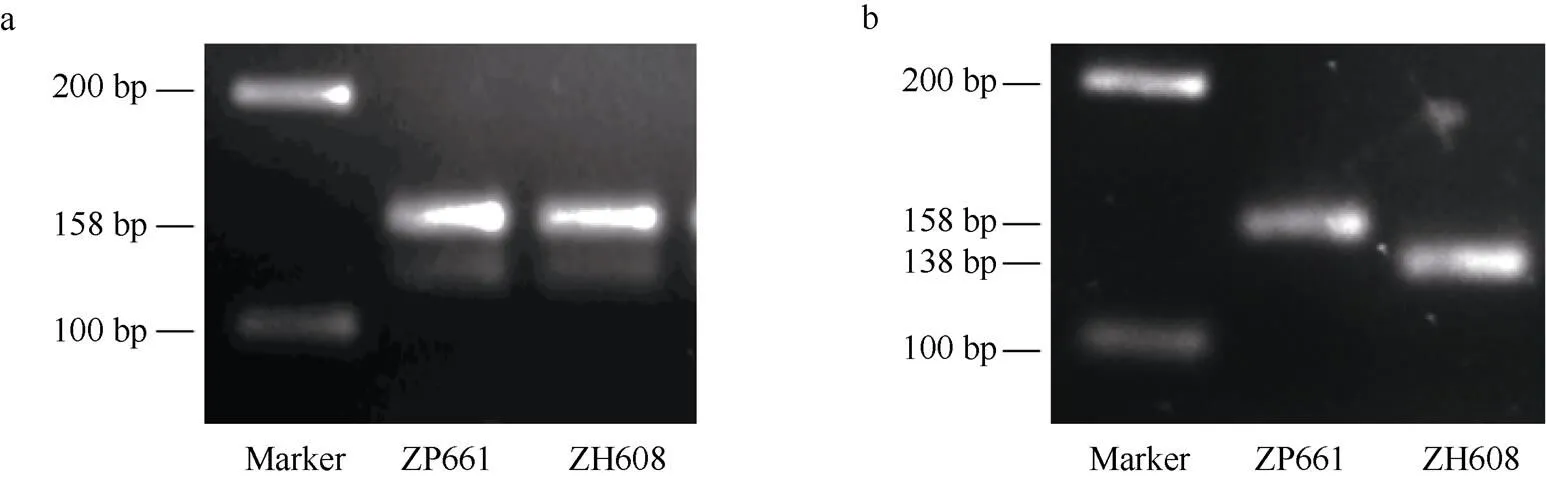
图4 dCAPS分子标记开发
a: 引物GM7S-1分别扩增野生型及突变体, PCR产物为150 bp的单一条带。b: ZH608的扩增产物被I酶酶切为2条更小的片段。
a: the single fragment was detected for the amplified PCR product of both the wild type and the mutant by the primer GM7S-1. b: the PCR product of ZH608 was cleaved into two smaller fragments by the restriction enzymeI.

图5 F2代dCAPs标记基因型检测结果
P1, P2为亲本; G为野生型基因型(父本), A为突变基因型(母本), H为杂合基因型。
P1is the female parent, and P2male parent. G, A, and H represent the wild type, mutant, and heterozygous genotype, respectively.
2.6 α'亚基缺失与11S/7S比值关系
α'亚基缺失材料中黄608的11S/7S比值为2.52, 显著高于野生型中品661 (2.04)(= 14.7,< 0.0001)。在中黄608与登科1号杂交组合的F2群体中, 64份α'亚基缺失材料的11S/7S平均值为2.73, 同样要显著高于146份α'亚基正常个体, 后者平均值为1.75 (= 11.76,< 0.0001)(图6)。可见, 作为7S大豆球蛋白的重要构成因子, α'亚基的缺失可以引起7S总量的减少, 进而改变11S/7S比值。
3 讨论
7S球蛋白α'亚基的缺失可以提高豆腐的凝胶硬度[26], 同时也能降低致敏性。因此, 筛选α'亚基缺失材料对提高大豆营养价值利用效率和改善其加工性能均十分重要。目前, 国内创制的大豆α'亚基缺失材料, 主要是利用国外材料与国内品种杂交选育的。例如, 刘珊珊[27]、宋波等[28]利用从日本引进的(α'+α)亚基缺失品种“日B”与黑龙江主栽品种东农47杂交, 从中筛选出α'缺失、A3缺失和α'+α亚基缺失等多种蛋白亚基变异类型材料。研究发现, 这些亚基缺失材料携带了不利基因位点, 多表现为萎黄病, 甚至发生致死, 不利于在大豆育种中进一步利用[29]。我国从α'亚基缺失材料变异中筛选的仅有几例[30-31], 尚不能满足α'亚基缺失品系选育需要。本研究中的α'亚基缺失材料中黄608是从高产、高油优良大豆品种中品661的化学诱变后代中筛选而来, 表现为α'亚基缺失表型但无黄化致死等不良性状, 为大豆蛋白品质改良提供了宝贵的材料。

图6 F2群体α'亚基缺失和α'亚基正常材料11S/7S比值分布
目前, 已报道的α'亚基缺失的等位基因有限。Kim等[32]研究发现, ‘Keburi’ α'亚基缺失表型可能与整个基因及不完整串联重复序列的12,998 bp删除相关。张国敏[33]从2份α'亚基缺失材料中分别克隆基因, 发现二者cDNA序列的361 bp和529 bp处均发生小片段缺失, 推测该基因的突变导致了α'亚基缺失。本研究则发现,基因组因第84位碱基发生了突变, 使编码氨基酸序列提前终止, 导致中黄608的α'亚基缺失表型。在此基础上, 我们利用鉴定出的基因的新等位变异位点开发了分子标记。为α'亚基缺失表型的分子标记辅助育种提供了新材料和技术支持。与前人研究结果类似[34],本研究发现中黄608因α'亚基缺失, 导致11S/7S比值变大, 并且蛋白质含量较野生型表现一定程度增加, 然而, α'亚基缺失对大豆籽粒总蛋白含量的影响以及二者相互关系还有待进一步研究[35]。
4 结论
利用α'亚基缺失突变体中黄608构建的F2群体, 通过连锁分析将控制α'亚基合成基因定位在Chr10标记SSR10_1489和SSR10_1612之间1.77 Mb的区间内。基因第84位碱基的突变, 导致编码氨基酸的提前终止。推测这是α'亚基的缺失的原因。
[1] Shu X O, Jin F, Dai Q, Wen W, Potter J D, Kushi L H, Ruan Z, Gao Y T, Zheng W. Soyfood intake during adolescence and subsequent risk of breast cancer among Chinese women., 2001, 10: 483–488.
[2] Fukui K, Tachibana N, Wanezaki S, Tsuzaki S, Takamatsu K, Yamamoto T, Hashimoto Y and Shimoda T. Isoflavone-free soy protein prepared by column chromatography reduces plasma cholesterol in rats., 2002, 50: 5717–5721.
[3] Huang W, Wood C, L’Abbé M R, Gilani G S, Cockell K A, Xiao C W. Soy protein isolate increases hepatic thyroid hormone receptor content and inhibits its binding to target genes in rats., 2005, 135: 1631–1635.
[4] Lo W M Y, Li-Chan E C Y. Angotensin I converting enzyme inhibitory peptides from in vitro pepsin-pencreatin digestion of soy protein., 2005, 53: 3369–3376.
[5] Tsuruki T, Takahata K, Yoshikawa M. Anti-alopecia mechanisms of soymetide-4, an immunostimulating peptide derived from soy β-conglycinin., 2005, 26: 707–711.
[6] Cordle C T. Soy protein allergy: Incidence and relative severity., 2004, 134: 1213S–1219S.
[7] Fukushima D. Recent progress of soybean protein foods: chemistry, technology and nutrition., 1991, 7: 323–351.
[8] 刘春, 王显生, 麻浩. 大豆种子贮藏蛋白亚基特异种质的蛋白功能性评价. 中国油脂, 2008, 33(8): 31–36. Liu C, Wang X S, Ma H. Evaluations on functional properties of soybean protein isolates prepared from cultivars with seed storage protein subunits variation., 2008, 33(8): 31–36 (in Chinese with English abstract).
[9] Wolf W J, Briggs D R. Ultracentrifugal investigation of the effect of neutral salts on the extraction of soybean proteins., 1956, 63: 40–49.
[10] Krishnan H B, Kim W S, Jang S, Kerley M S. All three subunits of soybean beta-conglycinin are potential food allergens., 2011, 57: 938–943.
[11] 周瑞宝, 周兵. 大豆7S和11S球蛋白的结构和功能性质. 中国粮油学报, 1998, (6): 39–42. Zhou R B, Zhou B, The structure and functional properties of soybean 7S and 11S globulin proteins., 1998, (6): 39–42 (in Chinese with English abstract).
[12] Mohamad Ramlan B M, Maruyama N, Takahashi K, Yagasaki K, Higasa T, Matsumura Y, Utsumi S. Gelling properties of soybean beta-conglycinin having different subunit compositions., 2004, 68: 1091–1096.
[13] Fukushima D. Structures of plant storage proteins and their functions., 1991, 7: 353–381.
[14] Fukushima D. Recent progress of soybean protein foods: chemistry, technology, and nutrition., 1991, 7: 323–351.
[15] Kitamura K, Kaizuma N. Mutant strains with low level of subunits of 7S globulin in soybean (Merr.) seed., 2008, 31: 353–359.
[16] Takahashi K, Banba H, Kikuchi A, Ito M, Nakamura S. An induced mutant line lacking the alpha-subunit of beta-conglycininin soybean ((L.) Merrill)., 1994, 44: 65–66.
[17] Kitamura K, Davies C S, Nielsen N C. Inheritance of alleles forandstorage protein genes in soybean., 1984, 68: 253–257.
[18] Teraishi M, Takahashi M, Hajika M, Matsunaga R, Uematsu Y, Ishimoto M. Suppression of soybean β-conglycinin genes by a dominant gene,., 2001, 103: 1266–1272.
[19] 宋波, 蓝岚, 田福东, 拓云, 白月, 姜自芹, 申丽威, 李文滨, 刘珊珊. 大豆7S球蛋白α'亚基缺失及(α'+α)亚基双缺失品系的回交转育. 作物学报, 2012, 38: 2297–2305. Song B, Lan L, Tian F D, Tuo Y, Bai Y, Jiang Z Q, Shen L W, Li W B, Liu S S. Development of soybean lines with α'-subunit or (α'+α)-subunits deficiency in 7S globulin by backcrossing,, 2012, 38: 2297–2305 (in Chinese with English abstract).
[20] 刘珊珊, 王志坤, 葛玉君, 刁桂珠, 田福东, 高丽辉, 李文滨. 大豆7S球蛋白亚基相对含量与品质性状间的相关分析. 中国油料作物学报, 2008, 30: 284–289. Liu S S, Wang Z K, Ge Y J, Diao G Z, Tian F D, Gao L H, Li W B. Correlations between relative content of individual subunit of 7S globulin and quality characteristics in soybean germplasm., 2008, 30: 284–289 (in Chinese with English abstract).
[21] Song Q J, Jia G F, Zhu Y L, Grant D, Nelson R T, Hwang E Y. Abundance of SSR motifs and development of candidate polymorphic SSR markers (barcsoyssr_1.0) in soybean., 2010, 50: 1950–1960.
[22] Li Z F, Jiang L X, Ma Y S, Wei Z Y, Hong H L, Liu Z X, Lei J H, Liu Y, Guan R X, Guo Y, Jin L G, Zhang L J, Li Y H, Ren Y L, He W, Liu M, Nan M P, Liu L, Guo B F, Song J, Tan B, Liu G F, Li M Q, Zhang X L, Liu B, Shi X H, Han S N, Hua S N, Zhou F L, Yu L L, Li Y F, Wang S, Wang J, Chang R Z, Qiu L J. Development and utilization of a new chemically induced soybean library with a high mutation density., 2017, 59: 60–74.
[23] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA., 1980, 8: 4321–4325.
[24] Yagasaki K, Takagi T, Sakai M, Kitamura K. Biochemical characterization of soybean protein consisting of different subunits of glycinin., 1997, 45: 656–660.
[25] Harada J J, Barker S J, Goldberg R B. Soybean beta-conglycinin genes are clustered in several DNA regions and are regulated by transcriptional and posttranscriptional processes., 1989, 1: 415–425.
[26] Poysa V, Woodrow L, Yu K. Effect of soy protein subunit composition on tofu quality., 2006, 39: 309–317.
[27] 刘珊珊, 滕卫丽, 姜自芹, 张彬彬, 葛玉君, 刁桂珠, 郑天慧, 曾蕊, 李文滨. 大豆7S球蛋白α-亚基缺失型种质创新. 作物学报, 2010, 36: 1409–1413. Liu S S, Teng W L, Jiang Z Q, Zhang B B, Ge Y J, Diao G Z, Zheng T H, Jiang Z Q, Zeng R, Wu S, Li W B. Development of soybean germplasm lacking of 7S globulin α-subunit., 2010, 36: 1409–1413 (in Chinese with English abstract).
[28] 宋波, 蓝岚, 田福东, 拓云, 白月, 姜自芹, 申丽威, 李文滨, 刘珊珊. 大豆7S球蛋白α'亚基缺失及(α'+α)亚基双缺失品系的回交转育. 作物学报, 2012, 38: 2297–2305.Song B, Lan L, Tian F D, Tuo Y, Bai Y, Jiang Z Q, Shen L W, Li W B, Liu S S. Development of soybean lines with α'-subunit or (α'+α)-subunits deficiency in 7S globulin by backcrossing., 2012, 38: 2297–2305 (in Chinese with English abstract).
[29] 张国敏, 张亚琴, 舒英杰, 麻浩. 三种大豆种子贮藏蛋白亚基缺失种质的筛选与鉴定. 大豆科学, 2015, 34: 1–8. Zhang G M, Zhang Y Q, Shu Y J, Ma H. Screening and identification of three type of soybean lines lacking different seed storage protein subunits., 2015, 34: 1–8 (in Chinese with English abstract).
[30] 姜振峰, 赫卫, 汪洋, 李文滨. 大豆种子7S、11S球蛋白及7S球蛋白亚基的研究. 中国油料作物学报, 2007, 29: 138–141. Jiang Z F, He W, Wang Y, Li W B. Study on 7S, 11S globulin of soybean seed., 2007, 29: 138–141 (in Chinese with English abstract).
[31] Liu S, Ohta K, Dong C, Thanh VC, Ishimoto M, Qin Z, Hirata Y. Genetic diversity of soybean ((L.) Merrill) 7S globulin protein subunits, 2006, 53: 1209–1219.
[32] Kim S, Kim M Y, Van K, Lee Y H, Kim H S, Cai C M, Park B S, Seo H S, Lee S H. The development of a co-dominant marker for the β-conglycinin α′ subunit in soybeans., 2011, 177: 355–363.
[33] 张国敏. 种子贮藏蛋白亚基缺失大豆种质的鉴定及其蛋白质功能性评价与α'亚基缺失的分子机制. 南京农业大学硕士学位论文, 江苏南京, 2014. Zhang G M. Identification of Soybean Lines Lacking Different Seed Storage Protein Subunits, Their Functional Properties of Proteins and the Molecular Mechanism of Lacking α' Subunit. MS Thesis of Nanjing Agriculture University, Nanjing, Jiangsu, China, 2014 (in Chinese with English abstract).
[34] Kitamura K, Kaizuma N. Mutant Strains with low level of subunits of 7S globulin in soybean (Merr.) seed., 2008, 31: 353–359.
[35] Krishnan, Hari B. Engineering soybean for enhanced sulfur amino acid content., 2005, 45: 454–461.
Molecular identification of a new soybean germplasm Zhonghuang 608 lacking of 7S globulin alpha' subunit
LI Jun-Ying1,2,**, SUN Ru-Jian2,3,**, LI Zhong-Feng2, WEI Zhong-Yan2, REN Yu-Long2, WANG Jun1,*,and QIU Li-Juan2,*
1College of Agriculture, Yangtze University, Jingzhou 434025, Hubei, China;2Key Laboratory of Crop Germplasm Utilization, Ministry of Agriculture, Institute of Crop Sciences, Chinese Academy of Agricultural Science, Beijing 100081, China / National Key Facility for Gene Resources and Genetic Improvement, Beijing 100081, China;3Hulun Buir Institution of Agricultural Sciences, Zhalantun 162650, Inner Mongolia, China
The content of alpha' subunit of 7S globulin has an important effect on the nutritional quality and processing characteristics in soybean. In this study, using polyacrylamide gel electrophoresis (SDS-PAGE) and Western blotting, Zhonghuang 608 (ZH608), an α' subunit deletion mutant, was identified from the Zhongpin 661 (ZP661) EMS mutant library. Zhonghuang 608 was crossed to the soybean variety Dengke 1, and self-pollinated to establish an F2segregating population composed of 210 individuals. Genetic analysis showed that the alpha' subunit deletion trait in ZH608 was controlled by a single recessive nuclear gene. By linkage analysis we mapped the locus between SSR10-1489 and SSR10-1612 on chromosome 10. Coincidentally, in the mapping region() was annotated as an alpha' subunit synthesis-related gene according to the Williams 82 reference genome. Further sequence analysis showed that the mutant had a single base change (G84to A84) in the first exon of, which resulted in the premature termination of the amino acid sequence. Based on the newly discovered SNP mutation, a co-dominant molecular marker was developed, and used to detect the genotypes of those F2individuals. The results indicated that thegenotype cosegregated with the alpha' subunit phenotype in the F2segregating population of Zh608 and Dengke 1. This study not only provides new materials for quality improvement, but also offers technical support for molecular breeding in soybean.
soybean; alpha' sunbunit; mutant; 7S globulin; dCAPS marker
2018-06-02;
2018-10-08;
2018-11-06.
10.3724/SP.J.1006.2019.84078
通信作者(Corresponding authors): 邱丽娟, E-mail: qiulijuan@caas.cn; 王俊, E-mail: wjsoybean_2008@163.com
**同等贡献(Contributed equally to this work)
李俊英, E-mail: 13051379117@163.com
本研究由“十三五”国家重点研发计划(2016YFD0100201)和国家大豆种质资源平台(2016-004)项目资助。
The study was supported by the National Key R&D Program for Crop Breeding (2016YFD0100201) and the National Soybean Germplasm Resources Platform (2016-004).
URL: http://kns.cnki.net/kcms/detail/11.1809.s.20181105.1125.014.html
