OPG-HSP70对CIA 小鼠模型血清学参数的影响及其与疗效的相关性分析
2019-12-25夏思思赵文明荣雨佳
夏思思 赵文明 荣雨佳
1.首都医科大学附属北京朝阳医院风湿免疫科,北京 100020;2.首都医科大学基础医学院免疫学系,北京 100069;3.中国航天科工集团七三一医院检验科血库,北京 100074
骨保护素(osteoprotegerin,OPG)可明显改善类风湿性关节炎(rheumatoid arthritis,RA)的骨流失,但对抑制滑膜炎没有作用[1-2]。热休克蛋白(heat shock proteins,HSPs)中某些保守的、具有与哺乳动物HSP同源序列的交叉反应性T 细胞表位可抑制关节炎进展[3-4]。为了改善RA 骨破坏及炎症损伤,本实验室将结核杆菌HSP70的部分基因序列引入到人OPG 功能性基因片段中,制备了OPG-HSP70融合蛋白,并利用胶原诱导的关节炎(collagen-induced arthritis,CIA)模型鼠评估其改善滑膜炎和骨侵蚀的作用。CIA 是经典的RA 动物模型,常用来研究RA 病理改变和评估新药[5-6]。鉴于中和抗体产生是生物制剂长期应用后疗效降低的机制之一[7-8],本研究分析了应用OPGHSP70融合蛋白后血清核因子κB 受体活化因子配基(receptor activator of nuclear factor-κB ligand,RANKL)、Ca2+、Ⅱ型胶原(collagen type Ⅱ,CⅡ)抗体与CIA小鼠滑膜炎及骨量改变的相关性,并检测了融合蛋白的免疫原性,为研发同时拮抗RA 炎症和骨破坏药物提供实验依据。
1 材料与方法
1.1 主要试剂
OPG、OPG-HSP70融合蛋白为首都医科大学基础医学院免疫学实验室保存。牛CⅡ蛋白、含4 mg/mL卡介苗的完全弗氏佐剂(complete Freund′s adjuvant,CFA)和牛CⅡ抗体测定试剂盒均购自美国Chondrex公司;辣根过氧化物酶标记的山羊抗小鼠IgG 抗体购自美国SAB 公司;小鼠RANKL 酶联免疫吸附法(ELISA)检测试剂盒和人OPG 重组蛋白均购自美国R&D 公司;钙离子检测试剂盒(DICA-500)购自美国BioAssay公司。
1.2 实验动物及分组
4~6周龄的SPF 级雄性DBA/1小鼠和雌雄各半的BALB/c 小鼠,体重(17±2)g,均购自北京华阜康科技有限公司,合格证号:0219345。小鼠在首都医科大学实验动物中心饲养,饲养及实验操作严格按照《首都医科大学实验动物伦理规范》进行,伦理审批号:SYXK2007-005。DBA/1小鼠按体重分为3组:OPGHSP70治疗组(n=20)、OPG 治疗组(n=12)和模型对照组(n=12)。BALB/c 小鼠按体重分为3组,OPGHSP70治疗组、OPG 治疗组和PBS 对照组,每组6只。
1.3 CIA 模型制备和评估
用CFA 与牛CⅡ(1∶1混合)在距DBA/1小鼠尾根部1.5 cm 处,皮内注射(100 μL/只)诱导CIA 模型。诱导后18 d 小鼠开始发病,最初表现为单关节肿胀,继而由趾端向踝关节发展。隔天按0~4分五级进行关节炎指数评分:无红肿记0分;累及一个关节红和/或肿胀记1分;累及两个关节的肿胀记2分;累及两个以上关节的肿胀记3分;包括踝关节在内的全部足爪肿胀记4分,每个足爪最高记4分,一只小鼠最高记16分,关节炎指数越高,炎症程度越重[9-10]。
1.4 给药方法
DBA/1小鼠发病后即参照文献进行相应给药处理[11-12],连续4周隔日一次腹腔注射给药,剂量如下:OPG-HSP70治疗组[50 mg/(kg·次)]、OPG 治疗组[45 mg/(kg·次)]、模型对照组(等剂量PBS)。BALB/c小鼠免疫原性测定的给药剂量、方式、次数同DBA/1小鼠。
1.5 骨相对灰度值计算
DBA/1小鼠给药4周后断颈处死,将后肢去皮毛和多余皮下组织,按相同姿势固定于小动物专用的Micro-CT 测定板(由北京大学医学部实验动物中心提供)上,将四肢踝关节到趾间的部分扫描后进行三维重建,并进行灰度值计算[13]。
1.6 血清学指标检测
DBA/1小鼠处死当日眼眶静脉采血,分离血清,ELISA 法检测血清中抗CⅡ抗体和RANKL 的水平,化学法检测血清钙离子水平;BALB/c 小鼠给药后0、1、2、3周间断采集血清,ELISA 法检测OPG 抗体的水平。具体操作按试剂盒说明书进行。
1.7 统计学方法
采用SPSS 16.0统计学软件进行数据分析,计量资料用均数±标准差()表示,多组间比较采用单因素方差分析,两组间比较采用LSD 检验;参数之间的相关性采用Logistic 线性回归分析。以P <0.05为差异有统计学意义。
2 结果
2.1 OPG-HSP70融合蛋白CIA 小鼠炎症和骨破坏的改善作用
胶原诱导后18 d,各组小鼠开始发病,与模型对照组比较,OPG-HSP70治疗组的关节炎指数明显降低(P <0.01),骨密度值明显增加(P <0.05),CⅡ抗体明显下降(P <0.01);RANKL 水平下降,Ca2+水平增高,但差异均无统计学意义(P >0.05)。与OPG 治疗组比较,OPG-HSP70治疗组关节炎指数降低(P <0.05),骨密度增加(P <0.05);与模型对照组比较,OPG 治疗组CⅡ抗体显著降低,差异有高度统计学意义(P <0.01)。见表1。
2.2 血清学指标与病情相关性分析
血清学指标与病情相关性分析的结果显示,血清中CⅡ抗体越高,关节炎指数越高,滑膜炎越重,呈正相关(r=0.892,P <0.01)。血清中Ca2+和RANKL 水平越高,骨密度值越低,骨破坏程度越重,呈负相关(r=-0.582、r=-0.588,均P <0.01)。见图1。提示应用OPG-HSP70治疗后,可以用血清学指标监测治疗敏感度。
表1 CIA 小鼠关节炎指数和血清学指标()

表1 CIA 小鼠关节炎指数和血清学指标()
注:与模型对照组比较,*P <0.05,**P <0.01;与OPG 治疗组比较,#P <0.05。CⅡ:Ⅱ型胶原;RANKL:核因子κB 受体活化因子配基;Ca2+:钙离子
2.3 血清免疫原性分析
为了明确OPG-HSP70融合蛋白的免疫原性,采用间接ELISA 法动态监测血清抗OPG 抗体的滴度。给药后,OPG-HSP70治疗组和抗OPG 治疗组均可检测到相应的抗体。给药后,OPG-HSP70给药组抗OPG 抗体水平均高于PBS 对照组(P <0.01)。但与OPG 治疗组比较,OPG-HSP70治疗组的OPG 抗体滴度在给药后2周开始低于OPG 治疗组,且随时间延长而逐渐下降,差异有统计学意义(P <0.05)。见表2。
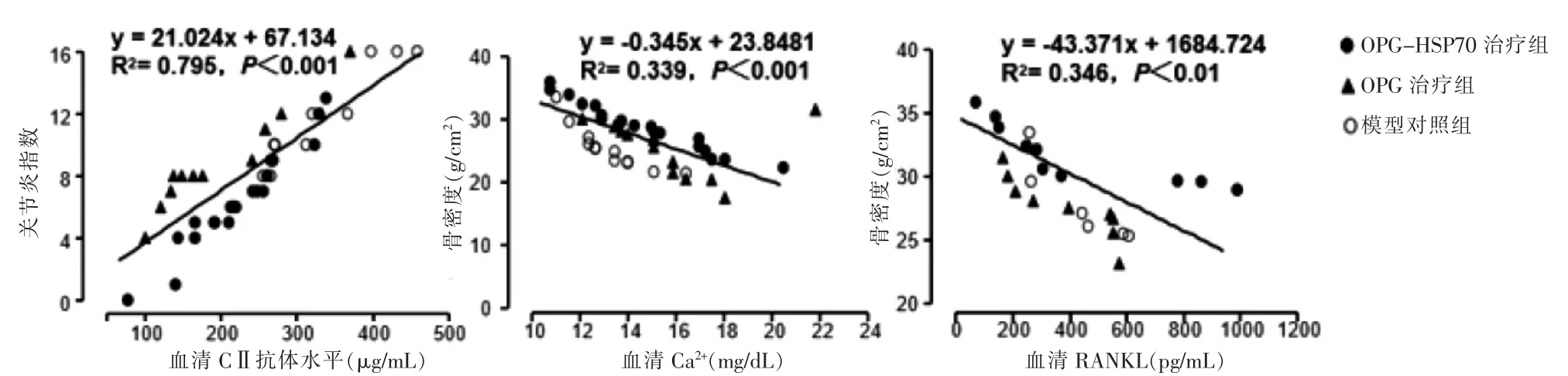
图1 血清学指标与病情相关性分析
表2 血清抗OPG 抗体水平(OD450nm,)
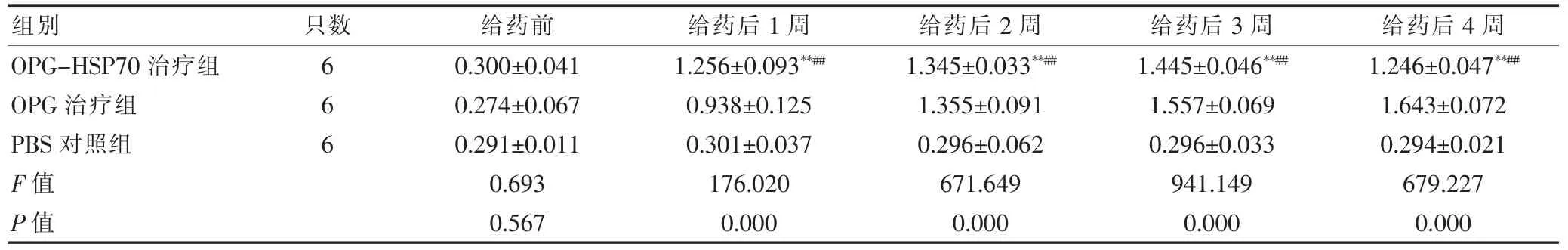
表2 血清抗OPG 抗体水平(OD450nm,)
注:与PBS 对照组比较,*P <0.05,**P <0.01;与OPG 治疗组比较,##P <0.01。OPG:骨保护素;OPG-HSP70:骨保护素-热休克蛋白70;PBS:磷酸盐缓冲液
3 讨论
OPG 是1997年发现的肿瘤坏死因子受体家族新成员,为一种含有401个氨基酸的可溶性分泌型糖蛋白[14]。OPG 作为RANKL 的可溶性诱饵受体与破骨细胞上的核转录因子-κB 受体活化因子(receptor activator of nuclear factor κB,RANK)竞争结合RANKL,抑制破骨细胞分化、成熟而终止骨吸收,并通过接触到临近的成骨细胞促进骨形成。多项研究发现在RA 的关节滑膜及局部骨侵蚀处可见RANKL 表达异常增高[15],而OPG 在RA 关节中的表达相对不足[16]。因此促进OPG 表达成为防治RA 关节骨侵蚀的有效途径。研究表明,OPG 在体内外能有效地阻止RA 患者破骨细胞的成熟与分化,抑制骨破坏,但对滑膜炎症没有作用[1]。为了使OPG 具有抑制炎症作用,本研究引入了HSP70片段制备了OPG-HSP70融合蛋白,关节炎指数和CⅡ抗体的明显下降提示引入HSP70后融合蛋白具备了抑制炎症的作用;且骨密度值出现上升,表明抑制炎症可进一步降低骨破坏。
HSP70的生物学作用主要是防止细胞凋亡、抗氧化、作为分子伴侣辅助蛋白折叠与转运[17-18]。近年研究表明HSP70具有抗炎作用,主要与其抑制NF-κB 的活性、减少炎症介质产生、增强抗炎细胞因子的表达有关[19-20]。本研究中,HSP70引入后构建的OPGHSP70融合蛋白不仅增加了抑制滑膜炎的效果,而且还具有调节免疫反应的作用,血清中反映疾病预后指标的CⅡ抗体水平下降,而且影响疗效的OPG 抗体也明显低于OPG 治疗组,这提示引入HSP70后可以使融合蛋白的免疫原性降低,有助于增加疗效。这可能是由于OPG 功能蛋白与HSP70重组后,蛋白空间结构的改变降低了其免疫原性,具体原因有待进一步研究。
综上所述,滑膜炎和骨损伤是类风湿关节炎两个最显著的病理学特征。本研究将OPG 和HSP70两者的功能性片段连接,制备了OPG-HSP70融合蛋白,去除了与RA 治疗无关,甚至对机体有害的肽段,也解决了由于HSP70发挥抑炎作用的功能片段小,可能不利于单独应用的问题;该融合蛋白能同时发挥两种功效,可一并治疗RA 的炎性反应和骨损伤这两个密切相关的病症。
