应用FISH-AFLP技术分析105份樱桃种质资源的亲缘关系
2019-12-24陈新徐丽宗晓娟王甲威谭钺朱东姿魏海蓉洪坡刘庆忠
陈新 徐丽 宗晓娟 王甲威 谭钺 朱东姿 魏海蓉 洪坡 刘庆忠


摘要:为建立樱桃种质资源的FISH-AFLP技术体系并进行亲缘关系分析,本研究以国内外搜集的105份樱桃种质为对象,经DNA提取、EcoRⅠ/MseⅠ双酶切,再进行FISH-AFLP反应。扩增结果显示,筛选得到8对EcoRⅠ/MseⅠ多态性引物,可扩增出1 148条谱带,平均多态性比率98.61%。聚类分析和遗传多样性分析结果显示,105份樱桃栽培品种的遗传相似性系数为0.54~0.89,当阈值为0.68时,可分成7个AFLP群;有效等位基因数、基因多样度、Shannon信息指数分别为1.52、0.30、0.45,具有较高的遗传多样性。本研究结果可为今后樱桃品种鉴别和遗传多样性研究等提供理论指导。
关键词:樱桃;FISH-AFLP;遗传多样性;亲缘关系
中图分类号:S662.5文献标识号:A文章编号:1001-4942(2019)11-0022-06
Genetic Relationship Analysis of 105 Accessions of
Cherry Germplasms by FISH-AFLP Technology
Chen Xin, Xu Li, Zong Xiaojuan, Wang Jiawei, Tan Yue,
Zhu Dongzi, Wei Hairong, Hong Po, Liu Qingzhong
(Shandong Institute of Pomology/Shandong Provincial Key Laboratory of
Fruit Tree Biotechnology Breeding, Taian 271000, China)
Abstract The objective of this study was to establish FISH-AFLP analysis system for cherry and analyze the genetic relationship of the main cultivars. One hundred and five cherry cultivars were selected as experiment materials. The high-quality genomic DNA was extracted and the purified DNA samples were digested with EcoRⅠ/MseⅠ;after ligation reaction, the samples were used to perform FISH-AFLP detection. The amplification results showed that eight pairs of EcoRⅠ/MseⅠ polymorphic primers were screened and 1 148 bands were obtained. The average percentage of polymorphic bands was 98.61%. The results of cluster analysis and genetic diversity analysis showed that the genetic similarity coefficient of the 105 cherry cultivars varied from 0.54 to 0.89. All the samples were divided into 7 groups when the threshold value was 0.68. The numbers of effective alleles, gene diversity and Shannon information index of the main cultivars were 1.52, 0.30 and 0.45, respectively, indicating high genetic diversity. This study could provide theoretical guidance for the identification and genetic diversity research of cherry varieties in the future.
Keywords Cherry; FISH-AFLP; Genetic diversity; Genetic relationship
櫻桃为多年生木本果树,属蔷薇科樱桃属。目前世界上作为果树栽培的樱桃有4个种,品种繁多,仅栽培品种就超过2 000个。随着我国新品种的不断选育以及国外品种的引进,基于表型性状标记鉴定不同品种以及确定品种分类地位及相互之间的亲缘关系越来越困难。DNA分子标记在樱桃上的应用已有报道。其中,RAPD[1-3]、SSR[4,5]皆曾用于樱桃种质资源的研究,但揭示的多态性位点较少;国外研究者曾利用cpSCAR分析樱桃品种间的遗传关系和多样性[6],但多集中在亲缘关系较近的欧洲甜樱桃品种上,尤其是一些老品种。
AFLP(amplified fragment length polymorphism,扩增片段长度多态性)检测DNA多态性的方法,于1995年以论文形式发表[7],是通过限制性内切酶片段的不同长度检测DNA多态性的一种DNA分子标记技术。AFLP具有多态性强、谱带丰富和灵敏、分辨率高、快速高效、重复性好等特点,是一种较为理想的分子标记技术[8],可用于检测种及种以下水平上的差异。目前,科研人员已利用AFLP技术进行遗传连锁图谱构建、抗病连锁基因分析和品种亲缘关系等研究[9-11]。而带有荧光标记的FISH-AFLP技术在各种生物的遗传多样性分析、分子鉴定和群体遗传结构等研究中也得到广泛应用[12-17],但该技术应用于樱桃资源的研究未见报道。基于此,本试验利用FISH-AFLP技术标记对樱桃种质进行研究,并对遗传多样性的重要度量指标——有效等位基因数(Ne)、基因多样度(H)及Shannon信息指数(I)进行分析,旨在建立樱桃种质FISH-AFLP分子标记的方法,并为品种鉴别、亲缘关系划分和遗传多样性研究等提供参考。
1 材料与方法
1.1 试验材料
供试样品为105份樱桃种质资源(表1),均种植于山东省果树研究所樱桃品种资源圃。于2018年4月采集树体中上部新鲜嫩叶,置于冰盒带回实验室,-80℃保存备用。
1.2 樱桃基因组DNA制备及酶切反应
采用改良CTAB法[18]提取叶片基因组DNA,用0.8%的琼脂糖凝胶电泳检测其质量。
酶切和连接反应在同一反应中进行。总体系20 μL:10×AFLP digest-ligation Buffer 2 μL、AFLP digest-ligation Enzyme Mix 1.8 μL、EcoRⅠ/MseⅠAdaptor(10 μmol/L) 各1 μL、模板DNA 5 μL,补ddH2O至20 μL。混匀离心数秒,25℃保温5 h。
1.3 AFLP分析
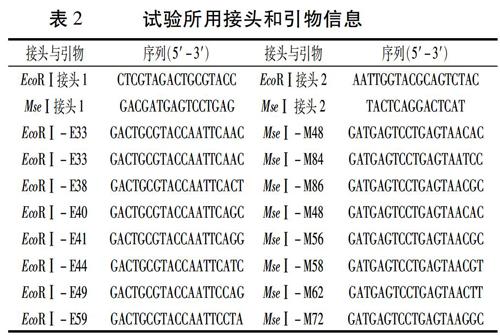
利用编号为4、25、26和91的样本,从64对AFLP EcoRⅠ/MseⅠ引物中筛选出扩增图谱清晰的8对引物:E41M56、E49M62、E44M58、E33M84、E59M72、E33M48、E38M86和E40M48(表2)。
预扩增反应总体系为20 μL,其中包括酶切-连接模板DNA 4 μL,2×PCR Mix 10 μL,EcoR Ⅰ和MseⅠ引物(20 μmol/L)各1 μL,ddH2O 4 μL。PCR反应程序:94℃ 3 min;94℃ 30 s,50℃ 30 s,72℃ 1 min,30个循环; 72℃ 5 min;4℃保存。预扩产物稀释20倍作为选扩模板,选择性扩增总体系20 μL,其中包括预扩增稀释样品 2 μL,2×PCR Mix 10 μL,EcoRⅠ和5′端带有荧光标记的MseⅠ引物(20 μmol/L,表2)各1 μL,ddH2O 6 μL。PCR反应程序为:95℃ 5 min;95℃ 35 s,65℃ 35 s,72℃ 1 min,每个循环退火温度递减0.7℃,扩增12轮; 94℃ 30 s,56℃ 30 s,72℃ 1 min,23个循环;72℃ 5 min;4℃保存。
将甲酰胺与分子量内标按100∶1的体积比混匀后,取15 μL加入上样板,再加入1 μL稀释10倍的上述PCR产物。使用3730XL测序仪进行毛细管电泳。
1.4 数据统计与分析
利用GeneMarker 1.8 软件将测序仪得到的原始数据进行分析,将电泳图转化为0/1数据矩阵,即有带记为1,无带记为0;用软件NTSYS-pc 2.11对所得数据矩阵进行聚类分析,生成聚类图;用软件Popgene 1.32计算样品遗传多样性的度量指标——有效等位基因数(Ne)、基因多样度(H)及 Shannon 信息指数(I)。
2 结果与分析
2.1 不同引物组合 FISH-AFLP 扩增的多态性比较[HTSS]
由表3可以看出,8对引物共扩增得到1 148条谱带,平均每对引物产生143.5条谱带,多态性谱带1 132条,平均多态性比率98.61%。不同引物组合在扩增带数、带型、条带分布均匀度等方面皆有所差异。其中,引物组合E33M84和 E41M56多态性比例达到100%,其它引物组合的多态性比例也在95%以上。图1为引物组合E40M48对所有样品的扩增结果。
2.2 105份樱桃种质资源的亲缘关系
2.2.1 遗传相似性系数 [HTSS]105份樱桃种质资源的遗传相似性系数为0.54~0.89,平均值为0.72。其中桑缇娜和Stella的遗传相似性系数最大,为0.89,亲缘关系较近;哥伦比亚和毛樱桃2号以及尤巨和M16之间的遗传相似性系数最小,均为0.54,表明品种间的亲缘关系较远。
2.2.2 聚类分析 [HTSS]在相似系数0.68处做结合线,该线将试验样品分成7个AFLP群(AFLP Groups,简称 AG):AG1含有1个品种,即灰毛叶樱桃;AG2含有3个品种,即大青叶、泰山红樱和泰山干櫻;AG3含有1个品种,即东北红樱; AG4含有5个品种,即多毛樱桃、马哈利×草原樱桃、马哈利实生后代、M16和奥德; AG5含有17个品种,即六倍体(吉塞拉)、B5、六倍体实生、草原樱桃、美丽、SC1、ZY-1、SC6、SC4、早生、SDL-1、聂美人、colt、东塘、短枝樱桃、F8和艾杂; AG6含有1个品种,即毛樱桃2号;AG7中含有其它77个品种。
2.2.3 遗传多样性分析 [HTSS]根据数据矩阵计算不同引物组合的遗传多样性度量指标(表4),进行遗传多样性分析。8对引物检测到样品不同位点的有效等位基因数为1.43~1.57,平均为1.52;基因多样度为0.26~0.32,平均为0.30;Shannon信息指数为0.39~0.48,平均为0.45。
3 讨论与结论
本试验采用FISH-AFLP方法,对105个樱桃种质资源进行多样性分析,选用的8对引物组合共产生1 148条谱带,平均每对引物产生143.5条谱带,其中,多态性谱带1 132条,多态性位点数高达98.61%。该方法得到的谱带数与其它树种FISH-AFLP所获数值相近[19,20],高于普通银染AFLP所获谱带数[17-21]。由此可见,作为一种新型的分子标记,FISH-AFLP技术在樱桃资源的系统分类、亲缘关系鉴定、品种鉴别、亲本选择等方面具有潜在的应用前景。本试验确立的FISH-AFLP体系、筛选的引物组合及所得亲缘关系和遗传多样性等数据均可为后续相关研究提供参考,对其它物种的AFLP研究也有一定的参考价值。
本研究通过聚类分析发现,苏1号、泰山红日和泰山朝阳樱桃品种聚在一亚类,体现了它们较近的亲缘关系,说明具有相同的遗传背景。这与三者是从那翁为母本、大紫为父本杂交产生的实生群体中选育出的优良品种的事实相符合。另外,吉塞拉6号和吉塞拉7号是灰毛叶樱桃和酸樱桃杂交育成的优良樱桃砧木,具有矮化、抗性强、嫁接亲和性好等特点。Y1是从吉塞拉6号自然受粉获得的种子后代中筛选出的四倍体新种质,Y1和吉塞拉6号亲缘关系较近,优先聚在一起,然后再与吉塞拉7号聚集。
评价群体遗传多样性水平的重要指标包括有效等位基因数(Ne)、基因多样度(H)和Shannon指数(I)。本研究得到的遗传多样性参数为Ne=1.52,H=0.30,I=0.45。本试验对樱桃主栽品种进行研究,其遗传相似系数为0.54~0.89,平均为0.72。由于研究样品中既有欧洲引进的甜樱桃(Prunus avium L.)品种,又有酸樱桃(P. cerasus L.)、中国樱桃(P. pseudocerasus LindI.)、杂交品种和野生樱桃属植物,所处环境和地域较广,而樱桃的种植年限长,遗传背景丰富,因此遗传相似系数阈值范围比较大。
参 考 文 献:
[1]陈晓流, 陈学森, 束怀瑞, 等. 15个樱桃品种的RAPD分析[J]. 果树学报, 2004, 21(6): 556-559.
[2]王彩虹, 田义轲, 赵静, 等. 樱桃品种资源间遗传差异的RAPD分析[J]. 西北植物学报, 2005, 25(12):2431-2435.
[3]蔡宇良, 曹东伟, 李珊, 等. 甜樱桃品种及其砧木的RAPD分析[J]. 西北植物学报, 2006, 26 (6):1125-1132.
[4]黄晓姣. 基于SSR标记的中国樱桃栽培资源的遗传多样性及群体遗传结构研究[D]. 雅安:四川农业大学,2013.
[5]Wünsch A, Hormaza J I. Molecular evaluation of genetic diversity and S-allele composition of local Spanish sweet cherry (Prunus avium L.) cultivars[J]. Genetic Resources and Crop Evolution, 2004, 51: 635-641.
[6]Turkec A, Sayar M, Heinze B. Identification of sweet cherry cultivars(Prunus avium L.) and analysis of their genetic relationships by chloroplast sequence-characterised amplifed regions (cpSCAR) [J]. Genetic Resources and Crop Evolution, 2006, 53(8): 1635-1641.
[7]Vos P, Hogers R, Bleeker M, et al. AFLP: a new technique for DNA fingerprinting[J]. Nucleic. Acids Res.,1995, 23(21):4407-4414.
[8]王斌,翁曼麗. AFLP的原理及其应用[J]. 杂交水稻, 1996(5):27-30.
[9]田清震.中国野生大豆与栽培大豆AFLP指纹技术分析及生态群体遗传关系研究[D]. 南京:南京农业大学, 2000.
[10]Chen H L, Mehlenbacher S A, Smith D. AFLP markers linked to eastern filbert blight resistance from OSU 408.040 hazelnut[J]. Journal of the American Society for Horticultural Science, 2005, 130(3) : 412-417.
[11]Ferrari M, Mugnozza G, Monnanni R, et al. DNA fingerprinting of Corylus avellana accessions revealed by AFLP molecular markers[J]. Acta Horticulturae,2005(686): 125-134.
[12]Kafkas S, zgen M, Dog Y, et al. Molecular characterization of mulberry accessions in Turkey by AFLP markers[J]. Journal of the American Society for Horticultural Science, 2008, 133(4): 593-597.
[13]Kafkas S, Erci瘙塂li S,Dogan Y, et al. Polymorphism and genetic relationships among tea genotypes from Turkey revealed by amplified fragment length polymorphism markers[J]. Journal of the American Society for Horticultural Science, 2009, 134(4):428-434.
[14]李凤霞,王卫锋,王鲁,等. 烟草属植物遗传多样性和亲缘进化关系的荧光AFLP分析[J]. 中国农业科学, 2010, 43(12):2418-2427.
[15]Ma Q G, Zhang J P, Pei D. Genetic analysis of walnut cultivars in China using fluorescent amplified fragment length polymorphism[J].Journal of the American Society for Horticultural Science, 2011, 136(6):422-428.
[16]马庆华,陈新,赵天田,等. 应用FISH-AFLP技术分析平欧杂种榛主栽品种的遗传关系[J]. 中国农业科学,2013, 46(23):5003-5011.
[17]王红霞,赵书岗,高仪,等. 普通核桃遗传多样性的AFLP分析[J]. 中国农业科学,2011, 44 (7):1434-1442.
[18]陈新. 榛子花芽转录组文库的Solexa测序及冷调节基因的表达谱分析[D]. 北京:中国林业科学研究院,2011.
[19]Wang L, Xing S Y, Yang K Q, et al. Genetic relationships of Ornamental cultivars of Ginkgo biloba analyzed by AFLP techniques [J]. Acta Genetica Sinica, 2006, 33 (11): 1020-1026.
[20]宁德鲁,马庆国,张雨,等. 云南省核桃品种遗传多样性的FISH-AFLP分析[J]. 林业科学研究,2011, 24(2):189-193.
[21]刘卫国,易干军,刘岩,等. 菠萝种质鉴定及亲缘关系的AFLP分析[J]. 果树学报,2008,25(4): 516-520.
收稿日期:2019-06-10
基金项目:山东省农业科学院青年科研基金项目(2016YQN25);山东省现代农业产业技术体系果品创新团队项目(SDAIT-06-04) ;科技部科技基础平台项目(NICGR2018-048)
作者简介:陈新(1980—),男,博士,副研究员,主要从事果树种质资源与分子生物学研究。E-mail: sdaucx@163.com
通讯作者:刘庆忠(1963—),男,博士,研究员,研究方向:果树种质资源与生物技术育种。E-mail: qzliu001@126.com
徐丽(1983—),女,博士,助理研究员,主要从事果树种质资源和分子生物学研究。E-mail: xuli1245@ 163.com
