小麦叶片离体培养体系的建立和优化
2019-12-24李光艳吴斌张眉王升吉竺晓平杜振翠辛相启姜珊珊
李光艳 吴斌 张眉 王升吉 竺晓平 杜振翠 辛相启 姜珊珊

摘要:以济麦22和临麦4号小麦叶片为材料进行离体培养试验,通过添加1/2MS、霍格兰营养液(Hoagland)、6-苄氨基腺嘌呤(6-benzylaminopurine,6-BA)分析不同培养条件下小麦离体叶片叶绿素及植物总蛋白的变化,建立适用于两个品种的离体培养体系。结果表明,筛选的培养体系中1/2MS液体培养基最适用于济麦22和临麦4号,叶片离体培养10 d内可保持生理活性稳定;霍格兰营养液仅适用于临麦4号;1/2MS液体培养基添加6-BA后叶片SPAD值及总蛋白含量增加,浓度25 mg/L时效果最佳,离体培养14 d叶片仍可保持良好的生理活性。本研究建立了适用于济麦22和临麦4号的叶片离体培养体系,为进一步开展小麦抗病性研究提供一定的科学依据。
关键词:小麦;离体叶片;1/2MS;6-BA;SPAD
中图分类号:S512.103.53文献标识号:A文章编号:1001-4942(2019)11-0013-05
Establishment and Optimization of Culture
Conditions of Detached Wheat Leaves
Li Guangyan1,2, Wu Bin1, Zhang Mei1, Wang Shengji1,
Zhu Xiaopin2, Du Zhencui3, Xin Xiangqi1, Jiang Shanshan1
(1. Institute of Plant Protection, Shandong Academy of Agricultural Sciences/Shandong
Key Laboratory of Plant Virology, Jinan 250100,China;
2. College of Plant Protection, Shandong Agricultural University, Taian 271018, China;
3. Junan Plant Protection Station, Junan 276600, China)
Abstract Experiments on detached leaves of Jimai 22 and Linmai 4 were carried out. The effects of different culture conditions by adding 1/2MS, Hoagland and 6-BA on the changes of chlorophyll and total protein of detached wheat leaves were studied, and the culture conditions suitable for Jimai 22 and Linmai 4 were established. The results indicated that 1/2MS liquid medium was most suitable for Jimai 22 and Linmai 4 among all the selected culture conditions, and the physiological activity remained stable within 10 days. Hoagland nutrient solution was only suitable for Linmai 4. SPAD value and total protein content of detached leaves in 1/2MS liquid medium increased after adding 6-BA at the optimum concentration of 25 mg/L, and the leaves cultured in vitro for 14 days still maintained better physiological activity. This study established culture conditions suitable for Jimai 22 and Linmai 4 and could provide scientific references for further research on wheat disease resistance.
Keywords Wheat; Detached leaves; 1/2MS; 6-BA; SPAD
生物界中很多植物病原菌都是活體营养的专性寄生菌,只能在活体上侵染繁殖,建立离体叶片培养体系可加速植物抗病虫害研究。利用离体叶片可突破季节、温度、湿度等环境因素的限制,具有快速高效、准确可靠等优势,已在水稻、西瓜、甜瓜等农作物品种抗性鉴定中广泛应用[1-3]。
叶片离体后依靠呼吸作用维持正常生命活动,若无外源营养物质输送,细胞活性会逐渐降低,叶片黄化,光合能力下降,叶绿素、蛋白质等逐渐降解,直至衰老死亡[1,4,5]。因此,如何维持叶片生理活性、延缓衰老是建立离体培养体系的重点之一。叶绿素和可溶性蛋白含量等常作为叶片衰老的监测指标。氮素作为植物生长发育最重要的营养物质之一,也是叶绿素合成途径的重要影响因子[6],提供外源氮素可减缓离体叶片衰老。6-苄氨基腺嘌呤(6-benzylaminopurine,6-BA)是一种人工合成的细胞分裂素,可通过刺激细胞分裂引发植物生长和发育,并可改善叶片光系统性能,提高光合性能,使衰老过程中的叶片维持较高的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性,减少丙二醛(MDA)积累,从而显著降低膜脂过氧化过程,阻止自由基的形成,进而延缓植物衰老[7]。研究表明,用6-BA处理小麦幼苗后,叶片叶绿素a、b及总量均明显增加,降解速度减缓[8,9];利用6-BA处理马铃薯扦插苗可促进叶片生长,提高叶绿素含量[10]。
小麦是我国主要的粮食作物之一,病原菌种类繁多,白粉病、锈病、病毒病等常年发生。建立有效的小麦叶片离体培养体系,可为小麦抗病研究提供便利[11,12]。本研究通过测定不同离体培养条件下济麦22和临麦4号叶片的SPAD值和植物总蛋白含量,分别筛选出适用于济麦22和临麦4号小麦叶片的离体培养体系,以期为后续开展小麦抗病性研究等提供数据支持。
1 材料与方法
1.1 供试材料
供试小麦品种为济麦22和临麦4号。挑取大小均一的小麦种子,去离子水浸泡催芽,露白后均匀播种到培养钵中,置光照培養箱中培养,培养条件为24℃、16 h光照/8 h黑暗;待长到2~3叶期时,取同叶位大小一致的叶片进行试验。
1.2 主要试剂
6-苄氨基腺嘌呤(6-BA)、琼脂粉(agar)购自生工生物工程(上海)股份有限公司; 植物凝胶(phytagel)购自Sigma公司;MS培养基、霍格兰营养液购自青岛日水生物技术有限公司。
1.3 试验方法
1.3.1 叶片离体培养条件设置 共设置5个处理,分别为1/2MS液体培养基(1/2MS)、添加1.5 g/L 琼脂的1/2MS固体培养基(1/2MS+A)、添加3.0 g/L 植物凝胶的1/2MS固体培养基(1/2MS+P)、霍格兰营养液(Hoagland)和H2O。取完全展开的小麦叶片从叶基部剪下,用酒精棉球将叶基部进行表面消毒,然后置入培养基并于光照培养箱中培养。每处理设置10次重复,每两天更换一次培养基。
1.3.2 6-BA浓度筛选 配制100 mg/L 6-BA储存液,按照0.25、2.50、25.00、50.00 mg/L的工作浓度分别加入1/2MS液体培养基中,以不加6-BA的1/2MS液体培养基作为空白对照。小麦叶片处理同上,每处理设置10次重复,每两天更换一次培养基。
1.3.3 小麦SPAD值测定 利用SPAD 502叶绿素含量测定仪(日本柯尼卡)测试小麦叶片的SPAD值,在叶片中部进行测试,每两天测一次,每片叶重复测3遍。
1.3.4 植物总蛋白检测 称取植物样品0.1 g,经液氮速冻研磨后加入蛋白质提取液(100 mmol/L Tris-HCl、6% SDS、2% β-mercaptoethanol)提取植物总蛋白。配制12% SDS-PAGE胶,蛋白样品经电泳后用考马斯亮蓝G-250染色液染色1 h,脱色至蛋白条带清晰后用凝胶成像系统进行拍照及分析。
1.4 数据分析
采用Microsoft Excel、GraphPad Prism 8和Photoshop 7.0软件进行数据分析及图片处理。
2 结果与分析
2.1 济麦22叶片离体培养条件筛选
对不同培养条件下济麦22离体叶片进行SPAD值和总蛋白检测,结果(图1A)显示,离体培养前2 d各培养条件下济麦22叶片SPAD值相差不大,都只有小幅度降低;2 d后,1/2MS+A处理开始明显下降;4 d后,1/2MS+P、H2O处理快速降低,Hoagland处理也开始缓慢降低;6 d后Hoagland营养液和H2O中的叶片SPAD值下降幅度较大。1/2MS液体培养基中叶片SPAD值比较稳定,6 d后出现小幅度下降。第10 d取样进行植物总蛋白检测,凝胶结果(图1B)显示,1/2MS液体培养基处理叶片总蛋白量最高,其次是1/2MS固体培养基和Hoagland营养液,H2O中培养的叶片蛋白总量最少。综上表明,1/2MS液体培养基最适于济麦22叶片离体培养。
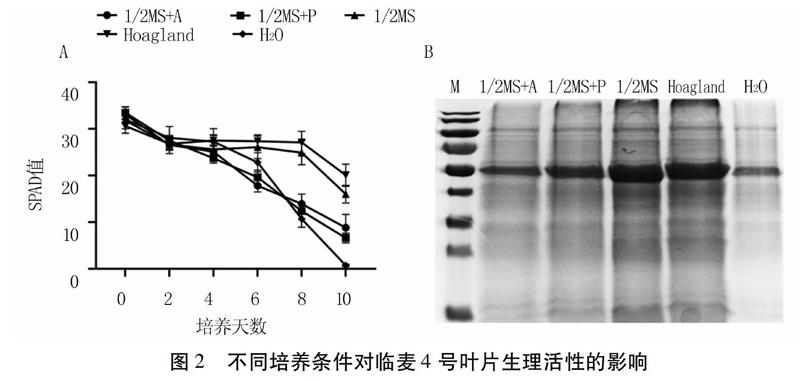
2.2 临麦4号叶片离体培养条件筛选
对不同培养条件下临麦4号离体叶片进行SPAD值和总蛋白检测,结果如图2显示。叶片SPAD值整体均呈降低趋势,前4 d降幅较小,4 d后,1/2MS固体培养基和H2O中叶片SPAD值降幅较大;1/2MS液体培养基和Hoagland营养液中叶片SPAD值变化比较平稳,8 d后开始出现明显降低。第10 d,1/2MS液体培养基和Hoagland营养液中叶片蛋白含量最高,其次为1/2MS固体培养基,H2O处理的叶片蛋白含量较低。综上表明,1/2MS液体培养基和Hoagland营养液适于临麦4号叶片离体培养。
2.3 6-BA对小麦离体叶片生理活性的影响
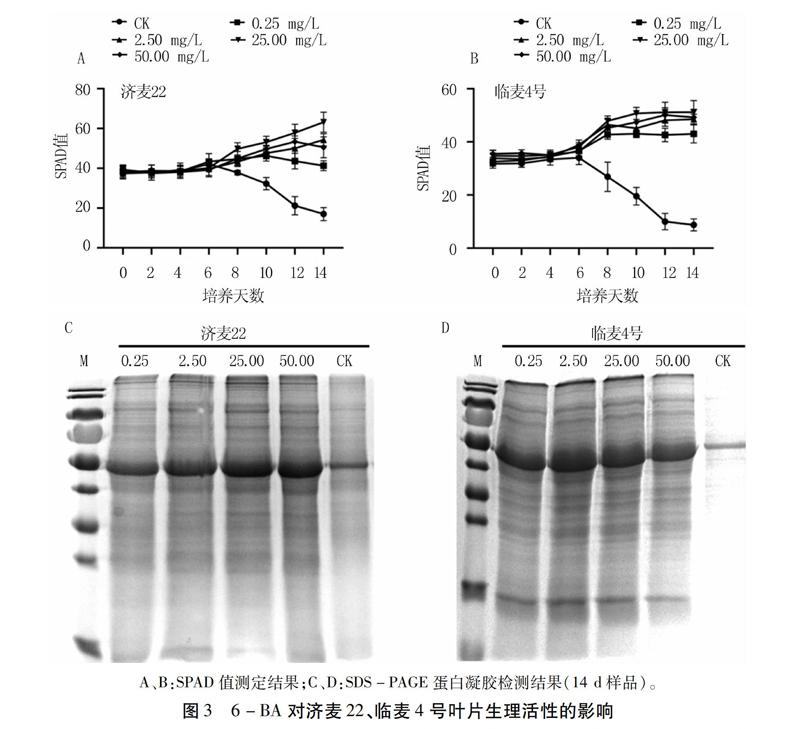
为了研究6-BA是否利于小麦叶片离体培养,设置4个浓度6-BA并分别加入1/2MS液体培养基中。结果(图3)显示,济麦22和临麦4号的离体叶片SPAD值,在所有处理的前6 d均保持稳定;6 d后添加6-BA处理的叶片SPAD值逐渐上升,而对照叶片的SPAD值逐渐下降。不同6-BA浓度处理的叶片SPAD值差异不显著,25.00 mg/L和50.00 mg/L处理的SPAD值相对较高。植物总蛋白检测结果与SPAD检测结果一致,添加6-BA处理的叶片总蛋白含量明显高于对照,均以25.00 mg/L和50.00 mg/L处理的含量较高。表明,1/2MS培养基中添加6-BA有利于济麦22和临麦4号叶片离体培养,其中25.00 mg/L添加浓度效果最优。
3 讨论与结论
离体叶片广泛应用于农作物抗性鉴定、病原菌分离等,维持叶片生理活性是离体叶片鉴定体系有效利用的关键。本研究分别选用1/2MS液体、固体培养基及Hoagland营养液为离体叶片提供外源营养元素,同时选用外源激素6-BA增强叶片生长,由此建立与优化了分别适用于济麦22和临麦4号的离体叶片培养体系。
MS培养基是目前使用最普遍的培养基,具有平衡的离子浓度,能满足植物细胞的营养和生理需要。Hoagland营养液是无土栽培常用营养液,富含作物生长发育必需的13种元素[13]。本研究选用1/2MS培养基和Hoagland营养液建立小麦叶片的培养体系,结果显示,济麦22和临麦4号的叶片皆可在1/2MS液体培养基中维持生理活性达10 d,表明其适用于小麦叶片的离体培养。小麦叶片在清水中培养4 d后黄化明显,SPAD值快速降低,第10 d时叶片细胞几乎全部坏死。小麦叶片在1/2MS固体培养基中的生长状态与在清水中相似,推测叶片可能无法有效地从固体培养基中吸收营养成分,导致细胞逐渐衰老。
临麦4号叶片在1/2MS液体培养基和Hoagland营养液中的生长状态较为一致,皆可维持稳定的叶绿素及蛋白含量;而济麦22叶片在Hoagland营养液中培养6 d后迅速衰老,这种现象可能是由两个品种的营养需求不同导致的。
在高等植物中,细胞分裂素通过控制细胞分裂和分化而广泛参与植物生长发育的调控,包括胚胎发育、根和芽的分化、维管束的形成、叶绿体成熟、顶端优势、光信号转导以及延缓衰老等[7]。研究表明,细胞分裂素通过促进功能叶叶绿体的发育提高叶面积、CO2同化速率、气孔导度和Rubisco酶活性来提高植物的光合能力[8]。6-BA处理能够维持叶绿体和基粒的结构及形态稳定,延缓叶绿素降解[5]。本研究结果显示,添加6-BA培养6 d后,叶片SPAD值逐渐上升,第14 d植物总蛋白检测结果也显示添加6-BA的叶片生长状态良好,均以25.00 mg/L 6-BA有利于小麦叶片的生长,可应用于小麦叶片离体培养。
本研究针对济麦22和临麦4号两个品种分别建立了其离体叶片培养体系,结果表明1/2MS液体培养基添加25.00 mg/L 6-BA更适于济麦22离体叶片培养,1/2MS液体培养基和Hoagland营养液分别添加25.00 mg/L 6-BA均适宜于临麦4号离体叶片培养,在此条件下,叶片离体状态下的正常生理活性均达14 d以上,可高效应用于植物抗病、病原菌分离鉴定等多方面的研究工作中。本研究结果为外源营养元素和激素在植物生长发育中的进一步应用提供了科学依据。
参 考 文 献:
[1]李海青, 张玲, 杨国涛, 等. 水稻叶片离体保鲜技术探索[J]. 湖北农业科学, 2011, 50(3): 468-471.
[2]孙玉燕, 范敏, 何艳军. 西瓜炭疽病菌离体叶片接种鉴定技术[J]. 浙江农业科学, 2019,60(8):1460-1462,1465.
[3]任琴琴, 鲁秀梅, 柯思佳, 等. 分子标记辅助离体叶片接种鉴定甜瓜蔓枯病极端抗感单株[J]. 中国瓜菜,2019,32(5):13-16.
[4]Liu P, Zhang S B,Zhou B,et al. The histone H3K4 demethylase JMJ16 represses leaf senescence in Arabidopsis [J]. Plant Cell,2019,31(2):430-443.
[5]杨东清, 王振林, 尹燕枰, 等. 外源ABA和6-BA对不同持绿型小麦旗叶衰老的影响及其生理机制[J].作物学报, 2013,39(6):1096-1104.
[6]Wen B B, Li C H, Fu X L, et al. Effects of nitrate deficiency on nitrate assimilation and chlorophyll synthesis of detached apple leaves[J]. Plant Physiology and Biochemistry,2019,142:363-371.
[7]张艳军, 赵江哲, 张可伟. 植物激素在叶片衰老中的作用机制研究进展[J]. 植物生理学报,2014,50(9):1305-1309.
[8]杨东清, 董文华, 骆永丽, 等. 外源6-BA对两种氮素水平下小麦幼苗叶片光合性能及内源激素含量的影响[J]. 中国农业科学, 2017,50(20):3871-3884.
[9]杨雪, 彭静, 张明明, 等. 叶面喷施6-BA对玉米生殖期碳水化合物转运和分配的影响[J]. 西北农林科技大学学报(自然科学版),2019,47(7):62-70.
[10]张晓勇, 杨友联, 李树江, 等. 外源激素对低温胁迫下脱毒马铃薯扦插苗早衰的影响[J]. 作物杂志,2018(4):95-101.
[11]郑丹, 左淑霞, 杜志敏, 等. 小麦条锈菌转主寄主小檗的离体叶片接种培养鉴定[J]. 植物病理学报,2018,48(5):707-710.
[12]张志刚, 杨自文, 王开梅, 等. 小麦白粉病离体叶片法生物测定技术研究[J]. 湖北农业科学, 2012,51(24):5643-5645.
[13]魏嘉禾, 陈斌. 2种养分水平条件下大麦幼苗对重金属铜胁迫的生长响应[J]. 安徽农业大学学报,2019,46(3):535-540.
收稿日期:2019-09-27
基金項目:国家自然科学基金项目(31701762);国家重点研发计划项目(2017YFD0201700);山东省农业科学院农业科技创新工程项目(CXGC2018E04,CXGC2016B11)
作者简介:李光艳(1995—),女,在读硕士研究生,研究方向:植物病毒病害研究。E-mail: lihayy616@163.com
通讯作者:姜珊珊(1987—),女,山东聊城人,博士,主要从事植物病毒与寄主互作研究。E-mail:shanshan2113@163.com
辛相启(1965—),男,山东安丘人,研究员,主要从事植物病害防控技术研究。E-mail:xinxiangqi@126.com
