加速溶剂萃取-GC/MS法测定土壤中多环芳烃
2019-12-24仇秀梅董学林何海洋
仇秀梅, 董学林, 宋 洲,何海洋,杨 杰, 刘 田
(湖北省地质实验测试中心,湖北 武汉 430034)
经济快速发展过程中所面临的大气、水和土壤等环境污染问题日益突出,中国先后制定了《大气污染防治行动计划》、《水污染防治行动计划》和《土壤污染防治行动计划》。与早已开展的大气和水污染治理相比,中国土壤污染治理工作相对滞后。2016年5月28日国务院印发了《土壤污染防治行动计划》,简称“土十条”,揭开了土壤污染防治的序幕,随后将多环芳烃(PAHs)作为重点项目列入详查计划[1]。PAHs是一系列芳香烃化合物及其衍生物,存在明显的致突变、致癌、致畸等作用,美国环保署将其中16种列为优先控制污染物[2-3]。在任何有机物使用、加工、燃烧的地方都可能产生PAHs。PAHs难于降解且易于在生物体内积累,所以在自然环境中广泛存在,特别是经过污水、降水、降尘等途径进入土壤生态系统,受到严重污染的土壤会导致某些种类的PAHs在粮食中积累,并通过食物链危害人类健康。由于土壤结构和其性质较复杂,且土壤PAHs浓度较低、部分组分不稳定、检测难度较大。因此,建立准确、可靠的土壤中多环芳烃的测试方法十分必要。
常见的土壤中PAHs前处理方法有索氏提取、加速溶剂萃取(ASE)等。索氏提取耗费溶剂多、提取时间长,对实验人员健康危害较大[4]。加速溶剂萃取是一种在较高的温度和较大的压力下用溶剂萃取固体或半固体的样品前处理方法,具有有机溶剂用量少、萃取速度快、样品回收率高等优点,已被广泛应用于土壤样品的前处理[5-6]。
土壤中PAHs的检测一般使用液相色谱法[7]、气相色谱法[8]、荧光法[9]、气质联用法[10-12]等,其中以液相色谱法、气质联用法较为常用。与液相色谱法相比,气质联用法可以提供足够的化合物定性分析,结果准确可靠,检测灵敏度高。本文拟通过前处理条件优化,采用加速溶剂萃取联合气相色谱/质谱法(GC/MS)测定土壤中15种PAHs。
1 材料与方法
1.1 仪器和试剂
加速溶剂萃取仪(ASE 350型),配22 mL萃取池;Agilent 7890B GC-5977A MSD型气相色谱—质谱联用仪(美国安捷伦公司),带自动进样器;色谱柱为DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm);正己烷、二氯甲烷、丙酮,均为农残级;硅藻土、石英砂,600 ℃加热4 h;弗罗里硅土净化柱,市售,1 g/6 mL。
PAHs标准储备液:浓度1 000 mg/L,二氯甲烷 ∶苯(1∶1)混合溶剂,含荧蒽、苯并(a)蒽、、苯并(b)荧蒽、苯并(k)荧蒽、苯并(a)芘、二苯并(a,h)蒽、苯并(g,h,i)苝、萘、苊、芴、菲、蒽、茚并(1,2,3-cd)芘、芘、二氢苊。
内标储备液:浓度2 000 mg/L,二氯甲烷溶剂,含萘-d8、苊-d10、菲-d10、-d12、苝-d12。
1.2 样品前处理方法
1.2.1加速溶剂萃取法
准确称取10.0 g土壤样品放入研钵中,加入适量硅藻土,研磨均匀,装入22 mL的萃取池中。萃取溶剂为丙酮和正己烷(v∶v,1∶1)的混合溶剂,提取温度110 ℃,压强10 MPa,加热6 min,静态提取7 min,循环3次,吹扫体积60%,吹扫时间90 s,提取液用无水硫酸钠除水后,氮吹浓缩至1.0 mL。萃取条件优化见2.1.1和2.1.2。
1.2.2样品净化
用弗罗里硅土净化柱净化样品,依次用4 mL二氯甲烷、10 mL正己烷活化小柱,平衡5 min后上样,用15 mL正己烷—二氯甲烷溶液(v∶v,7∶3)作为淋洗液进行淋洗,收集淋出液。条件优化见2.1.3。
1.2.3样品浓缩
收集的淋出液转移至氮吹管中,40 ℃氮吹至0.5 mL。用少量正己烷冲洗管壁,加至氮吹管的2~3 mL处。继续氮吹至小体积后,再用正己烷冲洗管壁,如此重复3次。加入50 μL的4.0 mg/L内标溶液,并用正己烷—丙酮(1∶1)定容至1.0 mL。
1.3 GC/MS条件
(1) 进样口温度为280 ℃;进样方式:不分流进样;
(2) 程序升温:柱箱初始温度80 ℃保持2 min,以20 ℃/min升温速率升至180 ℃,保持5 min后,以10 ℃/min升温速率升至290 ℃,保持5 min;
(3) 载气为氦气;流量为1.0 mL/min;进样量:1.0 μL;
(4) 离子源:EI源;离子源温度:280 ℃;离子化能量:70 eV;扫描方式:SIM;溶剂延迟:5.0 min。
2 结果与分析
2.1 前处理条件的优化
加速溶剂萃取的原理是在高温条件下,溶剂穿透力强且表面张力下降,使得土壤中的有机物容易从基体解吸进入溶剂;压力上升,使溶剂保持液态,用少量溶剂可快速提取固体样品中的目标物。萃取溶剂、萃取温度是加速溶剂萃取的关键因素,必须进行前处理条件优化。
2.1.1萃取溶剂的优化
为考察不同溶剂对土壤中15种多环芳烃的提取效率,分别采用丙酮 ∶二氯甲烷(v∶v,1∶1)、正己烷 ∶二氯甲烷(v∶v,1∶1)和正己烷 ∶丙酮(v∶v,1∶1)对土壤中多环芳烃标准物质(CDGK-SQCI-017)进行提取实验,结果如图1所示。三种萃取溶剂对15种多环芳烃的提取效果差别明显,提取效率为:正己烷 ∶丙酮(1∶1)>正己烷 ∶二氯甲烷(1∶1)>丙酮 ∶二氯甲烷(1∶1)。
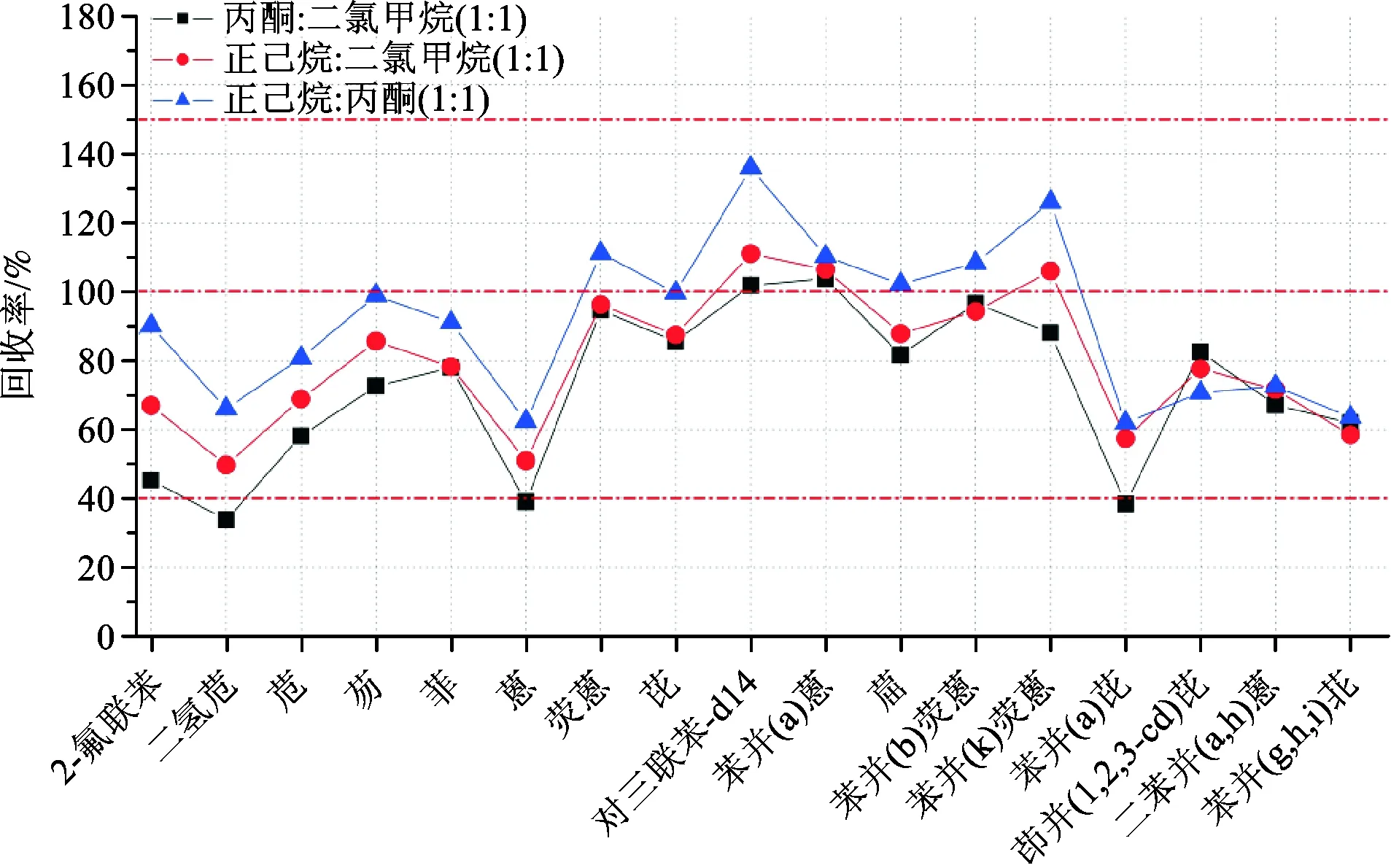
图1 不同萃取溶剂对PAHs提取效果的影响Fig.1 The effect of different extraction solvents on extraction effects of PAHs
2.1.2萃取温度的优化
提高萃取温度可以破坏溶剂与基质间由于范德华力、氢键等引起的强吸引力,减少溶剂的粘性和表面张力,从而使得溶剂能更好地渗透到基质中,快速、有效地萃取基质中的目标物;而温度过高时提取溶剂易损失,高压也会造成组分分解,因此萃取温度是目标物提取效率的重要影响因素。以正己烷∶丙酮(1∶1)为萃取溶剂,分别在100 ℃、110 ℃、120 ℃条件下对土壤多环芳烃标准物质(CDGK-SQCI-017)进行萃取实验,结果表明大部分PAHs化合物在温度为110 ℃时的提取效率最优(图2)。
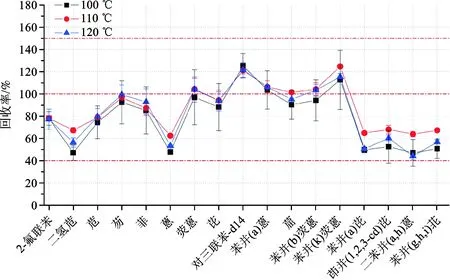
图2 萃取温度对PAHs提取效率的影响Fig.2 The effect of different extraction temperature onextraction effects of PAHs
2.1.3净化条件的优化
土壤样品基质复杂,在上机测试前通常需要经过净化处理。研究采用弗罗里硅土小柱进行固相萃取实现提取液的净化,对所选净化洗脱溶剂以及洗脱体积进行优化。取1 mL浓度为500 μg/L的多环芳烃标准溶液过柱净化,以10 mL正己烷∶二氯甲烷混合溶液(v∶v为1∶1、7∶3、9∶1)为洗脱溶剂进行实验,研究比较洗脱溶剂比例对15种PAHs的洗脱效率的影响,结果如图3所示。
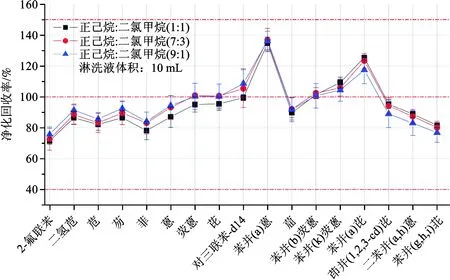
图3 不同比例洗脱溶剂对PAHs洗脱效率的影响Fig.3 The effect of eluting solvent with differentproportion on eluting effect of PAHs
由图3可知,洗脱溶剂中正己烷比例较高时对二氢苊、苊、芴、菲、蒽、荧蒽等低沸点化合物洗脱效果好;二氯甲烷比例较高时对苯并(a)芘、茚并(1,2,3-cd)芘、二苯并(a,h)蒽、苯并(g,h,i)苝等高沸点化合物洗脱效果更佳。综合考虑后选定正己烷∶二氯甲烷(7∶3)净化洗脱溶剂。
从图3可以看出,部分化合物的回收率不高,这可能是因为10 mL淋洗液无法完全洗脱目标化合物。因此对经10 mL淋洗液洗脱后的净化柱补加5 mL淋洗液进行洗脱,测定净化柱的PAHs残留量,结果如图4所示。由图可知,净化柱经3种洗脱溶剂15 mL洗脱后均有残留的目标化合物,特别是正己烷∶二氯甲烷(9∶1)为洗脱溶剂时,苯并(a)芘、茚并(1,2,3-cd)芘、
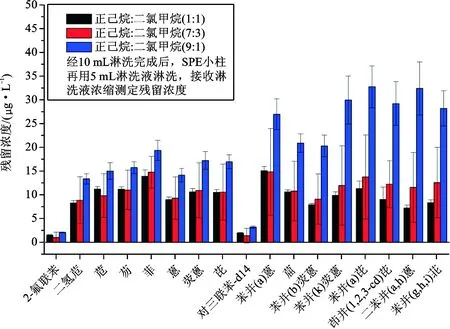
图4 15 mL淋洗液洗脱后PAHs残留量Fig.4 The residue of PAHs after leaching by 15 mL eluting solvent
二苯并(a,h)蒽、苯并(g,h,i)苝等高沸点化合物的残留量较高。经验证,以15 mL正己烷 ∶二氯甲烷(7∶3)为淋洗液时,加标回收率可满足测试要求。
2.1.4萃取方法对比
目前较为常见的土壤前处理方法有加速溶剂萃取法、索氏提取法等。索氏提取法具有回收效率高、仪器简便等优点,但耗费溶剂多、提取时间长,对实验人员危害大。由加速溶剂萃取法与索氏提取法提取土壤中15种多环芳烃的回收率结果(表1)可知,对于土壤中PAHs,以石英砂添加40 μL浓度为1 mg/L的PAHs标液,采用索氏提取法的回收率为61.1%~104%;而加速溶剂萃取法回收率为67.4%~102%。加速溶剂萃取法与索氏提取法的回收率相近,同时具有萃取速度快、溶剂用量少、选择性高等优点,本实验选择加速溶剂萃取法作为前处理方法。
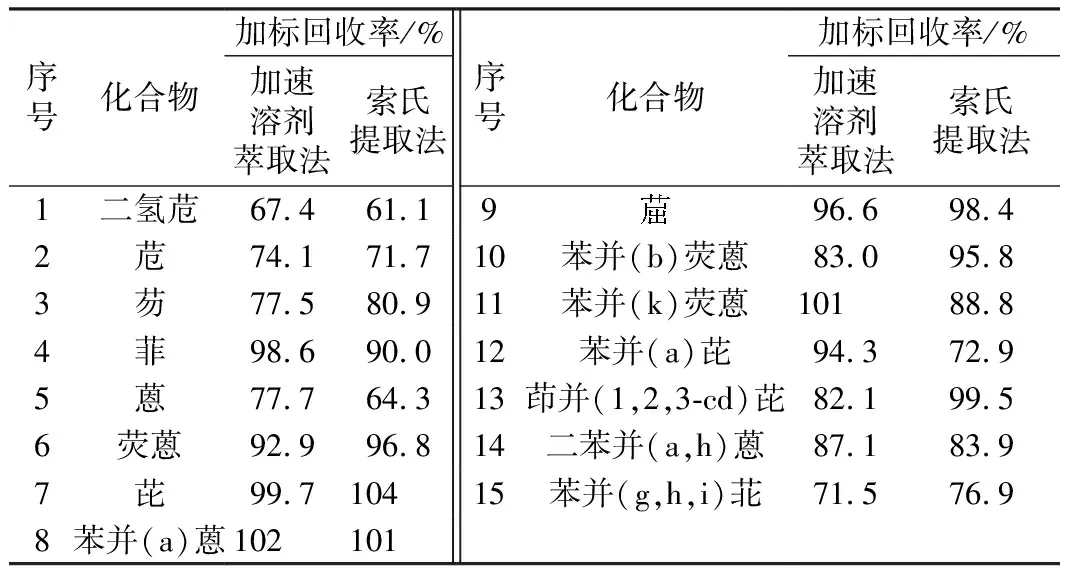
表1 土壤中PAHs的加速溶剂萃取和索氏提取回收率Table 1 The recoveries of PAHs extracted from soil through ASEand soxhlet extraction
2.2 目标化合物的分离效果
实验选定15种PAHs的定量离子、参考离子,见表2。浓度为100 μg/L的PAHs标准溶液中的目标化合物和内标的总离子流图见图5。在实验设定的色谱条件下,目标化合物和内标能得到较好地分离。
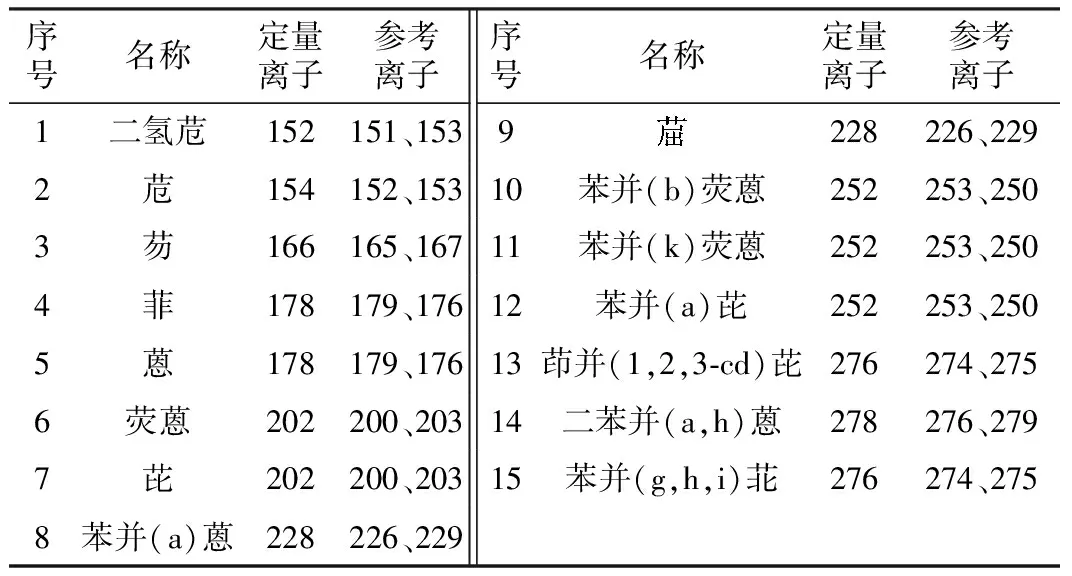
表2 15种多环芳烃化合物的定量离子、参考离子Table 2 Quantitative ion and reference ion of 15 PAHs
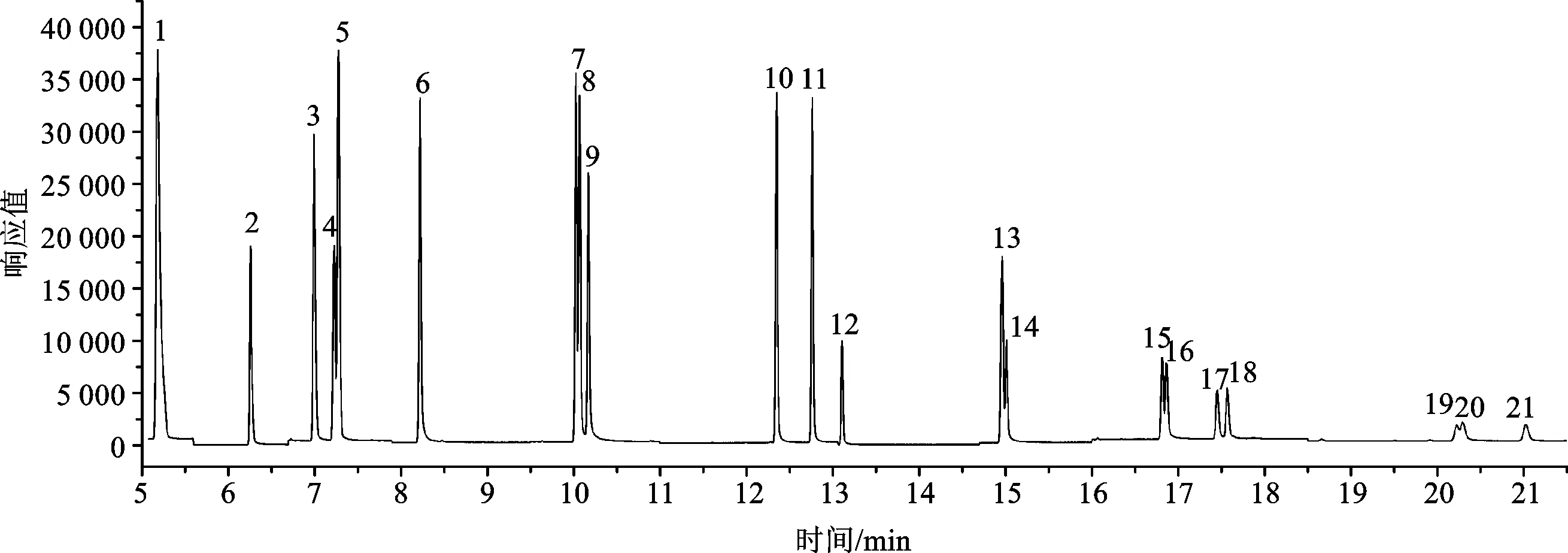
图5 目标化合物和内标物的总离子流图Fig.5 Total ion chromatogram of target compound and internal standard出峰顺序:1.萘-d8(内标物);2.2-氟联苯(替代物);3.二氢苊;4.苊-d10(内标物);5.苊;6.芴;7.菲-d10(内标物);8.菲;9.蒽;10.荧蒽;11.芘;12.对三联苯-d14(替代物);13.苯并[a]蒽;14.-d12(内标物)、;15.苯并[b]荧蒽;16.苯并[k]荧蒽;17.苯并[a]芘;18.苝-d12(内标物);19.茚并[1,2,3-cd]芘;20.二苯并[a,h]蒽;21.苯并[g,h,i]苝。
2.3 目标化合物的定量计算
考虑到气相色谱—质谱联用仪的灵敏度,以及在实际样品检测中的应用情况,配成浓度为5、10、20、50、100、200、500、1 000 μg/L的标准系列,以各组分的峰面积与内标峰面积的比值对质量浓度绘制标准曲线。同时分析低水平空白加标样品,以3倍信噪比的对应浓度作为方法的检出限。由表3结果可见,在5~1 000 μg/L质量浓度范围内,15种目标化合物、8个浓度水平的响应值与浓度的线性关系良好,线性拟合相关系数均>0.995,可用于化合物的定量。15种目标化合物的最低检出限为0.12~0.37 μg/kg,测定下限为0.48~1.48 μg/kg,均满足土壤样品中PAHs的测试要求(HJ 805—2016)。
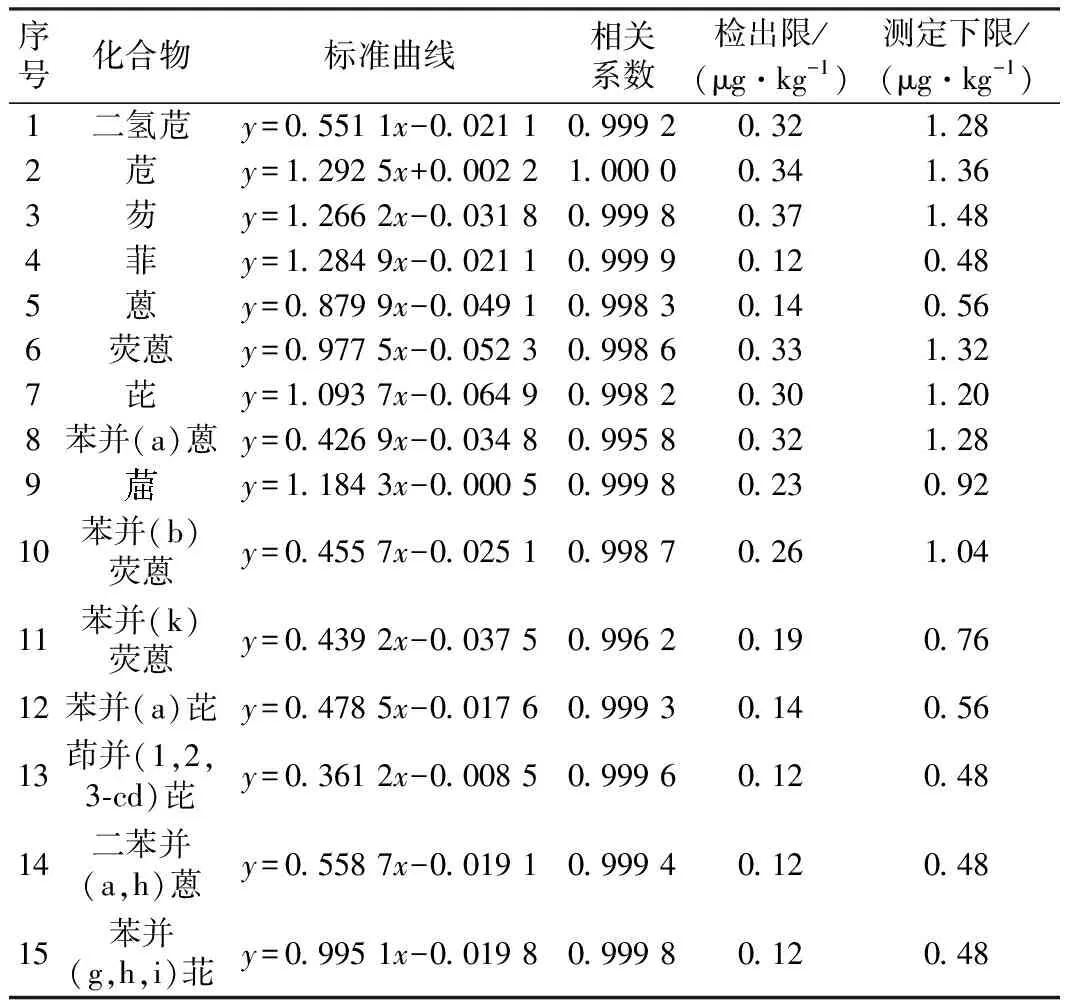
表3 目标化合物的平均相对响应因子与检出限(n=7)Table 3 Average relative response factor and detection limit oftarget compound (n=7)
2.4 方法的回收率和精密度
使用石英砂替代土壤样品,在相同的实验条件下进行全流程空白实验,多环芳烃各组分均未检出。对石英砂中分别添加不同含量水平的15种多环芳烃的加标样品进行回收率实验,平行实验7次,使用加速溶剂萃取—气相色谱/质谱法分析,结果表明(表4):方法的空白加标回收率在61.0%~134%范围内,色谱图中也没有其他干扰峰,说明实验过程没有引入干扰成分,可满足多环芳烃残留分析要求。
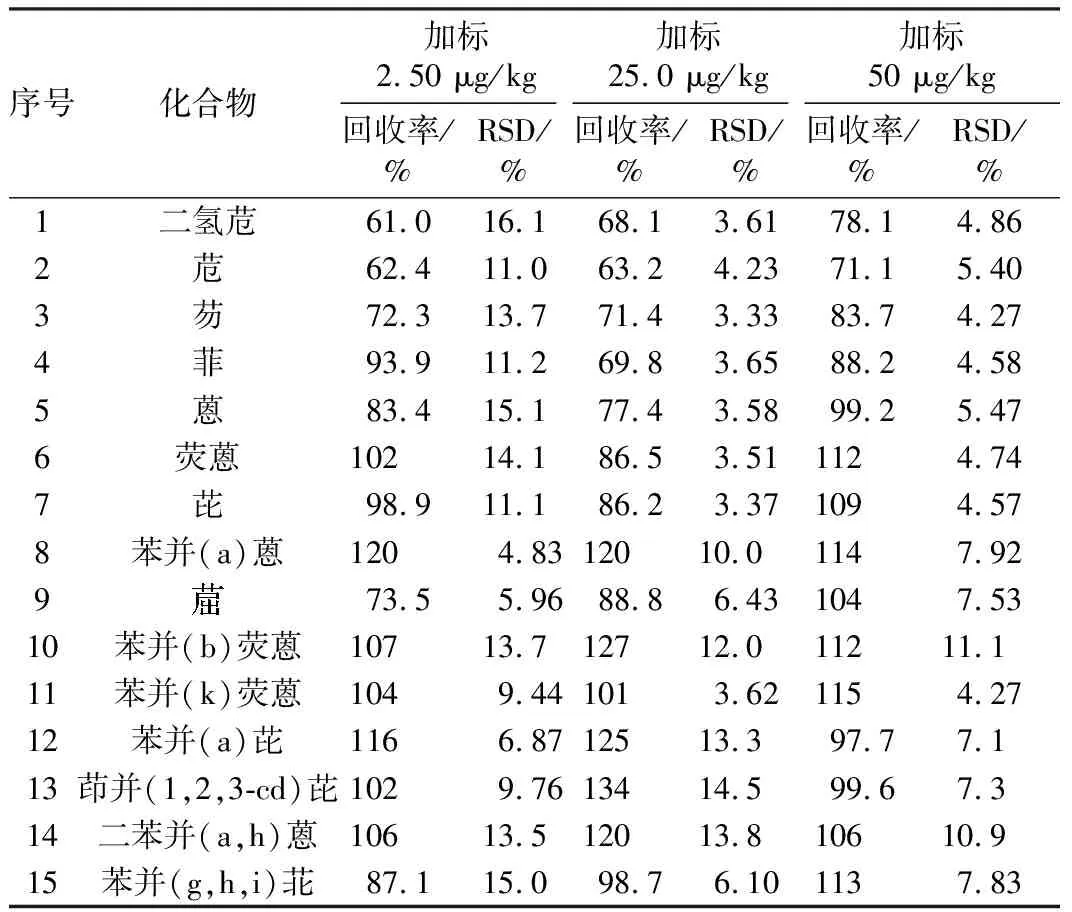
表4 多环芳烃的加标回收率、相对标准偏差(RSD)Table 4 The recovery percentage of standard samples andrelative standard deviations of PAHs(RSD)
2.5在土壤样品分析中的应用
为进一步考察本方法对土壤样品测定的适用性,将实验建立的加速溶剂萃取联合GC/MS方法应用于实际农田土壤中PAHs的测定,并进行了基体加标回收实验,加标浓度20.0 μg/kg,结果见表5。农田土壤样品的加标回收率在43.1%~131%范围内,表明该方法适用于实际土壤样品中15种PAHs的准确测定。
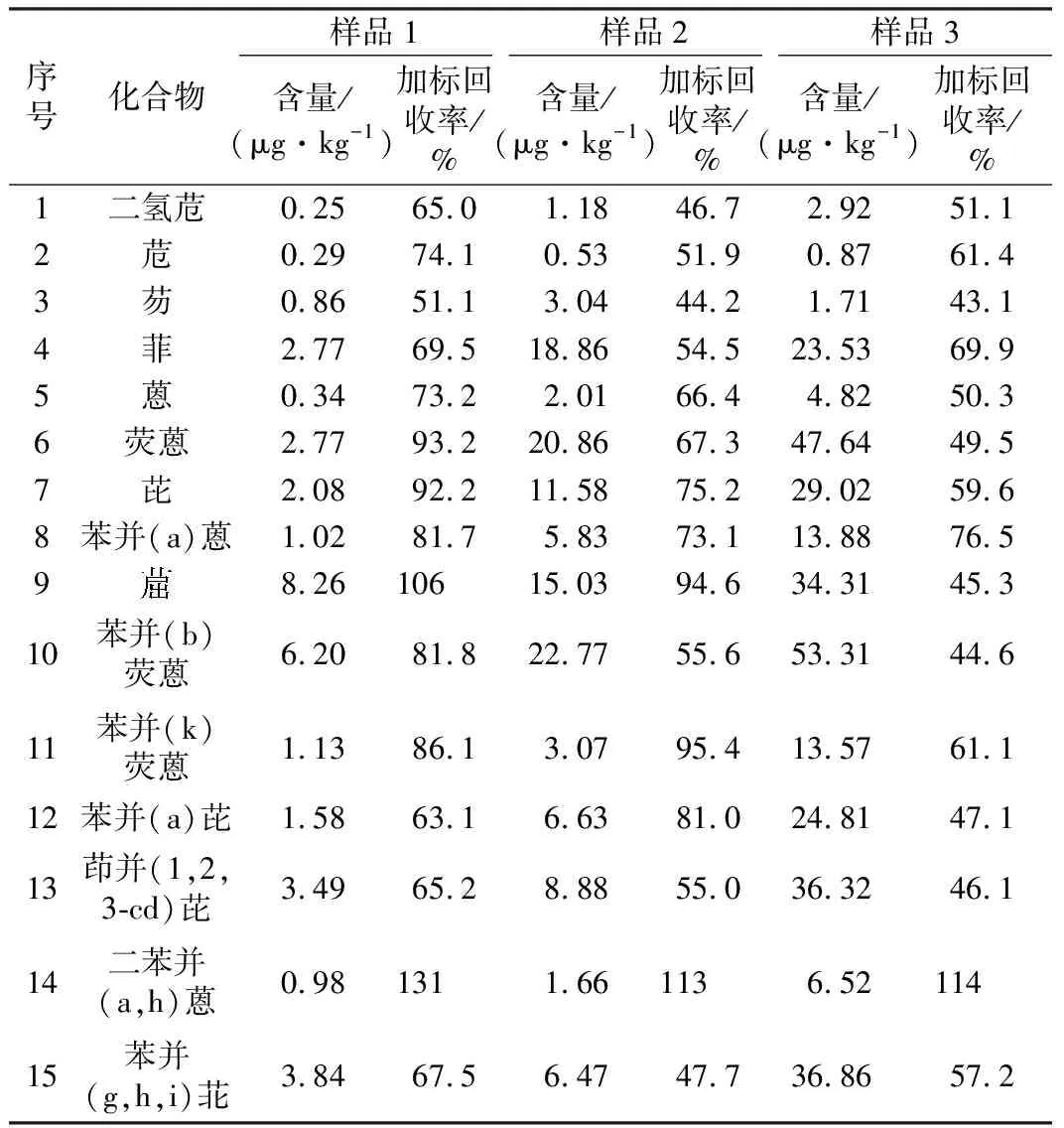
表5 农田土壤中PAHs的测定结果Table 5 The determination result of PAHs from farmland soil
3 结论
通过对土壤中15种多环芳烃的前处理条件、分析条件进行优化,研究建立了适合于分析土壤样品中多环芳烃的加速溶剂萃取—气相色谱/质谱联用方法,方法检出限低(0.12~0.37 μg/kg),灵敏度高,加标回收率和精密度均能满足土壤样品中多环芳烃的质量控制要求。
