非洲猪瘟疫苗研究趋势
2019-12-23陈江华陈文智梁旺旺丰志华
陈江华 陈文智 梁旺旺 丰志华
(福建师范大学南方生物医学研究中心,福建省天然免疫生物学重点实验室 福州 350117)
非洲猪瘟病毒(ASFV)是非洲猪瘟病毒科非洲猪瘟病毒属唯一成员,是唯一的虫媒双链DNA病毒[1-2],钝缘蜱属的节肢类动物为ASFV自然宿主和传播媒介[3-4]。自然宿主感染该病毒后无并发症,随后发展为持续性感染[5],家猪自然条件下感染ASFV后经过3~5 d的潜伏期,开始出现临床症状,10~14 d内死亡,死亡率可达100%[6-7]。ASFV成熟病毒颗粒具有多层结构,直径约200 nm,其衣壳为二十面体对称结构,基因组大小为170~193 kb,有150~167个开放阅读框,可编码54种结构蛋白、100多种非结构蛋白,基因组差异主要源于多基因家族(MGFs)成员的拷贝数不同[8-11]。按其mRNA的累积动力学分析,ASFV基因可分为立早期基因、早期基因、中期基因及晚期基因;中期基因的存在说明其基因表达受到严密调控[12-13]。ASFV编码的多种蛋白可抑制干扰素的表达,参与病毒免疫逃逸过程,但大多数蛋白功能未知[14]。目前认为ASFV主要通过巨胞饮及网格蛋白介导的胞吞作用侵染宿主单核巨噬细胞系统,但介导病毒与细胞相结合的受体还未发现[15-16]。
1921年ASF首次在肯尼亚报道[17],疫情于2007年传入俄罗斯等地区,随后传入乌克兰(2012年)、白俄罗斯(2013 年)、立陶宛(2014 年)、罗马尼亚(2017年)、匈牙利及中国(2018)[7,18]。ASFV 可分为 24 种基因型、8种血清型[18-19],撒哈拉以南非洲地区存在所有基因型,只有基因型Ⅰ和基因型Ⅱ传播到非洲以外地区[20]。ASFV基因型Ⅰ在1957年和1960年传播到伊比利亚半岛,后来侵入其他一些欧洲国家、加勒比地区和巴西,并仍留在撒丁岛。基因型Ⅱ在2007年从东非传播到高加索地区,然后迅速传播并在整个俄罗斯联邦和东欧的一些国家蔓延[20]。不同毒株之间毒力存在着差异,中国首次发现与分离的ASFV为基因型Ⅱ型、血清型8型[18-21]。Ⅱ型ASFV具有高毒力并诱导产生急性ASF病症,致死率接近100%[7,22-23]。目前,ASF有全球蔓延之势,针对ASF没有商品化疫苗,对于疫情只能被动防控(扑杀),不能主动预防,其对猪养殖业是灾难性的,给猪养殖业带来了巨大的经济损失,因此,研发用于预防ASF的疫苗迫在眉睫。近年来随着基因编辑技术与DNA测序及合成技术的发展,加快了非洲猪瘟疫苗研发的进程,研发针对预防非洲猪瘟的疫苗有灭活苗、弱毒活疫苗、亚单位疫苗、核酸疫苗、病毒载体疫苗等。现对ASF疫苗研究的最新进展进行综述,以期对ASF疫苗的研发提供参考。
1 灭活疫苗及弱毒活疫苗
早期研究主要聚焦于灭活疫苗的研制,FORMAN等[24]用戊二醛与洗涤剂分别处理ASFV侵染后的猪肺泡巨噬细胞并用于免疫,攻毒后发现戊二醛处理组有更快的血清学反应及病毒血症有所减轻,洗涤剂处理组未观察到明显的血清学反应且针对同源病毒的攻击也不具有保护作用。STONE等[25]用乙酰氮丙啶和缩水甘油醛处理制备的ASF灭活疫苗免疫后可产生抗体,但不能抵御ASFV的攻击。新型佐剂也未能增强灭活疫苗的保护效果,BLOME等[26]分别用佐剂PolygenTM与配伍灭活的ASFV亚美尼亚08株免疫小猪,免疫后小猪可产生特异性抗体,但用同源毒株攻击,发现该灭活疫苗免疫后并不能提供保护作用,且免疫组攻毒后更早出现临床症状。目前,灭活苗的研制都以失败告终,关于ASF灭活疫苗的研究也较少报道。
大多数病毒经过多次细胞传代可致弱,ASFV也不例外。MANSO等[27]将细胞传代致弱的病毒接种家猪后并未引起家猪死亡,且可抵御强毒攻击。随后进行免疫接种,但接种后约有23%的猪出现了临床症状以及部分猪出现死亡。TITOV等[28]用经细胞传代致弱获得的KK262株免疫小猪后再用同源毒株K49株(基因型Ⅰ,血清型2)攻击,发现免疫后小猪并不能抵御野生型K49株的攻击。可见,经细胞传代致弱的ASFV毒力不稳定,接种后易反强或免疫原性差,强毒攻击后最终导致慢性感染及死亡。但相关研究表明弱毒活疫苗仍可抵御强毒攻击,如OURT88/3 株[29-30]。KING 等[30]用 OURT88/3 株免疫小猪后再用强毒株OURT88/1加强免疫,最后用强毒株乌干达1965分离株(基因型X)及Benin 97/1(基因型Ⅰ)攻击,发现OURT88/3株免疫后可抵御强毒株OURT88/1、乌干达1965分离株及Benin 97/1的攻击。通过测序发现OURT88/3株与强毒株对比缺失了约10 kb的基因序列,该序列的丢失导致多基因家族(MGF360、MGF505、MGF530)大多数基因 缺失,这些基因与ASFV免疫逃逸相关,该片段缺失加强了Ⅰ型干扰素的反应强度[31-33]。O'DONNELL等[34-35]将多基因家族MGF360与MGF505的MGF505-1R、MGF360-12L、MGF360-13L、MGF360-14L、MGF505-2R以及 MGF505-3R删除后获得ASFV-G ΔMGF株,用该毒株免疫小猪后以强毒株ASFV-G攻击显示ASFV-GΔMGF株具有良好的保护能力;但在ASFV-G-△MGF基础上再删除9GL后获得的ASFV-G-Δ9GL/ΔMGF疫苗株不具保护作用。CRISPR/Cas9基因编辑技术是弱毒活疫苗研发的关键技术,其应用加快了ASFV弱毒疫苗的研发进程,BORCA等通过该技术构建了ASFV弱毒株(ASFV-G/Δ8-DR),但未进行免疫攻击试验。其他弱毒株有 ASFV-G-Δ9GL/ΔUK、Benin ΔDP148R、Pret4 Δ9GL、NHV/P68、OURT88/3 ΔDP2 及 Ba71 ΔCD2v、ASFV-GΔ9GL/ΔNL/ΔUK 等[34-51],不同弱毒株之间其保护能力也各不相同,除了与所缺失基因不同外还与基因型相关(见表1)。目前,弱毒活疫苗仍是研究热点与重点,国内已构建MGF360-MGF505R缺失弱毒株及MGF360-MGF505R与CD2v基因缺失弱毒株(原始毒株Pig/HLJ/18[21])但未见详细报道。
2 亚单位疫苗及核酸疫苗
非洲猪瘟病毒 p12、p30、p54、p72、CD2v 等结构蛋白为亚单位疫苗以及核酸疫苗研究的热点[52-58](见表2),这些亚单位疫苗及核酸疫苗可诱发机体产生免疫应答,但大多数疫苗并不能提供很好的保护,且有些疫苗保护效果还有待验证。LACASTA等[56]将p30、p54及血凝素胞外结构域与泛素融合表达构建的核酸疫苗免疫小猪后,保护率为33%。随后LACASTA等构建表达除p30、p54及血凝素在内的ASFV所有ORF的质粒(4 029个)并用于免疫攻击试验,保护率为60%且观察到25%(2/8)的小猪在任何阶段无排毒现象,但这是否由疫苗免疫导致还有待验证。有研究表明,攻毒后存活小猪不排毒并不是疫苗免疫导致,而是ASFV不能在幸存猪中长期潜伏及排毒[23]。SUN-YOUNG等[57]用表达CD2v、p72、p32、±p17 的质粒以及重组蛋白 p15、p35、p54、±p17免疫小猪后可产生特异性抗体,但以强毒株亚美尼亚2007株进行攻击后发现,相比对照组免疫组小猪在攻毒后出现更早的临床症状、病毒血症及死亡,表明核酸疫苗及亚单位疫苗免疫后产生的特异性抗体并不能中和病毒且增强了ASFV的感染,提示在核酸疫苗及亚单位疫苗研究中选择更多的抗原免疫并不一定能取得更好的效果,选择合适的抗原组合是关键。由于ASFV结构蛋白众多,单靠几种结构蛋白免疫机体难以提供较为全面的保护。因此,表达ASFV蛋白所制备的亚单位疫苗或者可表达几种蛋白组合的核酸疫苗及重组疫苗的研究有待进一步探索。
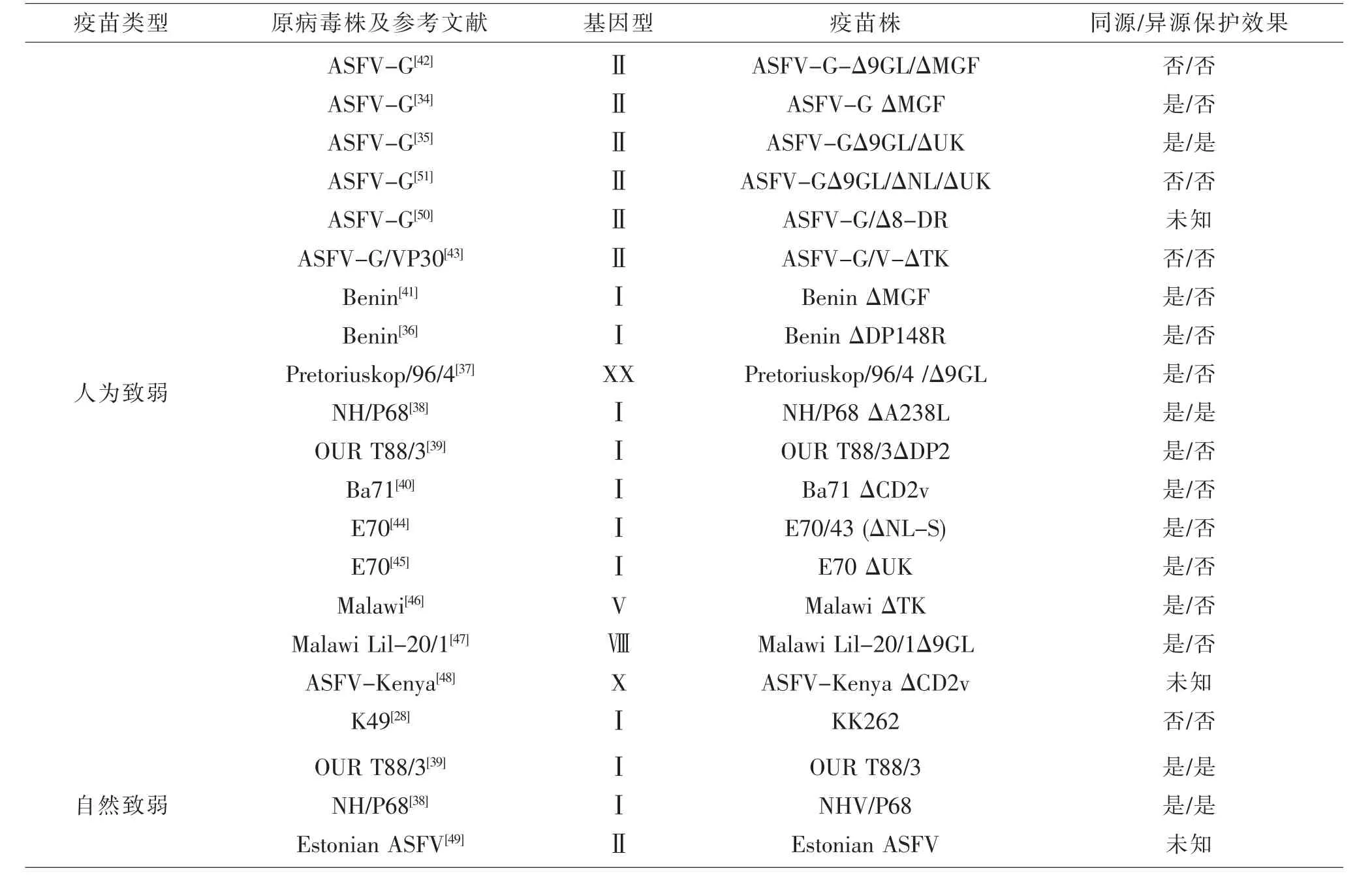
表1 ASFV弱毒活疫苗
3 病毒载体疫苗及复制缺陷型疫苗
腺病毒与痘病毒常被作为载体将外源基因递送到机体表达相关蛋白,使机体产生免疫反应用于抵抗病毒的入侵[59-62]。LOKHANDWALA等[61,63]将ASFV的多种基因经腺病毒载体导入机体表达 (见表3),以 “鸡尾酒”式免疫可诱发机体产生较强的免疫反应,因此,其猜测通过腺病毒将ASFV相关基因递送到机体产生免疫反应能有效抵抗ASFV的侵染。但其作为疫苗的有效性还需进行免疫攻击试验加以验证。 LOPERAMADRID 等[62]以重组 B646L(P72)、EP153R和EP402R(CD2v)的痘苗病毒为载体免疫小猪,并不能诱导抗体应答但能诱发IFNγ的表达。研究表明,细胞免疫应答在ASFV免疫保护中扮演重要角色,CD8+T细胞的耗竭消除了OURT88/3株免疫后提供的保护作用[64]。NETHERTON C L等[65]筛选出能被T细胞识别并可激活细胞免疫的抗原蛋白 由 B646L、MGF110-5L、CP204L、CP530R、I73R、I215L、A151R、C129R、E146L 等基因 (来自 ASFV OURT88/3株)编码,随后将这些基因插入到腺病毒载体与牛痘病毒载体中进行免疫,发现免疫后可激活细胞免疫及体液免疫,但用强毒株OURT88/1攻击后并未显示这些病毒载体疫苗具有保护作用,仅降低部分免疫猪病毒血症。CHEN X等[66]将ASFV p72基因通过反向遗传学技术插入到新城疫病毒基因组中构建了rNDV/p72重组毒株,用该毒株免疫小鼠后可产生特异性抗体并引起T细胞增殖和IFN-γ、IL-4的分泌,其认为该毒株可作为预防ASFV的候选疫苗株,但未进行免疫攻击试验,其保护效果还有待确定。可见病毒载体疫苗激活免疫应答的能力因其携带的基因不同而存在差异,且大多数疫苗保护效果还有待验证。

表2 ASFV亚单位疫苗及核酸疫苗
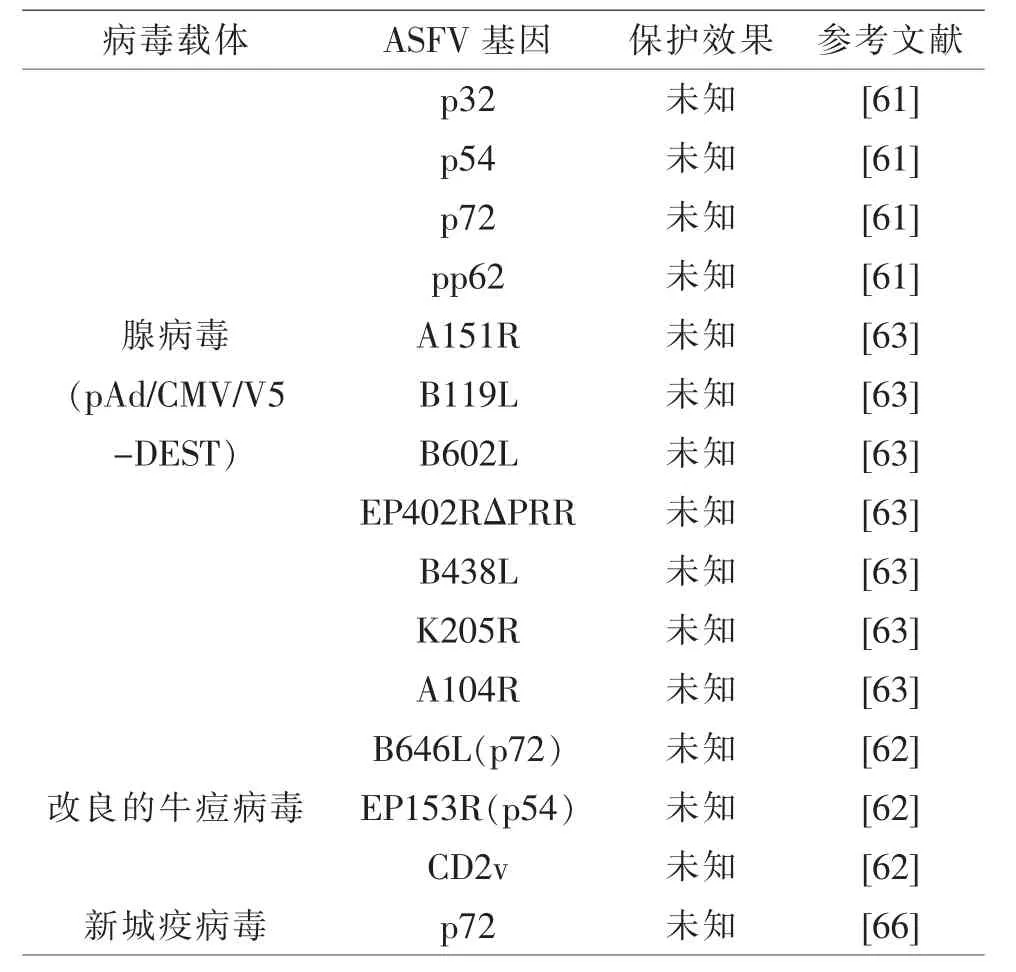
表3 病毒载体疫苗
复制缺陷型疫苗目前还无相关报道,其不具复制能力但最大程度保留了完整病毒颗粒所具有的免疫原性,相比弱毒活疫苗其免疫动物后不会产生排毒以及毒力反强等免疫副作用,是一种理想的疫苗。虽然复制缺陷型疫苗还未见报道,但已有相关的基因缺失毒株(BA71)被申请专利,如 PP220、pp62和pB438L基因缺失毒株[67]。
4 ASF疫苗研发瓶颈
ASF疫苗研发瓶颈主要体现在以下几方面:(1)ASFV基因型众多,所研发的疫苗交叉保护能力差,只能针对同源或者几种非同源病毒具有保护作用。(2)大多数ASFV在常见的细胞系如ST、Vero中不能增殖,只有少数几种毒株如Ba71 V或Georgia 07等可在Vero细胞中增殖,其他毒株只能通过猪单核-巨噬细胞或者网状-内皮细胞中进行增殖且产量低[68-70]。 (3)ASFV 基因组庞大,多数基因功能未知,且编码的许多蛋白具有免疫抑制作用,可协助病毒的免疫逃逸以利于病毒的复制与扩散[20,71]。(4)疫苗免疫后可产生特异性抗体但并不能抵抗病毒入侵,即产生的抗体并非中和抗体。(5)ASFV可在单核巨噬细胞中大量增殖,而单核巨噬细胞在抗原呈递、诱导T细胞活化及激活启动免疫应答等方面具有重要作用,ASFV对单核巨噬细胞系统破坏无疑会削弱猪的免疫力,促进病毒感染。
5 总结与展望
目前,针对ASF没有疫苗预防,疫情仍然时有暴发。根据目前疫苗研究现状可知,灭活苗、亚单位疫苗、核酸疫苗免疫后保护能力极差甚至无保护作用。病毒载体疫苗需多次免疫或以“鸡尾酒”式免疫或可取得一定免疫效果,且多数病毒载体疫苗保护效果有待验证。弱毒活疫苗保护效果参差不齐,自然致弱毒株毒力不稳定、易反强,人为致弱毒株保护效果因不同基因缺失其保护效果也不同,但总体优于灭活苗、亚单位疫苗、核酸疫苗及病毒载体疫苗。复制缺陷型疫苗的研发还未见详细报道,其免疫保护效果未知,但其安全性好,不存在毒力反强现象,研发该类疫苗也是研发ASF疫苗的一个突破方向。对于弱毒活疫苗的构建,应当针对与免疫抑制相关基因如MGF360 成员、MGF505 成员、DP96R、CD2v、DP148R、9GL 等基因的删除,但 9GL、MGFs、TK、NL等基因不宜同时剔除,以免降低疫苗免疫原性导致免疫后不能提供保护。
随着CRISPR/Cas9基因编辑技术的发展,可针对ASFV特定基因进行删除,构建弱毒株及复制缺陷型毒株或定点敲除某个基因构建重组疫苗株,该技术将加快ASF弱毒活疫苗、复制缺陷型疫苗及重组疫苗的研发。随着基因合成技术的发展,可构建全基因组敲除文库,应用全基因组敲除文库可筛选出ASFV宿主依赖因子及互作蛋白,针对这些因子及蛋白可设计相应多肽类、小分子化合物类以及筛选出天然抗病毒药物等。cGAS-STING通路的发现,揭示了cGAMP作为第二信使可与其接头蛋白STING结合并激活下游信号,可激活Ⅰ型干扰素的表达[72-74],由于ASFV多个蛋白如MGF360/505家族、DP96R与EP153R等可抑制宿主细胞Ⅰ型干扰素和ISGs的产生,调控细胞凋亡、蛋白合成和自噬等多种信号通路[20],若将cGAMP作为新型疫苗佐剂可逆转ASFV对干扰素表达的抑制,从而可加强机体的抗病毒反应,增强疫苗免疫效果。鉴于目前ASF疫苗研发的进展,不难发现弱毒疫苗保护能力优于灭活苗、亚单位疫苗、核酸疫苗及病毒载体疫苗,弱毒活疫苗极有可能成为第一个用于预防非洲猪瘟疫情的疫苗类型。
