流式细胞术检测食管鳞癌患者外周血循环肿瘤细胞
2019-12-23赵荣荣乔媛媛刘军强范博士
李 军,赵荣荣,乔媛媛,王 伟,文 锋,刘军强,范博士
食管癌是我国最常见的恶性肿瘤之一,其中鳞状细胞癌占90%以上,尽管诊疗的手段不断进步,但食管癌的5年生存率仍低于20%[1-3],初诊分期较晚、肿瘤复发转移是其主要原因。随着对食管鳞癌循环肿瘤细胞(circulating tumor cells,CTCs)研究的深入,提示其对监测肿瘤的发生发展、复发转移具有重要意义,可以指导治疗,改善预后[4]。近年来,CTCs的检测方法不断涌现,但各有利弊,尚无统一标准。本研究旨在利用密度梯度离心法联合流式细胞术检测食管鳞癌和健康人外周血CTCs,尝试建立一种高效简单易行的食管鳞癌CTCs富集和分离方法。
1 材料与方法
1.1 临床资料 收集2017年10月—2018年5月中国人民解放军总医院第六医学中心胸外科收治的食管鳞癌患者的外周血,共20例。纳入标准:术前经病理学诊断为食管鳞癌;患者及家属充分知情,签署同意书。排除标准:病理为非鳞癌;食管穿孔;感染;恶病质。同时收集我院5例健康志愿者血样作为对照。
1.2 抗体、主要试剂及设备 Anti-EpCAM-APC、anti-Cytokeratin (CK)-FITC及anti-CD45-PerCP抗体均购自德国美天旎公司;流式固定液和破膜液购自美国BD公司,淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司。BD FACSCalibur流式细胞仪(美国BD公司)由我院中心实验室提供。
1.3 食管鳞癌细胞系的培养及流式检测 选用3个食管鳞癌细胞系EC9706、EC9706P(由EC9706细胞系经过Transwell筛选出的高转移细胞系)[5]及Kyse-170,将其从液氮中取出,迅速放入37 ℃温水中,加入10% FBS的DMEM高糖及RPMI 1640培养基中混匀。然后以1 000 r/min离心5 min,弃上清。EC9706及EC9706P细胞系加入含有10% FBS的DMEM高糖培养基,Kyse-170加入含有10% FBS的RPMI1640培养液,反复吹吸细胞,移至培养瓶,各自补加10%FBS的两种培养基至5 mL,置37 ℃、5% CO2培养箱中培养。收集3种细胞系,分别加入anti-EpCAM-APC(anti-CD326-APC),anti-CD45-PerCP抗体,常温下避光孵育15 min,经固定透化后再加入anti-CK-FITC,常温避光孵育30 min,加入1 mL PBS,洗涤,离心5 min,弃上清。用500 μL PBS重悬细胞,通过流式细胞仪进行CTCs检测。
1.4 标本采集及外周血单个核细胞的分选 从肘正中静脉用含EDTA采血管采集清晨空腹外周血7.5 mL,为防止静脉穿剌过程中上皮细胞的污染,前2 mL不收集到目的采血管中。采集后于室温保存,并进行外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的分选。步骤:将外周血用同样体积的PBS稀释至15 mL,缓慢加入Ficoll分离液面上(外周血稀释液∶Ficoll分离液=1∶1),放入水平离心机2 000 r/min离心20 min,吸去最上层血清,尽量吸取中间白膜层,即PBMC层,然后加入10 mL的PBS,1 500 r/min离心10 min,弃上清,重复1次。加入红细胞裂解液1 mL,静置5 min,1 500 r/min离心10 min。分离后的细胞即为PBMC。
1.5 敏感性实验 将EC9706细胞加入到PBMC中,EC9706细胞与PBMC的比例分别为1∶106,5∶106,1∶105,5∶105,1∶104,用anti-EpCAM-APC,anti-CD45-PerCP进行表面染色,染色完成后加固定破膜液处理,加入抗体anti-CK-FITC,常温避光孵育30 min,加入1 mL PBS,洗涤,离心5 min,弃上清,用500 μL PBS重悬细胞,通过流式细胞仪进行CTCs检测。结果以外周血每106PBMC中CK+、EpCAM+、CD45-细胞数来表示外周血中的肿瘤细胞含量,即CTCs单位为×10-6。参考既往研究结果,本研究以CTCs数量<3为检出阴性,CTCs数量≥3为检出阳性[6]。
1.6 特异性实验 按照1.4描述的方法采集食管鳞癌患者及健康志愿者外周血7.5 mL并进行PBMC的分离,分离后按照1.5描述的染色方法完成染色后用流式细胞仪检测外周血中CTCs。
1.7 统计学处理 流式细胞仪检测结果利用CellQuest软件自动生成各种散点图及数据结果。应用SPSS 17.0统计软件,计数资料以频数和率表示,组间比较进行χ2检验,以P<0.05为差异比较具有统计学意义。
2 结果
2.1 食管鳞癌细胞系中EpCAM和CK表达 3种细胞系在CD45-细胞群中EpCAM及CK的比例见图1。
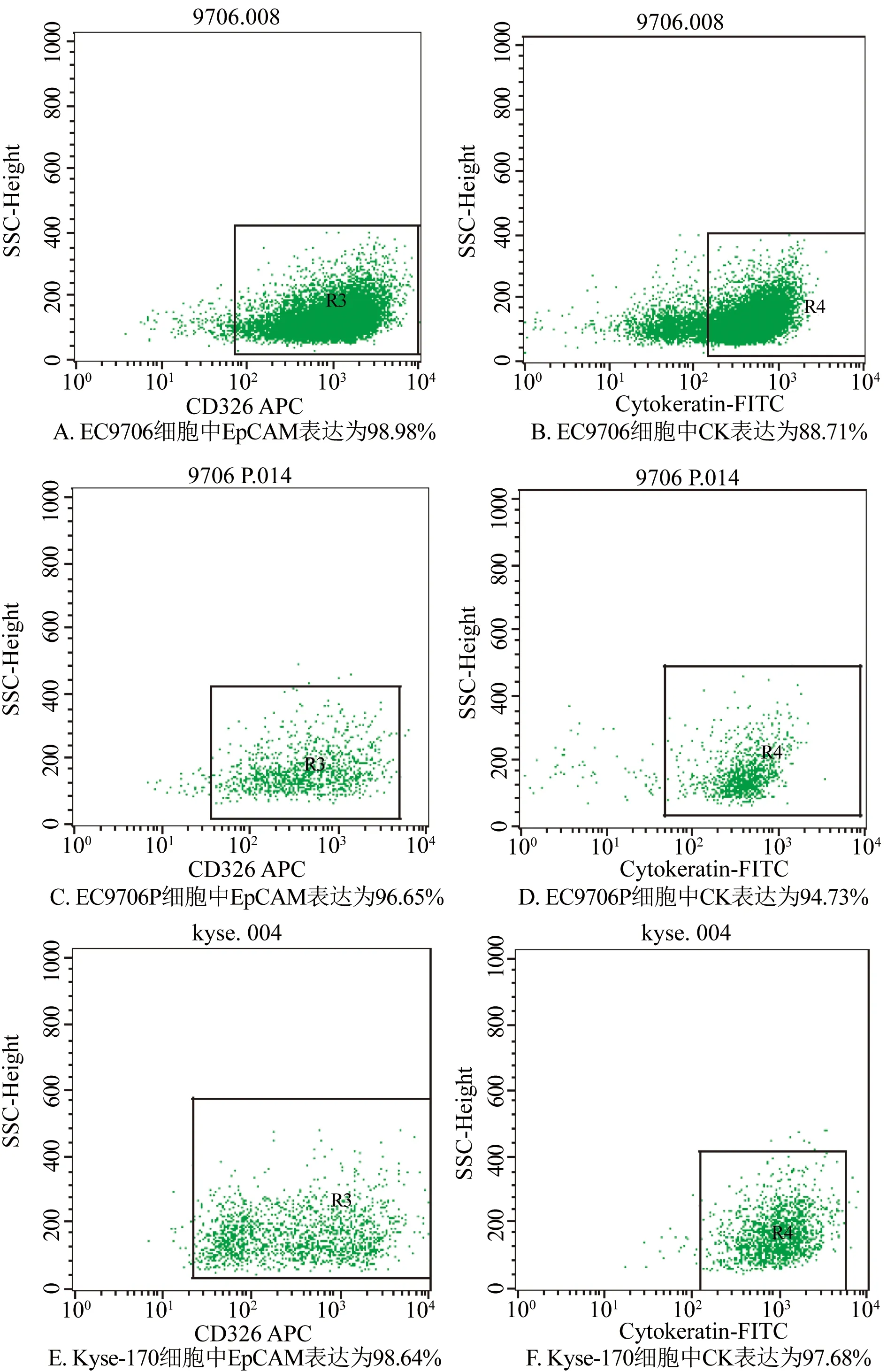
图1 3种细胞系中EpCAM及CK在CD45-细胞群中的比例
2.2 CTCs的确定 ①以侧向反散射(SS)对前向散射(FS)作二维散射点,设R1门(图2);②取R1门,以SS对CD45-PerCP作二维散射点,选择CD45-细胞设R2门(图3);③取R2门,以CK-FITC对EpCAM-APC(CD326-APC)作二维散射点,选择EpCAM+CK+细胞设定为CTCs(图4)。

图2 FSC、SSC二维散点图

图3 CD45 PerCP单染二维散点图
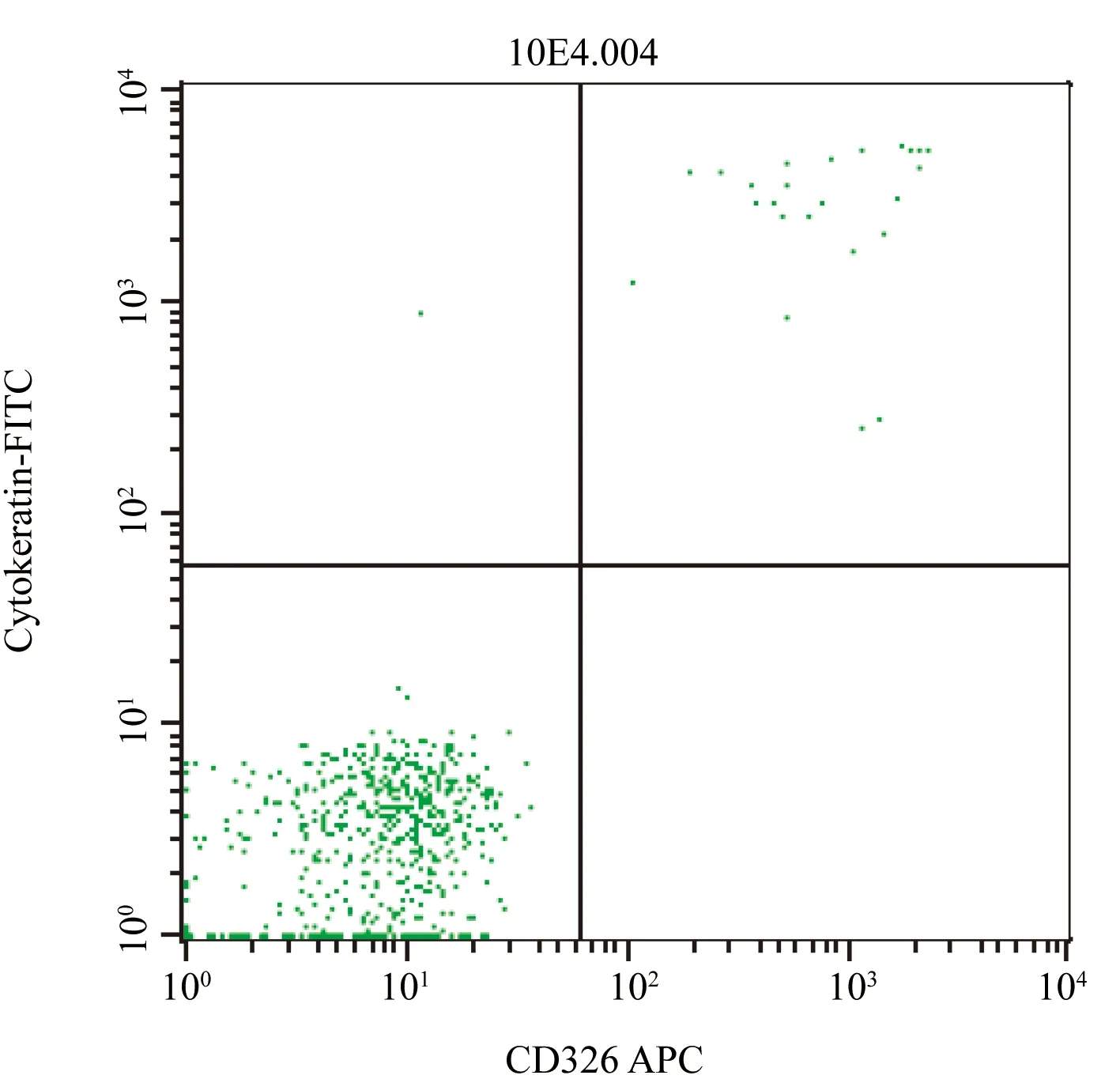
图4 CD326 APC/CK FITC双染样本分析图
2.3 敏感性和特异性验证 将不同数量的食管鳞癌细胞掺入到健康志愿者2 mL抗凝血中,用流式细胞仪检测CTCs。结果发现外周血每106个细胞可检出1个CTCs,证明该方法敏感度高。实验共检测了20例食管鳞癌及5名健康志愿者外周血样(见表1)。其中5例健康志愿者外周血CTCs检测为阴性,而20例食管鳞癌中有15例均检测到CTCs,CTCs阳性率达到75%,明显高于健康志愿者,差异比较具有统计学意义(χ2=7.955,P=0.004 8),表明密度梯度离心结合流式细胞术可以更高效的检测到食管鳞癌外周血中的CTCs,敏感性和特异性好。
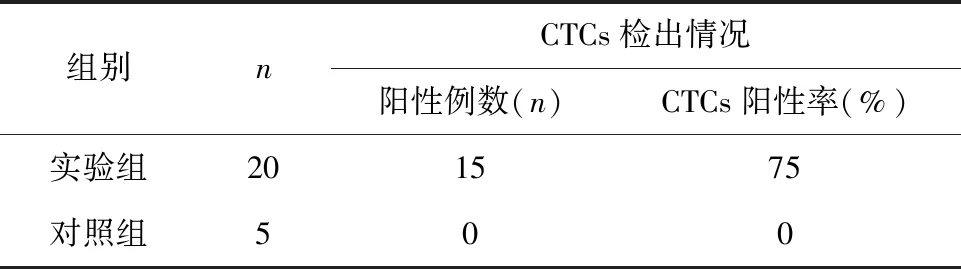
表1 食管鳞癌患者和健康志愿者外周血CTCs阳性率
3 讨论
CTCs是指自发或因诊疗操作由实体瘤或转移灶释放进入外周血循环的一类肿瘤细胞[7],在肿瘤的早期筛查、疗效评估、监测复发转移等方面具有重要意义,而且具有创伤小、可连续检测等优点,一直是肿瘤领域研究的热点[8]。近年来随着液体活检、二代测序技术的发展,对ctDNA的检测有逐渐替代针对CTCs细胞检测的趋势,但尚无证据支持片段化的ctDNA提供的信息能够提高疾病的治疗效果,改善预后[9],而完整CTCs细胞的检测,不但可以判断细胞数量,更能够提供全面的细胞变化的信息和数据,但由于CTCs在外周血中含量极其稀少,对于CTCs的富集分离和鉴定一直是研究的热点和难点[10-12]。
目前,CTCs的富集方法主要包括基于形态学的富集法、免疫磁性分离法和微芯片技术等,CTCs的鉴定技术包括核酸分析法、免疫细胞化学法、流式细胞分析法、功能分析法等,单一方法的准确率不高,各项技术也各有利弊。在前期的研究中,我们应用免疫磁珠负性筛选策略,成功在食管鳞癌患者外周血中富集、鉴定出食管鳞癌CTCs[6],但由于步骤繁琐,耗时较长,难以在临床推广应用。流式细胞术的优点在于特异性强、重复性好,费用较低、操作简便、快速、数据精确,更适于临床普查,而且可在免疫放大检测CTCs的同时对癌细胞的形态进行定量测定,同时还可进行多参数测量,并可对细胞进行分析与分选。但缺点在于不能区分活细胞和死细胞,不能反映CTCs的功能状态[13]。为提高检测效率和准确度,本研究采用了密度梯度离心法和流式细胞术联合检测方法。
肿瘤细胞分解产物超出正常网状内皮细胞系统的清除能力,胞内细胞角蛋白水平大大升高并被释放入血[14],故针对细胞角蛋白的检测常用于外周血CTCs的鉴定,本研究也选择了EpCAM及CK作为CTCs的定性标志,将标记为CD45-/EpCAM+/CK+的细胞定义为CTCs。CTCs检测结果受多种因素影响,本研究主要通过标本采集和实验步骤的优化等减少假阴性、假阳性结果。血样采集时,将最初的2 mL外周血弃除,避免采血处皮肤等组织上皮细胞的混入。实验操作中,选用单克隆抗体,减少多克隆抗体的非特异染色,同时,在每次染色完成后,用PBS进行洗涤,最大限度减少非特异染色对识别的干扰。研究结果显示,5例健康志愿者外周血中CTCs定量均为阴性,而20例食管鳞癌患者中有15例CTCs定量为阳性,CTCs阳性率达到75%。提示此方法特异性、敏感度较高。
本研究的不足之处是样本量较少,数据有限,在后续研究中将增加样本量,并通过实验数据和随访数据的积累,继续完善、优化实验步骤,进一步评价该研究方法的临床应用价值,同时尝试通过血液富集将游离DNA 浓集,用流式分选将单个CTCs分离,为基因测序、DNA、RNA及蛋白分子等的分析奠定基础。
