Sigma-1受体在小鼠肝缺血再灌注损伤中的表达和作用
2019-12-23沈昀泰陈德喜臧运金
沈昀泰,陈德喜,臧 英,关 鸽,刘 欢,臧运金
肝缺血再灌注损伤是肝部分切除及肝移植等肝胆外科手术中常见的并发症[1]。尤其是在肝移植中,肝缺血再灌注损伤可造成已移植肝功能障碍,肝功能恢复时间延迟,甚至引起肝衰竭[2]。已有研究证实凋亡、氧化应激和炎症反应等与肝缺血再灌注损伤密切相关[3-6]。Sigma-1受体是分布于内质网的跨膜蛋白,其分子量约为25 KD[7],在氧化应激、炎症反应等多种生理过程中发挥重要调节作用[8-10],并且在肝组织中有较高的表达[11-12]。本研究通过构建小鼠肝缺血再灌注模型,研究Sigma-1受体在肝缺血再灌注损伤中表达变化,同时采用Sigma-1受体激动剂和抑制剂预处理小鼠,探讨Sigma-1受体表达变化与肝缺血再灌注中炎症反应的关系,进一步阐明Sigma-1受体在小鼠肝缺血再灌注损伤中的作用。
1 材料与方法
1.1 材料 C57BL/6J小鼠40只,购自北京维通利华实验动物技术有限公司,体重18~22 g[SCXK(京)2016-0006];Trizol(美国Introvigen公司);RIPA裂解液(北京索莱宝科技有限公司);蛋白定量试剂盒(上海碧云天生物技术研究所);Sigma-1受体激动剂4-苯基-1-(4-苯丁基)哌啶[4-phenyl-1-(4-phenylbutyl) piperidine,PPBP](美国Sigma-Aldrich公司)和Sigma-1受体抑制剂NE-100(英国Tocris Bioscience公司);实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)逆转录试剂盒(日本TaKaRa公司);SYBR Premix Ex TaqTMⅡ(日本TaKaRa公司);Sigma-1受体抗体和β-actin抗体(美国Cell Signaling公司);山羊抗兔抗体(武汉博士德公司);肝组织肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素(interleukin,IL)-6和IL-10 ELISA检测试剂盒(武汉伊莱瑞特生物科技有限公司);正置生物显微镜及照相系统(日本Olympus公司)。
1.2 方法
1.2.1 实验分组 为检测肝缺血再灌注后小鼠肝组织中Sigma-1受体表达水平变化,将20只C57BL/6J小鼠随机分组如下:①对照组;②肝缺血再灌注组:肝缺血1 h再灌注6 h、再灌注12 h、再灌注24 h组;每组5只小鼠。为进一步研究Sigma-1受体在小鼠肝缺血再灌注损伤中作用,将20只小鼠随机分组如下:①对照组;②肝缺血再灌注组;③Sigma-1受体激动剂组;④Sigma-1受体激动剂加抑制剂组;每组5只小鼠。
1.2.2 小鼠肝缺血再灌注模型构建 10%水合氯醛麻醉C57BL/6J小鼠,固定后腹部备皮、铺巾,经腹部正中切口,逐层切开腹壁。充分显露肝左叶及肝中叶,显微血管夹夹闭肝动脉及门静脉,造成70%的肝脏缺血。临时阻断血流1 h后取下显微血管夹,再灌注时间分别为6、12和24 h。Sigma-1受体激动剂组小鼠于建立模型前1 h以1 mg/kg的剂量腹腔注射PPBP溶液,Sigma-1受体激动剂加抑制剂组小鼠于建立肝缺血再灌注模型前3 h以1 mg/kg的剂量腹腔注射NE-100溶液,建立模型前2 h以1 mg/kg的剂量腹腔注射PPBP溶液,再于建立模型前1 h以1 mg/kg的剂量腹腔注射PPBP溶液。对照组和缺血再灌注组小鼠注射等体积生理盐水。对照组仅进行开腹、暴露肝门及关腹操作,不夹闭血管。
1.2.3 收集标本 收集小鼠血标本,分离获得血清,用于检测小鼠血清谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)和细胞因子水平。收集小鼠肝组织,剪为小块分装保存-80 ℃冰箱用于提取RNA及蛋白质或浸泡于4%多聚甲醛溶液固定,用于观察肝组织病理学变化。
1.2.4 qRT-PCR 采用Trizol提取小鼠肝组织的RNA,分光光度计检测RNA纯度和浓度,RNA逆转录合成cDNA后进行qRT-PCR。所用引物序列如表1。

表1 qRT-PCR引物
1.2.5 Western Blot RIPA裂解液提取小鼠肝组织总蛋白,98 ℃加热10 min使蛋白变性;BCA蛋白检测试剂盒检测蛋白浓度;经聚丙烯酰胺凝胶电泳分离蛋白并转移至PVDF膜。5%脱脂牛奶室温封闭1 h,室温TBST液洗膜3次后,加入Sigma-1受体抗体和β-actin抗体后4 ℃摇床过夜;洗膜后加入相应的羊抗兔抗体室温孵育1 h;经ECL超敏发光液曝光并拍照。
1.2.6 血清ALT、AST水平检测 取不同分组小鼠血清标本,经全自动生化分析仪检测血清ALT、AST水平。
1.2.7 血清细胞因子检测 根据ELISA试剂盒说明书,采用ELISA法检测小鼠血清细胞因子TNF-α、IL-6和IL-10水平。
1.2.8 观察肝组织病理学变化 取各组小鼠适量肝组织,经4%多聚甲醛固定过夜后进行石蜡包埋、切片、苏木精-尹红染色法染色。显微镜随机选取5个高倍视野评估小鼠肝组织病理学变化情况。

2 结果
2.1 小鼠肝缺血再灌注后Sigma-1受体mRNA和蛋白表达变化 通过qRT-PCR法检测Sigma-1受体在不同再灌注时间点的mRNA表达水平。结果显示不同再灌注时间点的各组小鼠肝Sigma-1受体mRNA表达水平均比对照组高,差异比较具有统计学意义(P<0.05)。Sigma-1受体mRNA表达水平在再灌注12 h达到高峰,再灌注6、24 h Sigma-1受体mRNA表达水平均较再灌注12 h低(图1A)。Western Blot实验检测Sigma-1受体在不同再灌注时间点的蛋白表达水平。结果显示缺血再灌注组的小鼠肝组织Sigma-1受体蛋白表达水平在再灌注12 h达到高峰,缺血再灌注组Sigma-1受体蛋白表达水平均比对照组表达水平高(图1B)。因此,选择缺血1 h再灌注12 h作为后续构建模型的时间点。
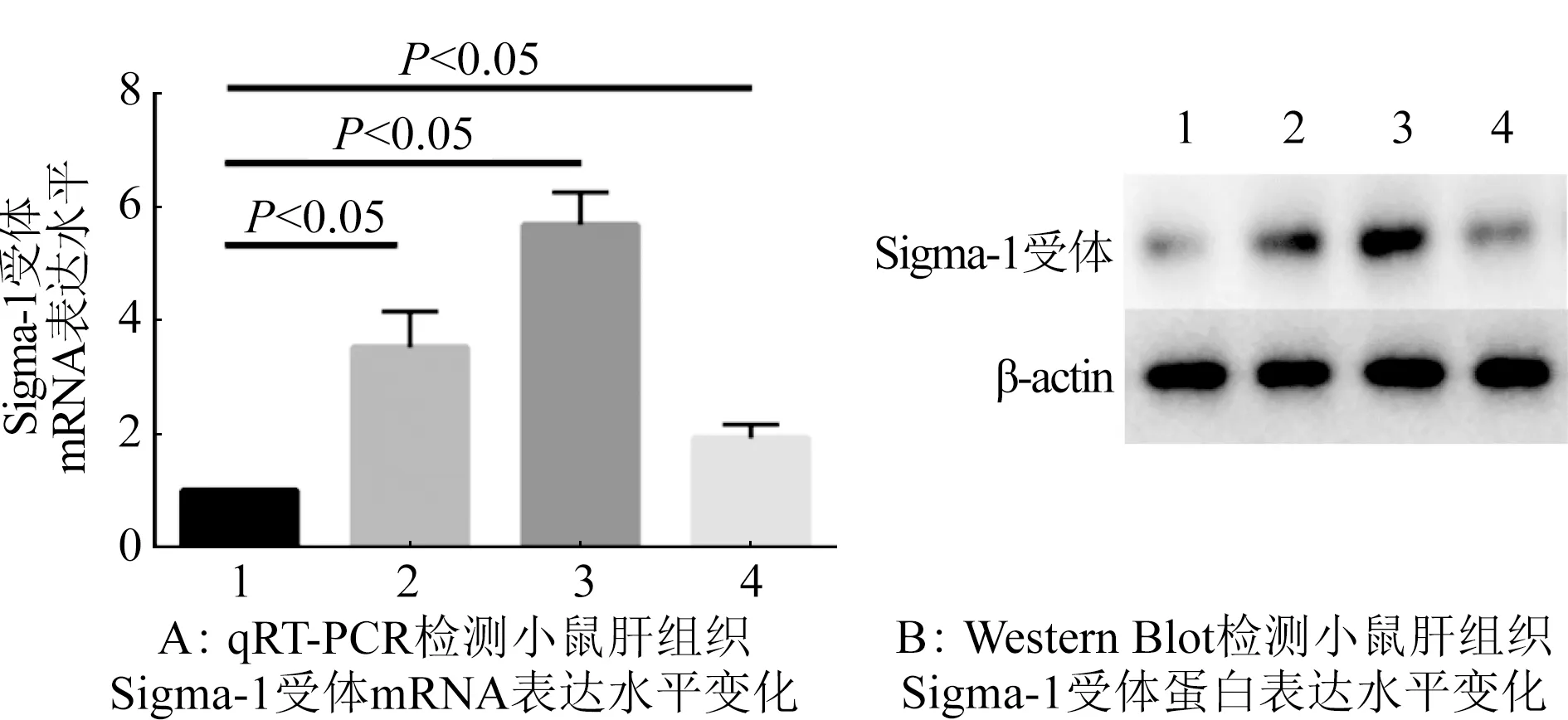
1.对照组;2.肝缺血再灌注6 h组;3.肝缺血再灌注12 h组;4.肝缺血再灌注24 h组图1 小鼠肝缺血再灌注后Sigma-1受体mRNA和蛋白表达变化
2.2 Sigma-1受体激动剂和抑制剂预处理对小鼠肝功能损伤影响 对照组小鼠未见肝小叶结构明显异常,未发现明显肝细胞坏死及炎症细胞浸润,血清ALT及AST水平较低。同缺血再灌注组比较,Sigma-1受体激动剂组血清ALT及AST水平明显降低,差异比较具有统计学意义(P<0.05)。Sigma-1受体激动剂组预处理后,可观察到小鼠肝窦区变窄程度降低,炎症细胞浸润较少,肝细胞坏死程度降低。Sigma-1受体激动剂加抑制剂组小鼠血清ALT及AST水平高于Sigma-1受体激动剂组(P<0.05)。Sigma-1受体激动剂加抑制剂组肝组织损伤程度较Sigma-1受体激动剂组明显加重(表2、图2)。
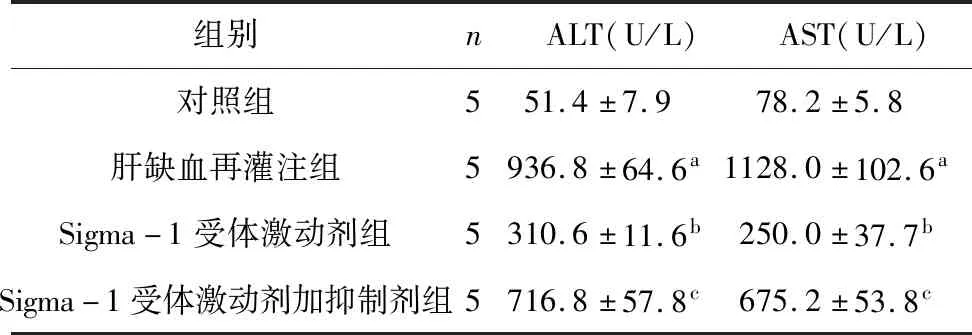
表2 小鼠血清ALT、AST水平变化
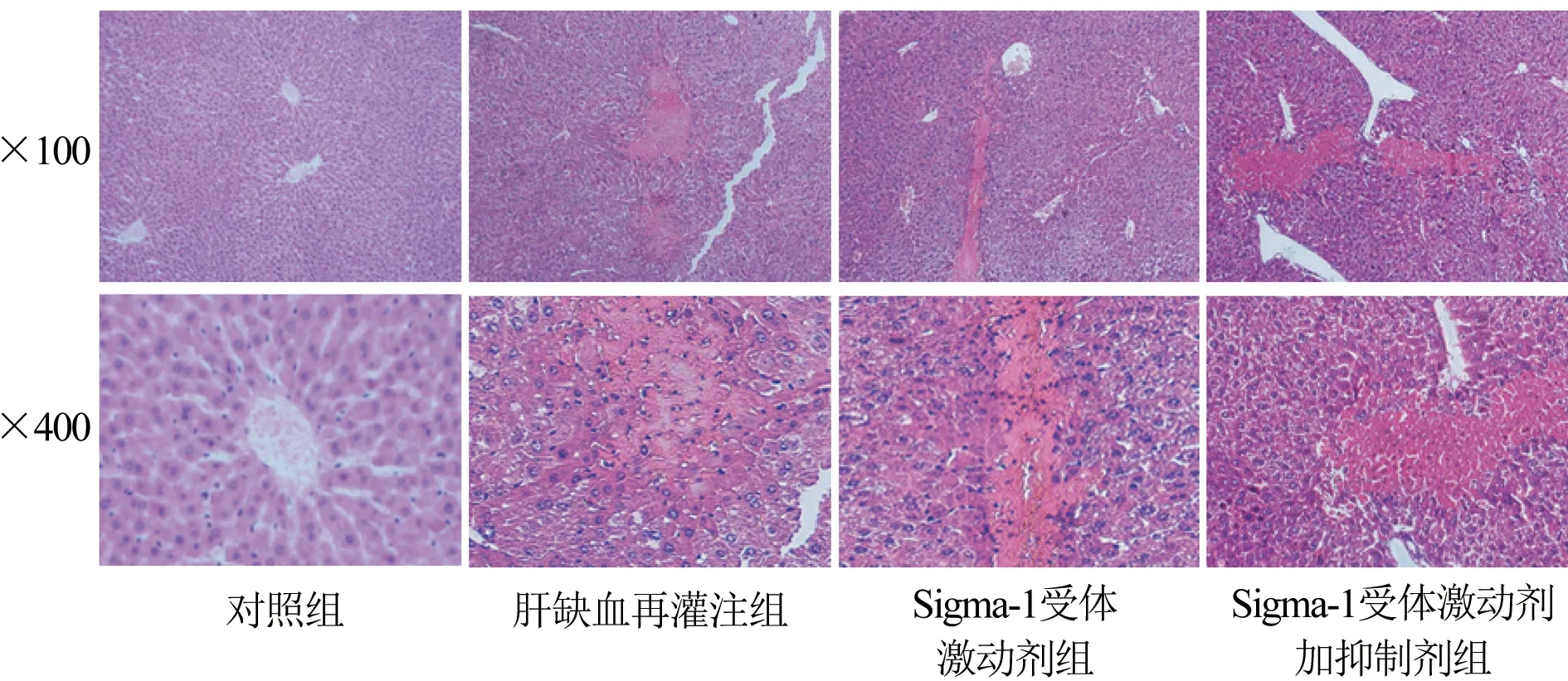
图2 小鼠肝组织病理学变化
2.3 Sigma-1受体激动剂和抑制剂预处理对小鼠肝组织细胞因子表达及血清细胞因子水平的影响 结果显示经Sigma-1受体激动剂PPBP预处理后,小鼠肝组织TNF-α、IL-6 mRNA表达水平低于缺血再灌注组,IL-10 mRNA表达水平高于缺血再灌注组(P<0.05)。激动剂组小鼠血清TNF-α、IL-6水平低于缺血再灌注组,血清IL-10水平高于缺血再灌注组(P<0.05)。Sigma-1受体激动剂加抑制剂组小鼠肝组织TNF-α、IL-6 mRNA表达水平高于Sigma-1受体激动剂组,IL-10 mRNA表达水平较Sigma-1受体激动剂组降低(P<0.05)。同Sigma-1受体激动剂组比较,Sigma-1受体激动剂加抑制剂组小鼠血清TNF-α、IL-6水平升高,IL-10水平降低(P<0.05)。图3,表3。
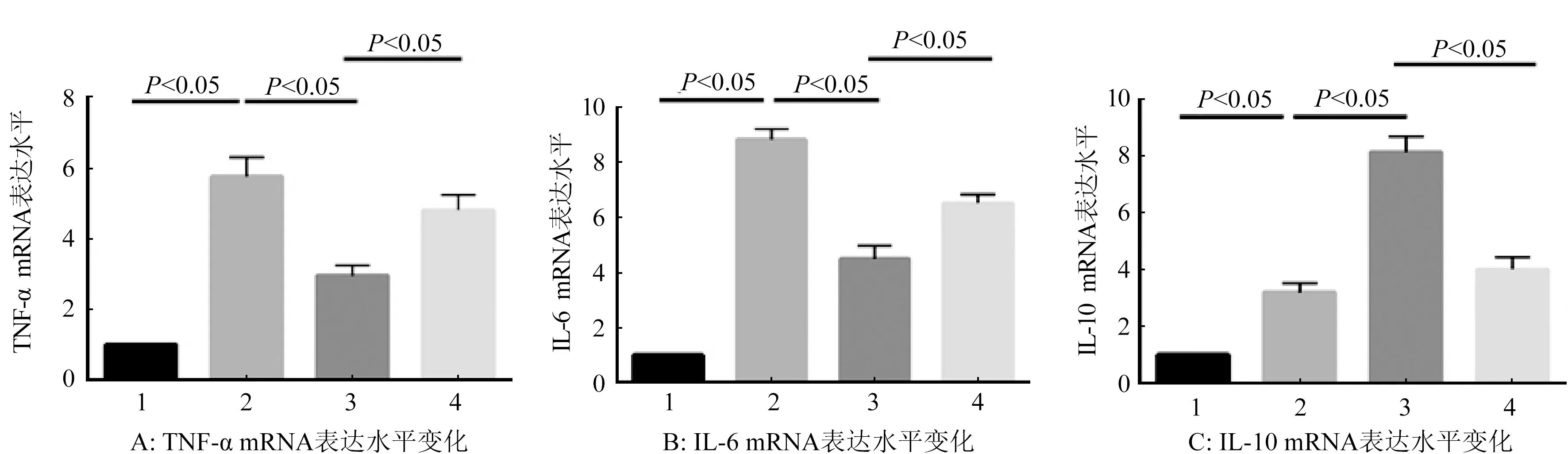
1.对照组;2.肝缺血再灌注组;3.Sigma-1受体激动剂组;4.Sigma-1受体激动剂加抑制剂组图3 小鼠肝组织细胞因子mRNA表达变化

表3 各组小鼠血清TNF-α、IL-6和IL-10水平变化
3 讨论
肝脏缺血再灌注损伤是肝部分切除、肝移植等肝胆外科手术中常见的组织器官损伤,是涉及氧化应激、凋亡、炎症反应等多因素的复杂病理过程。近年来的研究表明促进Sigma-1受体活化可减轻多种缺血再灌注损伤,发挥良好的保护作用。Gao等[13]研究表明Sigma-1受体激动剂PRE-084可通过抑制细胞凋亡而减轻心脏缺血再灌注损伤。另有研究表明促进Sigma-1受体活化可增强eNOS活性进而增加NO含量,发挥肾保护作用[14]。Sigma-1受体激动剂PPBP可减少大鼠脑缺血时皮质梗死体积,发挥神经保护作用[15]。因此,Sigma-1受体是否参与肝缺血再灌注损伤,改变Sigma-1受体的表达是否能够减轻肝缺血再灌注损伤,引起我们的关注。本研究发现Sigma-1受体表达量在缺血再灌注6 h开始升高,再灌注12 h Sigma-1受体表达升高最明显,表明Sigma-1受体可能参与肝缺血再灌注损伤的发展。
为明确Sigma-1受体表达变化对肝缺血再灌注损伤的影响,分别通过Sigma-1受体特异性激动剂及抑制剂处理小鼠,观察到促进Sigma-1受体活化后,肝组织TNF-α、IL-6 mRNA表达水平下降,IL-10 mRNA表达水平升高。血清TNF-α和IL-6水平下降,IL-10水平升高,血清ALT及AST水平降低,提示Sigma-1受体激动剂预处理可抑制炎症反应而减轻肝功能损伤。研究表明Kuppfer细胞在肝缺血再灌注过程中激活后,可通过产生包括TNF-α、IL-6在内的促炎细胞因子损伤肝组织[5]。IL-10是抑制炎症反应的重要细胞因子,可有效抑制TNF-α和IL-6等促炎细胞因子的产生[16]。在肝缺血再灌注中发现IL-10具有抑制炎症反应、保护肝组织的作用。Dinant等[17]研究表明IL-10可以抑制IL-6的产生,并能促进肝细胞的增殖而减轻肝缺血再灌注损伤。Yoshidome等[18]研究发现IL-10可抑制TNF-α的表达抑制肝缺血再灌注损伤。Bourrie等[19]研究发现促进Sigma-1受体活化可抑制炎症反应,增强IL-10的表达和产生,抑制TNF-α的表达和产生,从而抑制炎症反应。Bourrie等[20]利用Sigma-1受体激动剂SSR125329A预处理小鼠,可提高抑炎细胞因子IL-10并降低小鼠血清促炎细胞因子TNF-α的水平,发挥抗炎作用。因此,我们推断Sigma-1受体活化后可能促进IL-10的表达和产生,IL-10可以抑制TNF-α、IL-6表达和产生,有效抑制炎症反应,从而减轻肝损伤并改善肝功能。促进Sigma-1受体活化产生的保护作用可能与调节细胞因子表达和抑制炎症反应相关。
综上所述,本研究发现小鼠肝缺血再灌注模型中Sigma-1受体表达升高,提示Sigma-1受体可能在肝缺血再灌注损伤具有重要调节作用。通过Sigma-1受体激动剂预处理小鼠促进Sigma-1受体活化可降低炎症反应,进一步降低肝缺血再灌注损伤。因此,研究新型Sigma-1受体激动剂,促进Sigma-1受体活化,有助于减轻肝缺血再灌注损伤,为防治肝缺血再灌注损伤提供新思路。本研究从炎症反应的角度对Sigma-1受体活化可减轻肝缺血再灌注损伤进行初步研究,但对Sigma-1受体活化是调控哪些信号通路减轻肝缺血再灌注损伤并不清楚,需要进一步的研究。
