人CD147胞内结构域蛋白的表达与纯化
2019-12-23李佳悦刘芬玲崔洪勇
吴 东,南 刚,李佳悦,刘芬玲,崔洪勇
CD147是Ⅰ型跨膜蛋白,属于免疫球蛋白超家族。CD147在正常组织及胚胎组织中低表达,在上皮来源的癌组织中高表达,与肿瘤发生发展密切相关,是一个癌特异性的、新型广谱的肿瘤标志物[1]。诱导肿瘤细胞以及成纤维细胞分泌基质金属蛋白酶(matrix metalloproteinases,MMPs)是CD147最主要的功能之一[2],体内外实验表明,CD147能够促进肿瘤的侵袭和转移[3]。研究证实,CD147能够调节肿瘤细胞间充质样运动形式和阿米巴样运动形式的转换[4-5],调控肿瘤细胞的代谢和自噬[6-7]。此外,多发性骨髓瘤细胞表面的CD147能够作为骨髓内皮细胞分泌的亲环素(cyclophilin A,CyPA)的受体促进多发性骨髓瘤细胞增殖和归巢[8],胰腺癌细胞表达的CD147与CyPA结合能够促进胰腺癌进展[9],但是CD147诱导MMPs分泌、调控肿瘤侵袭转移的分子机制尚未阐明,尤其是CD147胞内结构域(CD147 intracellular domain,CD147ICD)的生物学功能和分子机制鲜见报道。
CD147分子全长269个氨基酸,N端21个氨基酸为信号肽,参与CD147分子的生物合成和转运,信号肽之后的185个氨基酸为胞外段,接下来的24个氨基酸为跨膜区,胞内结构域由C端39个氨基酸构成。CD147胞外段包含2个Ig样结构域,N端为C2结构域(2~101位氨基酸),C端为I样结构域(107~205位氨基酸),2个Ig样结构域之间由5个氨基酸连接。CD147跨膜区序列在人、小鼠和鸡之间完全保守,提示跨膜区有重要生理功能。CD147ICD在种属之间也高度保守,提示胞内结构域可能参与介导细胞外信号向细胞内的传递[10]。本实验室先后解析了CD147胞外段2.0Å晶体结构[11]和CD147胞外段与CyPA相互作用的液相结构[12],但CD147ICD的互作分子及蛋白质结构知之甚少。本研究通过构建CD147ICD重组质粒并制备纯化CD147ICD,为CD147ICD互作分子的鉴定和蛋白质结构解析提供研究基础。
1 材料与方法
1.1 材料 Premix PrimeSTAR DNA聚合酶、DNA限制性内切酶、连接酶购自宝日医生物技术(北京)有限公司;DH5α、Origami B(DE3)感受态细胞购自天根生化科技(北京)有限公司;二硫苏糖醇(dithiothreitol,DTT)、异丙基硫代-β-d-半乳糖苷(isopropyl-β-d-thiogalactoside,IPTG)购自美国Sigma公司;蛋白酶抑制剂购自瑞士罗氏公司;凝血酶购自Solarbio公司;Ni-Sepharose FF预装柱购自美国GE公司;引物由华大基因合成;3 KD超滤管、10 KD超滤管购自美国Millipore公司;BCA蛋白质定量试剂盒购自美国Pierce公司;其他试剂均购自生工生物工程(上海)股份有限公司。
1.2 重组质粒的构建和鉴定 以人cDNA为模板,PCR扩增CD147ICD片段(上游引物:5′-TGGGTACCATGAAGCGCCGGAAGCCCGAG-3′,下游引物:5′-CAGATATCTCAGGAAGAGTTCCTCTGGC-3′;反应条件:98 ℃ 10 s,68 ℃ 10 s,30个循环),经KpnⅠ/EcoRⅤ双酶切后连接入pET-32a(+)质粒,将连接混合物转化DH5α感受态细胞,挑取克隆后进行测序分析。取10 ng重组质粒pET-32a(+)/CD147ICD转化Origami B(DE3)感受态细胞,挑取克隆经酶切鉴定后冻存保种。
1.3 蛋白的表达和纯化 接种5 μL pET-32a(+)/CD147ICD/Origami B菌液至5 mL Amp+/Kan+/Tet+LB培养基中,37 ℃振荡培养过夜。转接5 mL培养过夜的pET-32a(+)/CD147ICD/Origami B菌液至500 mL Amp+/Kan+/Tet+LB培养基中,37 ℃振荡培养6~7 h后(OD600=0.6),加入500 μL 1 mol/L IPTG,37 ℃振荡培养2~5 h。6 000 r/min离心6 min 收集菌体,Ni-NTA A液重悬洗涤1次,-80 ℃冻存。室温融解菌泥,加入8 mL含蛋白酶抑制剂的Ni-NTA A液,振荡重悬。冰浴超声裂解细胞,300 W,5 s/10 s,30 min。12 000 r/min 4 ℃离心15 min,取上清。采用快速蛋白液相色谱系统AKTA FPLC GE-048,Ni-Sepharose FF预装柱进行蛋白纯化,流速1 mL/min,30 min梯度洗脱,洗脱峰用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulphate-polyacrylamide gel electrophoresis,SDS-PAGE)鉴定组分和纯度。采用凝血酶20 ℃酶切过夜,经10 KD超滤管去除凝血酶后,用3 KD超滤管换液并浓缩目的蛋白。采用SDS-PAGE鉴定CD147ICD蛋白纯度。
2 结果
2.1 CD147ICD重组质粒的DNA测序 提取pET-32a(+)/CD147ICD质粒(图1),经KpnⅠ/EcoRⅤ双酶切后在100 bp DNA ladder上方可见较弱的CD147ICD基因片段,大小符合预期(图2);测序结果如图3,经序列比对,插入序列正确,无碱基突变和移码突变,证明CD147ICD重组质粒构建成功。
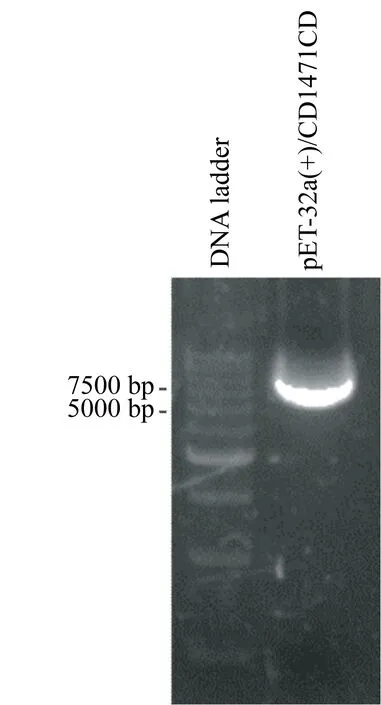
图1 琼脂糖电泳鉴定pET-32a(+)/CD147ICD质粒

图2 酶切鉴定pET-32a(+)/CD147ICD质粒
图3 DNA测序鉴定重组质粒
2.2 TrxA-His6-CD147ICD融合蛋白的表达和纯化 经ExPASy在线工具预测TrxA-His6-CD147ICD融合蛋白的分子量是20.93 KD。采用37 ℃,1 mmol/L IPTG分别诱导2、3、4、5 h。SDS-PAGE电泳结果显示,与未诱导组相比,IPTG诱导2 h后重组菌即可大量表达分子量约为20 KD的目的蛋白(图4)。经超声破碎裂解,高速离心后取上清进行Ni2+亲和层析,纯化得到重组TrxA-His6-CD147ICD蛋白。
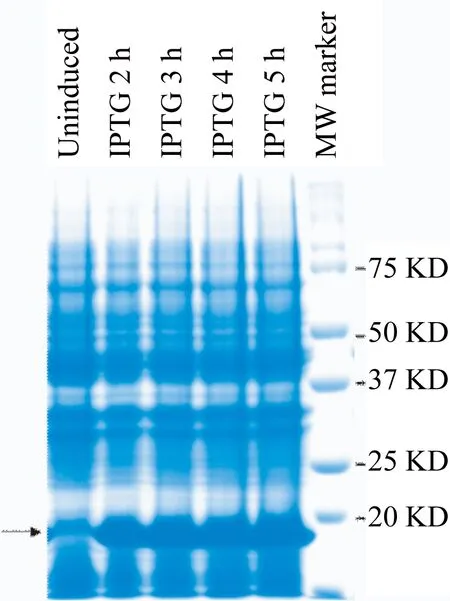
图4 SDS-PAGE鉴定TrxA-His6-CD147ICD融合蛋白的表达水平
2.3 酶切、纯化CD147ICD蛋白 经ExPASy在线工具预测,凝血酶酶切后CD147ICD融合蛋白的分子量是7.01 KD。采用凝血酶20 ℃酶切过夜后,经10 KD超滤管去除凝血酶,用3 KD超滤管换液并浓缩CD147ICD蛋白。SDS-PAGE电泳结果显示,纯化后的CD147ICD蛋白在预期分子量7 KD处可见特异性条带,蛋白纯度在95%以上(图5)。采用BCA蛋白定量试剂盒测定纯化后的CD147ICD蛋白浓度,经计算其蛋白浓度为0.74 mg/mL。
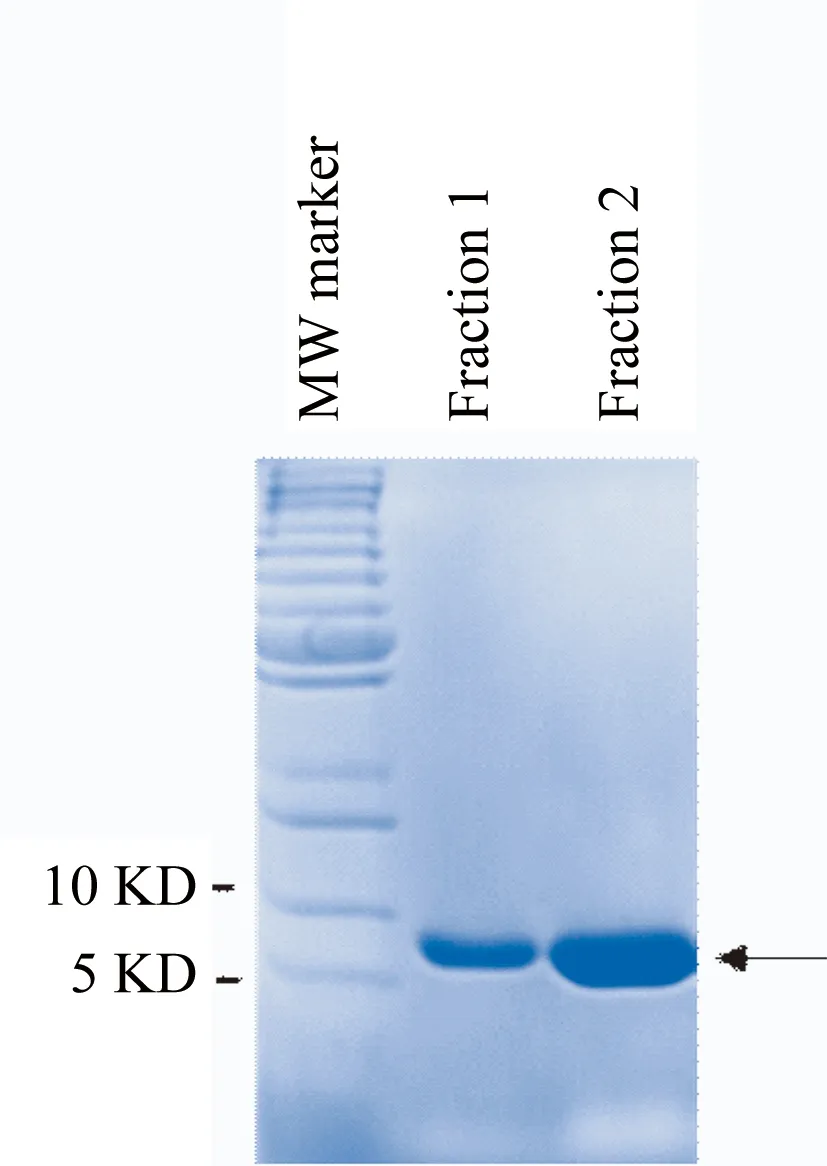
图5 SDS-PAGE鉴定纯化的CD147ICD蛋白
3 讨论
肿瘤相关抗原CD147在肺癌、肝癌等恶性肿瘤组织中高表达,靶向CD147的肝癌抗体药物“利卡汀”已批准上市,取得了良好的治疗效果[13]。本实验室前期的研究发现,CD147能够负性调控NO/cGMP介导的细胞钙内流,促进MMP2和MMP9的分泌和活化,继而促进了肿瘤细胞的侵袭和转移,上述作用需要该分子胞内外结构的完整性,其中缺失胞内结构域的CD147对肝癌细胞MMPs分泌、侵袭的调控功能缺失[14],提示CD147ICD在促进MMPs分泌、调控肿瘤侵袭和转移中也发挥重要作用。Hibino等[15]研究发现,S100A9能够结合于黑色素瘤细胞表面的CD147,促进CD147ICD募集TRAF2,进而促进Cdc42活化和肿瘤侵袭转移,但是CD147与其配体S100A9结合后是如何调控其胞内段募集TRAF2的仍不清楚[16]。目前,针对CD147分子的研究主要集中于胞外段,CD147ICD参与信号转导的分子机制尚不明确,CD147ICD的互作分子鲜见报道。缺乏高纯度的CD147ICD蛋白是制约CD147ICD互作分子鉴定及蛋白质结构解析的重要因素。本研究采用大肠杆菌表达系统对CD147ICD实现高效表达,制备纯度较高的CD147ICD蛋白,为后续制备CD147ICD单抗或多抗、筛选CD147ICD互作分子、解析CD147ICD结构提供基础。
利用PCR扩增得到全长为117 bp的CD147ICD基因,将其连接到pET-32a(+),获得pET-32a(+)/CD147ICD重组质粒,将其转化Origami B(DE3)感受态细胞,重组菌能够表达20.93 KD的TrxA-His6-CD147ICD融合蛋白,利用Ni-NTA亲和层析法纯化后,采用凝血酶酶切去除TrxA-His6标签,获得纯度约为95%的CD147ICD蛋白,蛋白浓度为0.74 mg/mL。
