坚果壳色素的提取和抗氧化作用研究
2019-12-21李利红李先芳赵建平赵月
李利红 , 李 凯, 李先芳, 赵建平, 赵月
(1.河南牧业经济学院制药工程学院,河南郑州450046;2.河南省畜牧总站,河南郑州450011)
坚果壳如板栗壳、 核桃壳等来源于农产品和食品废弃物,价格低廉,坚果壳提取物以天然色素为主,大都属于多酚类化合物,性质稳定,具有较好的清除自由基和维护心血管系统健康的能力,同时还有抑菌活性。因此,深入研究开发坚果壳提取物作为新型绿色饲料添加剂, 在畜牧养殖中具有广阔的发展前景。
本试验旨在通过比较研究不同提取工艺下核桃壳和板栗壳提取物的得率、主要成分含量、清除DPPH 自由基的能力,选取较优者,研究其对酒精造成的小鼠肝损伤的保护作用, 以期为后期开发具有促生长和应激保护作用的坚果壳提取物饲料添加剂提供借鉴。
1 材料与方法
1.1 材料 核桃和板栗均购自农贸市场,剥肉取壳备用。
1.2 仪器与试剂
1.2.1 仪器 超声波清洗仪(KQ3200E 型,昆山市超声仪器有限公司); 旋转蒸发仪 (R-1001-VN, 郑州长城科工贸有限公司); 台式离心机(X1R,Thermo);紫外分光光度计(Y1702,上海菁华科技仪器有限公司); 万分之一天平(BT125D,赛多利斯);电子天平(BSA224S-CW,赛多利斯科学仪器有限公司);立式高压灭菌锅(LDZM-60K,上海审安医疗器械厂);超净工作台(JH-SCB,上海鸿都电子科技有限公司); 生化培养箱 (SPX-300BSH-, 上海新苗医疗器械制造有限公司);台式冷冻恒温振荡器(THZ-Q,太仓市华美生化仪器厂);Varioskan 多功能酶标仪 (Thermo);H.H.S 电热恒温水浴锅(上海医疗器械五厂);快速混匀器(XK96-B,姜堰市新康医疗器械有限公司)等。
1.2.2 试剂 乙醇、氢氧化钠、没食子酸(萨恩化学技术(上海)有限公司)、冰乙酸和无水乙醇等均为分析纯。 芦丁标准品(中国食品药品检定研究所,纯度98%)。DPPH 自由基粉末(SIGMA);维生素C 片(华中药业股份有限公司)。 谷胱甘肽过氧化物酶(GSH-Px)测试盒(20180309,南京建成生物工程研究所,其他同);过氧化氢酶(CAT)测试盒(20180312);总超氧化物歧化酶(T-SOD)测试盒(20180425); 丙 二 醛 (MDA) 测 试 盒(20180426);蛋白质定量测试盒(20180421);双蒸水等。
1.2.3 试验动物 无特定病原体的雄性老年KM小鼠,体重为20 ~35 g,由河南牧业经济学院药理实验室提供。
1.3 方法
1.3.1 壳色素提取 通过超声辅助碱法工艺条件(10 倍量pH 9 的碱水,35 ℃超声提取30 min) 和超声辅助乙醇法提取工艺(8 倍量30%乙醇,25 ℃超声提取40 min) 进行壳色素的提取。 提取物干燥,称重(m,g)。

1.3.2 提取物主要成分含量测定 总酚含量根据2010 版《药典》中福林-酚法测定;总黄酮含量用NaNO2-Al(NO3)3比色法测定(汪秀妹,2013)。
1.3.3 体外抗氧化活性的测定
1.3.3.1 DPPH 自由基溶液的配制 根据余兰斌(2016) 方法进行体外抗氧化活性的测定。 称取DPPH 自由基粉末, 用无水乙醇溶解配制成浓度为0.2 mmol/L,避光保存,作为母液。 将母液稀释为0.05 mmol/L,将此浓度作为DPPH 自由基溶液的初始浓度。
1.3.3.2 样品母液的配制 称取0.5 g 壳提取物,置于250 mL 锥形瓶中, 量取200 mL 蒸馏水加入,使其溶解并作为样品母液。
1.3.3.3 样品溶液的配制 取DPPH 溶液2.0 mL,缓慢加入少量样品母液,边加边摇匀,观察溶液颜色的变化,当颜色基本褪去时,记下样品的用量,即为样品的最大用量。在不超过此最大量的基础上,设置不同的稀释浓度梯度,最少5 个梯度,即为样品溶液。
1.3.3.4 DPPH 自由基清除试验 2.0 mL 不同浓度的样品及2.0 mL DPPH 自由基 (初始浓度)的混合液作为样品组,加入5 mL 离心管中,摇匀,室温下密闭静置20 min, 于517 nm 波长下用多功能酶标仪测定吸光值,记为A 样品,以2.0 mL溶剂和2.0 mL 自由基混合液作为对照组,测得吸光度值为A对照,以2 mL 样品和2 mL 无水乙醇混合液作空白组,测得吸光值为A空白。以Vc 为阳性对照。

按照袁亚男(2009)方法,计算IC50(即自由基清除率为50%时的浓度)。
1.3.4 体内抗氧化活性测定
1.3.4.1 试验动物及饲养管理 选取100 只无特定病原体的雄性老年小鼠,按照体重均衡将其随机分成5 组(蒸馏水组,Vc 组, 三个提取物添加组),每组20 只。 参考李晓明(2012)方法,其中提取物添加组按照低剂量(4.0 mg/mL),中剂量(8.0 mg/mL),高剂量(16.0 mg/mL)灌胃,Vc 组参照提取物的中浓度剂量灌胃,各组均饲喂基础饲料,让其自由饮水,所有组每天定时经口灌胃1 次。灌胃剂量为0.1 mL/10 g。 连续灌胃21 d。
1.3.4.2 小鼠急性酒精性肝损伤模型的建立 将每组小鼠再分成两部分(酒精组和对照组),酒精组按照体重以0.1 mL/10 g 的量灌服62.5%的酒精(储兰兰,2017),对照组不灌服酒精,照常喂养。灌胃后禁食不禁水6 h。
1.3.4.3 肝匀浆的制备及蛋白质含量的测定 灌服酒精6 h 后,处死小鼠并迅速取出肝脏,按照总超氧化物歧化酶测试盒说明书上的方法操作,制备10%的肝组织匀浆,并按照说明书上操作用酶标仪测定吸光度值。 被测样品的蛋白质浓度计算公式如下:
待测样本蛋白质浓度/(g prot/L)=(测定OD值-空白OD 值)/(标准OD 值-空白OD 值)×标准品浓度(0.563 g/L)×样本测定前稀释倍数。
1.3.4.4 肝组织中酶活力和丙二醛含量的测定按照各试剂盒说明书上的方法操作, 计算GSHPx、CAT、T-SOD 活力和MDA 含量。
组织GSH-Px 活力/(U/mg prot)=(非酶管OD值-酶管OD 值)/(标准管OD 值-空白管OD 值)×标准管浓度×稀释倍数/反应时间/取样量×样本蛋白质含量);
组织匀浆中CAT 活力/(U/mg prot)=(对照OD 值-测定OD 值)×271×1/(60×取样量)×待测样本蛋白质浓度/(mg prot/mL);
式中:271 为斜率的倒数。
T-SOD 活力/(U/mg prot)=(对照OD 值-测定OD 值)/对照OD 值/50%×反应液总体积(mL)/取样量(mL)/待测样本蛋白质浓度(mg prot/mL);
组织中MDA 含量/(nmol/mg prot)=(测定OD值-对照OD 值)/(标准OD 值-空白OD 值)×标准品浓度(10 nmol/mL)/待测样本蛋白质浓度(mgprot/mL)。
1.4 数据处理 试验数据用Excel 软件进行处理。
2 结果与分析
2.1 提取方法及含量测定结果 由表1 可知,本试验中超声辅助碱法(pH=9)下核桃壳和板栗壳色素的提取得率分别为6.15%、6.52%, 超声辅助醇(30%)法下核桃壳和板栗壳色素的提取得率分别为5.56%、5.66%; 两种壳色素均以碱法提取得率高;无论碱法还是醇法,均以板栗壳色素的提取得率高于核桃壳色素得率。
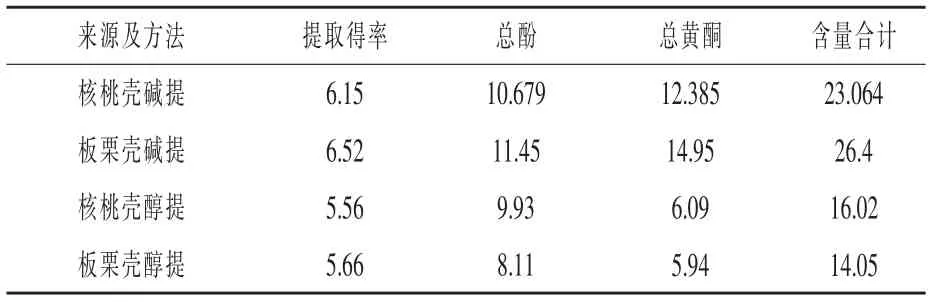
表1 板栗壳和核桃壳色素提取结果比较%
壳色素中的总酚和总黄酮含量均以碱法高于醇法。 碱提法核桃壳色素的总酚和总黄酮含量分别为10.679%和12.385%; 醇提法核桃壳色素的总酚和总黄酮含量分别为9.93%和6.09%; 碱提法板栗壳总酚和总黄酮含量分别为11.45%和14.95%,醇提法板栗壳色素的总酚和总黄酮含量分别为8.11%和5.94%。
2.2 DPPH 清除试验结果 两种壳色素对DPPH自由基的清除率结果见表2 和表3。
经计算, 本试验核桃壳碱提色素的IC50 为23.6 μg/mL。 醇提色素的IC50 为159.156 μg/mL。板栗壳醇提色素的IC50 为1.482 mg/mL, 碱提色素的IC50 为2.2583 mg/mL。

表2 不同浓度的核桃壳色素对DPPH 自由基的清除率%

表3 不同浓度的板栗壳色素对DPPH 自由基的清除率%
虽然板栗壳提取得率高,主成分含量高,但是清除DPPH 自由基的能力不如核桃壳。 核桃壳碱提物清除DPPH 自由基的能力高于醇提物。
综合比较核桃壳和板栗壳色素的提取得率和体外清除DPPH 自由基的能力, 择优选取核桃壳碱提物进行体内抗氧化活性研究。
2.3 核桃壳色素对小鼠肝损伤的保护作用
2.3.1 核桃壳提取物对GSH-Px 活力的影响对10%肝组织匀浆的GSH-Px 活力的测定结果见表4。
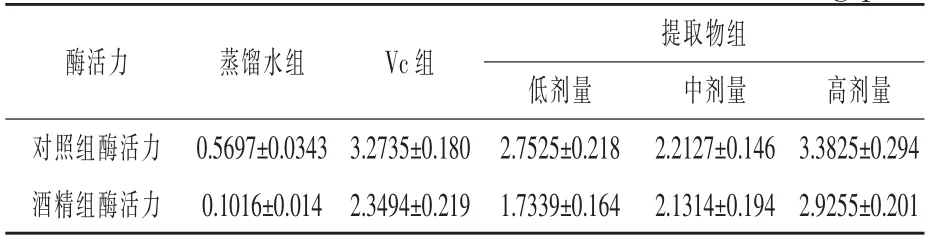
表4 小鼠肝脏中GSH-Px 活力测定结果U/mg prot
由表4 可看出, 未添加药物的蒸馏水组小鼠在酒精影响下, 肝脏中谷胱甘肽过氧化物酶的活力为0.1016 U/mg prot, 仅为对照组酶活力(0.5697 U/mg prot)的20%。因此,酒精造成了小鼠肝损伤,谷胱甘肽过氧化物酶活力急速下降。
添加Vc 和核桃壳提取物显著提高了小鼠肝组织的谷胱甘肽过氧化物酶活力; 降低了酒精对于小鼠肝脏酶活力的伤害。 核桃壳提取物高剂量组的酶活力高于Vc 组。
2.3.2 核桃壳提取物对小鼠CAT 活力的影响对10%肝组织匀浆CAT 活力的测定结果见表5。
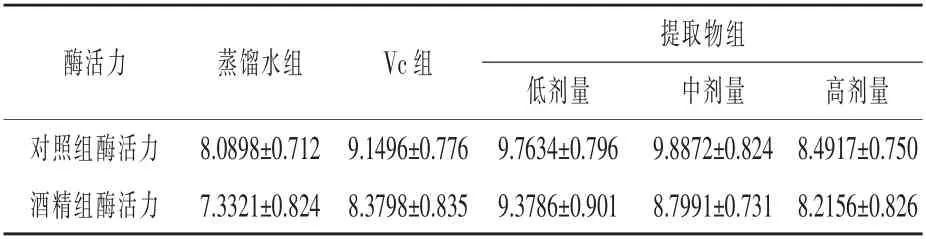
表5 小鼠肝脏中CAT 活力测定结果U/mg prot
根据表5 可以看出, 酒精处理降低了小鼠肝脏中过氧化氢酶的活力。Vc 和核桃壳色素提高了小鼠肝脏中过氧化氢酶活力,随着浓度的增加,核桃壳色素对过氧化氢酶活力的提高作用逐渐下降,高剂量下的酶活力最低,但仍比蒸馏水组高。核桃壳提取物低剂量和中剂量提高过氧化氢酶活力的效果比Vc 强, 而高剂量核桃壳提取物的作用不如Vc。
2.3.3 核桃壳提取物对小鼠T-SOD 活力的影响对10%肝组织匀浆超氧化物歧化酶活力的测定结果见表6。
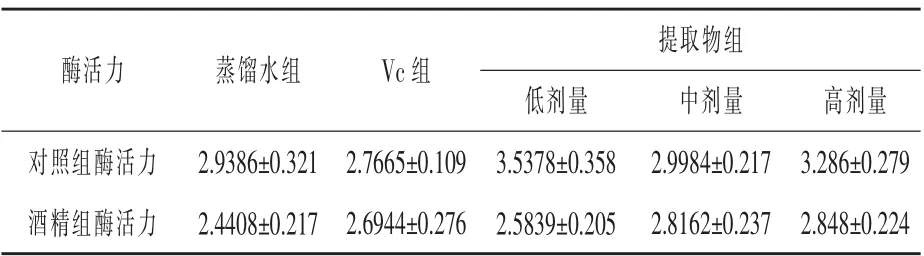
表6 小鼠肝脏中T-SOD 活力测定结果U/mg prot
由表6 可看出, 酒精处理造成了小鼠肝脏超氧化物歧化酶的活力下降,Vc 对小鼠肝脏超氧化物歧化酶的活力提高无效果, 但是仍然保护了酒精处理下的酶活力; 高剂量和低剂量色素提取物对小鼠肝脏超氧化物歧化酶的活力提高作用明显, 中剂量提取物虽然对酶活力的提高效果不明显, 但是对小鼠肝脏在酒精作用下酶活力降低的保护作用明显。
2.3.4 核桃壳提取物对小鼠MDA 含量的影响对10%肝组织匀浆MDA 含量的测定结果见表7。

表7 小鼠肝脏中MDA 含量的测定结果nmol/mg prot
根据表7 可知, 酒精处理造成了小鼠肝脏中MDA 含量增加。 Vc 和核桃壳提取物均降低了小鼠肝脏中的MDA 含量, 减少了酒精处理下MDA 含量的增加,保护了酒精处理下小鼠肝脏细胞的损伤。 高、中、低剂量组的MDA 含量均低于Vc 组,即保护作用均大于Vc 组。
3 结论与讨论
从提取方法而言, 两种壳碱提法的得率和主成分含量高于醇提法。 因此, 选择碱提为主要方法。 板栗壳色素的总酚和黄酮含量与提取得率均稍高于核桃壳色素得率, 但是清除DPPH 自由基的能力不如核桃壳,综合考虑成本,认为核桃壳色素更适于开发具有抗氧化作用的饲料添加剂。
乙醇浓度会影响坚果壳色素的抗氧化活性。本试验中板栗壳醇提物清除DPPH 自由基的能力高于碱提物。 戚建华等(2012)通过70%乙醇和pH 11 的氨水分别提取板栗壳色素,结果表明,醇法提取所得色素不如碱法提取所得色素的DPPH自由基清除能力强。 李莉(2011)研究表明,用1%氢氧化钠溶液和40%乙醇溶液分别提取板栗壳棕色素, 其清除DPPH 自由基能力由高到低依次是: 维生素C、 板栗壳醇提物、 板栗壳碱提物、BHT。 由于70%乙醇提取物的极性略小于40%乙醇提取物,因此认为,板栗壳色素中的抗氧化成分极性偏大。
核桃壳提取物的抗氧化活性与成分含量基本一致。本试验中,核桃壳碱提物中多酚和黄酮的含量及抗氧化活性均高于醇提物。 魏欢等(2018)研究结果表明,核桃叶75%乙醇提取物及其各萃取部分均表现出一定的抗氧化活性,其中乙酸乙酯、正丁醇的IC50 均高于Vc, 且多酚的含量和抗氧化能力呈现正相关关系。
本试验中, 酒精处理降低了小鼠肝脏中谷胱甘肽过氧化物酶、过氧化氢酶、超氧化物歧化酶的活力,提高了丙二醛含量,核桃壳提取物提高了酒精处理下小鼠体内的谷胱甘肽过氧化物酶、 过氧化氢酶、总超氧化物歧化酶活性,降低了丙二醛的含量, 因此核桃壳提取物对酒精引起的肝脏GSH-Px、CAT、T-SOD 活力的降低和MDA 含量的升高具有预防作用, 即核桃壳提取物对肝脏具有保护作用。总体来看,核桃壳提取物高剂量对肝脏具有较好的保护作用。 本试验结果对研究核桃壳的抗氧化活性及其作为饲料添加剂提供了基础。
