围绕核心素养的“以学定教”教学
2019-12-20陈晓勇

[摘 要]以《氯水的组成》的教学为例开展“以学定教”式教学,对以情境为线索、以知识为载体、以素养为目标的教学实践进行探索。
[关键词]核心素养;以学定教;教学实践;氯水的组成
[中图分类号] G633.8 [文献标识码] A [文章编号] 1674-6058(2019)32-0059-03
2018年1月16日,教育部发布了新的课程方案和课程标准。新的课程标准凝练了学科核心素养,明确了学生学习相应学科课程后应形成的正确价值观念、必备品格和关键能力。其中化学学科核心素养包含“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”“科学探究与创新意识”“科学态度与社会责任”五个方面的内容,体现了化学学科的本质特征。如何围绕学科核心素养,精选教学内容,创设真实情境,变革学习方式,将“立德树人”的根本任务真正落实到学校教育教学的具体实践中,是摆在一线教师面前的重要任务。
一、发展学生化学学科核心素养的教学模型
培养学生学科核心素养,需要让他们置身于各种复杂多样的真实情境中,在有意义的任务和活动中不断实践、反思、讨论和质疑,学会整合、应用已有知识与经验分析,解决各种复杂和陌生的问题。这就需要扬弃“知识取向、教师讲授,操练为主”的传统教学模式,转而追求以素养为本位、以学生为中心的、“自主—合作—探究”式的学习方式[1]。基于此,笔者开展了以情境为线索,以知识为载体,以素养为目标,以“以学定教”为主要教学方式的实践活动。
“以学定教”就是以学生的情况来确定教师教什么、怎么教以及教的程度,即教师要了解学生,知道学生已知什么、想知道什么、是怎样学习的,以便教师的教学更符合学生的实际,更有效[2]。据此,我们设计了如图1所示的教学模型。
图1反映了情境、知识、素养、教学方式这四者的关系。教师从学生的实际情况出发,创设能够激发学生学习兴趣的教学情境。教学情境可以由一个一个的问题串组成,通过问题串,引导学生开展深入而持久的学习。教学情境是学生开展学习的线索,如果只在课堂开始的时候用一下,线索就断了,学生学习的兴趣将难以持久,深入持久的学习活动就不容易发生。因此,一节课应尽可能由一个教学情境贯穿始终。学生在教师创设的情境中,不是简单地识记知识,而是运用知识去解决真实问题,在解决真实问题的过程中,学生的核心素养得到了发展。在这个过程中,教师要引导学生去思考、去合作、去探究,将学生的知识、能力、素养推上一个新的高度,实现学生的成长,为新一轮的“以学定教”做好准备。
二、发展学生化学学科核心素养的教学实践
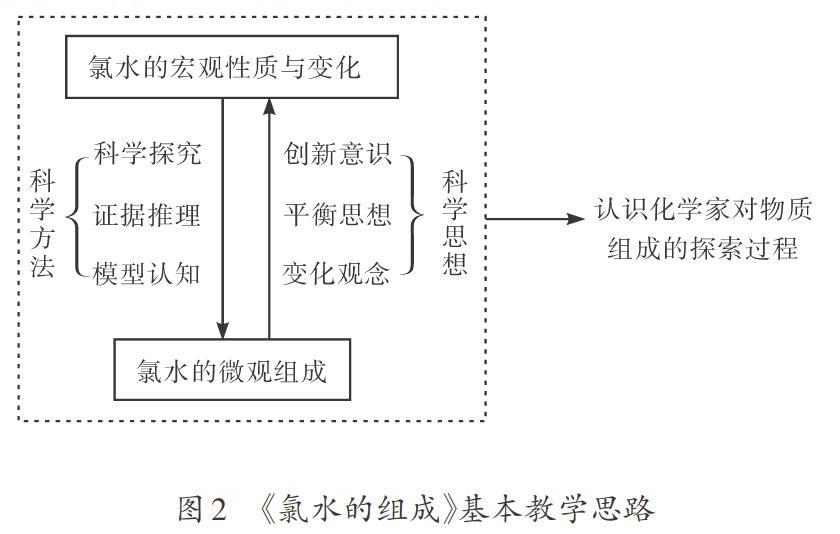
笔者以《氯水的组成》的教学设计和实施来展示如何在物质组成教学中发展学生的化学学科核心素养。“氯水”是学生进入高中以来学习的第一种较复杂的混合物,其物质成分较多,还存在着可逆反应,组成成分会随时间而变化。如何让学生正确认识到其中存在的各种微粒?这当然要通过实验来探究,即以实验中的宏观现象为证据,通过证据推理使宏观现象与微观粒子一一对应,形成逻辑关系。这个证据推理过程应该由学生通过独立思考或者相互合作来完成。在这个过程中学生运用各种科学方法,形成各种科学思想,进而发展化学学科核心素養。可以用图2来表示发展学生化学学科核心素养的《氯水的组成》基本教学思路。
【实验探究1】观察一瓶新制饱和氯水的颜色,并与氯气比较,推测氯水中可能存在的微粒。
面对这样一个简单的问题,许多学生无法做出“氯水中含有Cl2分子”的推断,说明在学生的思维中,宏观现象与微观粒子之间的逻辑联系比较薄弱,亟待发展学生的“宏观辨识与微观探析”素养。宏观物质是微观粒子的聚集体,物质的宏观性质是若干微观粒子性质的综合表现。虽然我们无法真切地看见微观粒子,但是我们可以通过物质的宏观性质来“推断”单个或几个微观粒子的行为表现,这个过程体现的是“宏观辨识与微观探析”的研究范式。氯气是黄绿色的,说明氯气中含有黄绿色的微观粒子,而氯气是Cl2分子的聚集体,可以推断出Cl2分子是黄绿色的。氯水是Cl2分子分散在水中形成的分散系,氯水呈浅黄绿色,说明氯水中含有Cl2分子。学生查阅教材不难发现,常温下,1体积水能溶解2体积氯气[3],按照这一观点,饱和氯水的颜色应该比氯气深。而现在学生看到的氯水是“浅”黄绿色,比氯气颜色浅,这是为什么呢?学生预测,氯水中的Cl2分子可能发生了反应。那么,可能发生哪些反应?如何来证明呢?
【实验探究2】氯水中加入硝酸银,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解。
大多数学生都能推断出氯水中含有Cl-离子,但也就到此为止了,基本上还不会运用氧化还原的原理进行更深入的分析判断。从Cl2分子到Cl-离子,有新物质(Cl-离子)出现,说明发生了化学反应,而且是氧化还原反应,其中氯元素化合价降低。化合价有降必有升,那么化合价升高的物质是什么呢?
【实验探究3】将氯水滴在pH试纸上,黄色的pH试纸先变红后褪色。
pH试纸变红,说明氯水中含有H+离子。pH试纸褪色,说明氯水中含有能使pH试纸褪色的物质。使有机色素褪色的现象称之为漂白,pH试纸褪色就是一种漂白过程。因此在氯水中含有一种有漂白作用的物质,科学家最终证明,这种物质是次氯酸(HClO)。次氯酸中氯元素为+1价,即反应中化合价升高的物质。据此可以写出氯水中存在的反应:
Cl2+H2O=H-+Cl-+HClO
在氯水中,水分子要远远多于Cl2分子,随着反应的发生,溶液中Cl2分子应该会完全反应,溶液也应该是无色的。为什么氯水一直保持着浅黄绿色呢?
【实验探究4】一瓶NaClO溶液,一瓶盐酸溶液,然后分别取少许加入一个无色的试剂瓶中,稍作振荡,观察现象:瓶内迅速产生黄绿色气体,溶液呈浅黄绿色。
黄绿色的气体是氯气,这个实验说明盐酸可以和NaClO溶液反应,生成氯气。反应的过程为,盐酸先和NaClO反应生成HClO,然后盐酸再和HClO反应,生成氯气。通过这个实验,我们可以形成如下推断:氯气溶于水的过程中,氯气和水发生反应,生成盐酸、次氯酸,同时盐酸和次氯酸又可以反应生成氯气和水,导致氯水中的氯分子不能与水分子完全反应,使氯水呈现黄绿色。像这样在同一条件下,既可以正向进行,又可以逆向进行的反应,我们把它称为可逆反应。据此可以将氯气和水的反应改写为可逆反应:
Cl2+H2O[?]H++Cl-+HClO
学生观察到,从上课开始到现在,氯水的颜色似乎一直在变浅。那么,氯水中各种物质的组成是否也在改变呢?
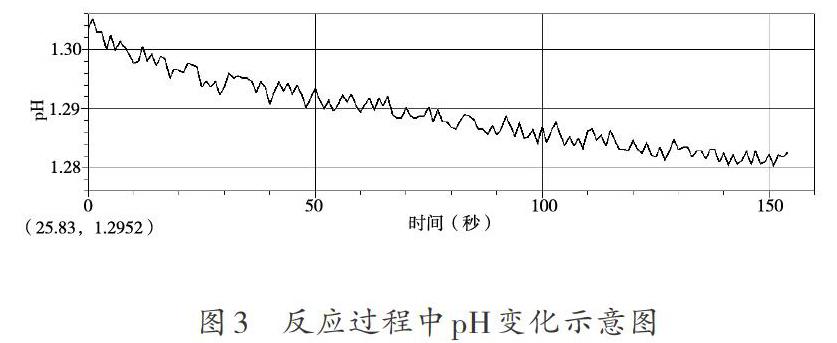
【实验探究5】用强光光照新制氯水,利用数字化传感技术对氯水的pH变化进行测定。实验数据记录如图3所示:
用强光光照氯水,利用数字化传感技术对氯水中的O2浓度变化进行测定。实验数据记录如图4所示:
观察光照后的氯水,颜色呈无色,说明在光照的过程中,溶液中的氯分子在不断地转化、减少,直至消失。光照氯水的过程中,H+、O2都在增加,而H2O在光照下不会分解,HCl、Cl2都不含氧元素,因此只有HClO有可能在光照下发生分解,生成O2和HCl,使溶液中的H+、O2增加。据此可以写出HClO分解的反应方程式:
2HClO=2H++2Cl-+O2↑
因为次氯酸的分解,导致氯水中次氯酸和盐酸的逆反应减少,而氯分子与水的反应仍在不断进行,最终溶液中的氯分子不断地减少,直至消失,所以光照后的氯水呈无色。
以上实验探究过程中,发展学生化学学科核心素养的过程可以整理如下表所示:
在这个过程中,学生通过实验探究,观察实验中的宏观现象,再通过证据推理、模型认知,得出氯水中的微粒组成,形成关于氯水中微粒组成的基本观念。学生形成观念以后,要对观念进行运用,才能使形成的观念得到巩固,即运用氯水中的微粒组成,来解释更多的宏观实验现象。可以用图5来表示学生物质组成观念的形成与巩固过程:
【实验探究6】取一定量的饱和氯水与CaCO3粉末混合,观察到少量气泡,氯水的黄绿色褪去,静置后取上层澄清溶液四份,分别进行以下实验:
①一份滴加盐酸,产生大量气泡;
②一份滴加NaOH溶液,出现白色沉淀;
③一份用酒精灯加热出现白色沉淀;
④将有色布条浸入第四份溶液,布条立即褪色。
由上述实验现象推测该澄清溶液的主要溶质是什么?
上层澄清溶液滴加盐酸产生大量气泡,这气泡一定是CO2气体,原澄清溶液中一定存在CO[2-3]或HCO[-3],但原澄清溶液中存在Ca2+,所以不可能存在CO[2-3],一定存在HCO[-3]。这样就可以解释实验②中,为什么滴加NaOH溶液会出现白色沉淀:OH-与HCO[-3]反应,生成CO[2-3],CO[2-3]再与Ca2+反应,生成CaCO3沉淀。也可以解释实验③为什么会出现白色沉淀:加热时,溶液中的Ca(HCO3)2分解,生成CaCO3沉淀。实验④说明原澄清溶液中存在HClO。那么氯水中的黄绿色是如何褪去的呢?氯水中的HCl和CaCO3粉末反应,生成Ca(HCO3)2,导致氯水中HClO和HCl的逆反应逐渐减少,最终氯水的黄绿色褪去。饱和氯水与CaCO3粉末发生反应的化学方程式为:2Cl2+2H2O+2CaCO3=Ca(HCO3)2+CaCl2+2HClO。
三、发展学生化学学科核心素养的教学反思
建立对宏观物质的微观认识,是学生形成对物质世界的科学认识的重要基础,是培养学生科学精神的重要内容,是中学化学教学的重要任务。学生通过科学探究、证据推理、模型认知等科学方法,透过物质的宏观现象认识物质的微观本质,在了解物质的微观本质的基础上,运用变化观念、平衡思想、创新意识等科学思想,在更高层次上理解物质的宏观现象。在这个不断循环往复的过程中,学生逐步深化了对物质在宏观、微观两个层面上的理解,学生的科学精神与社会责任逐渐得到了发展。可以用图6来表示高中化学物质组成教学中各化学学科核心素养之间的联系。
学生化学学科核心素养的形成,是化学基本知识和技能、化学思维方法与学科思想等长期共同作用的结果。化学学科核心素养不能通过大量记忆知识或反复训练技能来实现,而是通过大量感性材料的积累,不断思考、质疑和探究,然后抽象提炼形成理性经验,再将形成的经验规律用于指导学习实践,并在学习实践中不断巩固、完善和发展,最终才能成为自觉、科学的化学思维惯性[4]。
[ 参 考 文 献 ]
[1] 杨向东.如何基于核心素养设计教学案例[N].中国教育报,2018-05-30(5).
[2] 陈晓勇,梁杏娟.“以学定教,以教导学”在高中化学教学中的实践与反思[J].教学与管理,2014(1):57-58.
[3] 王祖浩.普通高中课程标准实验教科书·化學 (必修1) [M].南京:江苏教育出版社,2014.
[4] 尹庆后.核心素养要落地,学习方式必须变[N].中国教育报,2016-09-14(5).
(责任编辑 罗 艳)
