双液原电池盐桥的实验改进
2019-12-20杜爱萍芦琴燕
杜爱萍 芦琴燕

摘要:基于实验教学操作简便、直观明了的原则,作者对苏教版《化学反应原理》电化学专题中双液原电池的U型管盐桥进行了改进,分别得到了纸条状盐桥(包括滤纸条、棉布条以及湿纸巾)和琼脂块盐桥两种改进方案。对于前者,作者对纸条状盐桥的不同材质进行了导电性能对比;对于后者则进一步研究了琼脂块盐桥中KCl的浓度及琼脂块的厚度两个因素对双原液电池性能的影响,并从中得出了琼脂块盐桥制备的最优方案。
关键词:盐桥改进;电化学
文章编号:1008-0546(2019)11-0080-03
中图分类号:G633.8
文献标识码:B
doi: 10.3969/j.issn. 1008-0546.2019.11.022
一、问题提出
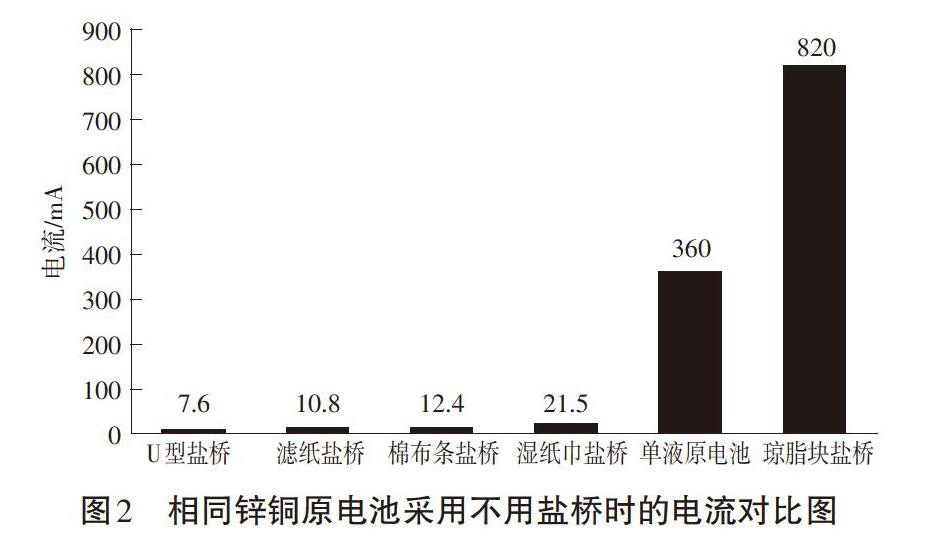
苏教版《化学反应原理》教材在第二单元“化学能与电能的转化”讲述原电池的工作原理时引入了盐桥的概念。由于单液锌铜原电池电流不稳定,故采用U型管盐桥构成双液原电池。盐桥的引入,意在获得平稳、持续而显著的电流。然而,在实际教学中则出现了以下两个问题:一是盐桥都是教师事先制备好的,学生对于U型管内的物质没有概念,不利于学生对盐桥真实结构及其工作原理的理解。二是在实际使用U型管盐桥时,发现其构成的双液原电池电流7.6mA,非常小,远小于相同条件下单液原电池的电流(360mA),这一实际情况与教材引入盐桥的出发点不尽相同,容易对教学造成一定的困扰。笔者针对在实际教学中的上述两个问题,对U型管盐桥进行了改进。
二、实验方案改进
为了实验的可对比性和数据的准确性,双液锌铜原电池的构成笔者均采用实验室普通且状况相同的锌片和铜片,锌片为负极,铜片为正极,负极池电解质溶液为1.Omol.L-1的ZnS04溶液,正极池为1.Omol·L-1的CuSO4溶液。原电池的电流均采用软件朗威8.0进行测定。
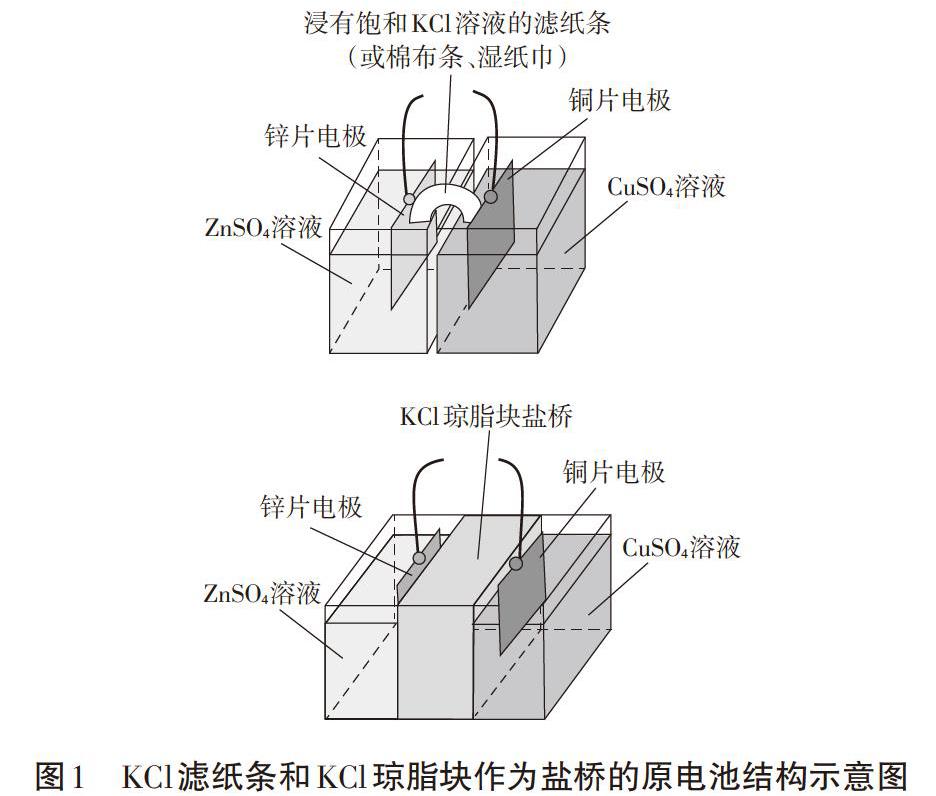
针对前述的问题一,笔者首先设计了滤纸条盐桥[1][2]:将滤纸折成约3.5cm×12cm x0.2cm的条状,室温条件下在饱和KCl溶液中浸泡一分钟,取出后代替U型管盐桥搭在正负极电解质池之间,两电极铜片、锌片与滤纸紧密接触,两电极之间距离为2cm,构成双液原电池(装置如图1(上)所示)。实验结果表明,在其他条件都相同的情况下,滤纸条盐桥构成的双液原电池所产生的电流为10.8mA,与U型管盐桥(7.6mA)相当。另外,笔者用相同大小的棉布条和湿纸巾(材料为无纺布)分别代替滤纸条重复实验,实验结果表明,相同情况下,棉布条和湿纸巾构成的原电池所产生的电流分别为12.4mA和21.5mA,由此可见,盐桥巾吸附KCl饱和溶液的材料不同,电池的放电效率也有所差异,其中湿纸巾(无纺布)的效果相对较好。通过查阅文献,笔者发现实际生产研究中,很多电池,如锂离子电池等,其电池内部就是采用与湿纸巾类似的无纺布材料作为正负极隔膜[3]。湿纸巾(无纺布)由于其材质较好的亲水性及材料较高的孔隙率,较滤纸条和棉布条对KCl溶液具有更好的亲液性和保液性,是离子的良导体,在电解液中电导率较高,从而相同条件下产生的电流更大。
纸条状盐桥(包括滤纸条、棉布条和湿纸巾)的优点在于可以直接在课堂上制作该盐桥,操作简便,学生可以通过对比发现湿纸巾(滤纸条或棉布条)与U型管盐桥中琼脂的作用类似,让学生更深入地理解盐桥的构成和工作原理。同时,借助有色离子在纸条上的定向迁移,学生可以直接观察到原电池内部阴、阳离子的迁移方向,让原电池内部工作原理可视化,使学生突破对原电池的学习难点。
针对问题二,笔者认为使用U型管盐桥后电流变小的主要原因可能有两个:一是U型管盐桥的路径太长,二是U型管管口与电解质溶液的接触面积太小,两者均导致双液原电池的内阻变大,故电流变小。基于上述分析,我们对盐桥做了以下改进:在1OOOmL沸水中先加入7g琼脂,加热使其完全溶解,再加入200g KCl固体,继续加热,直至KCl完全溶解,停止加热。等溶液冷却至50℃左右,趁热倒在一个矩形电解槽中,待冷却凝固后用小刀将装置内两边多余的琼脂除去,只留中间一堵厚度为3cm的“墙”,即形成了琼脂块盐桥4(如图1(下)所示)。改进后的盐桥路程较短,接触面积大大提高,在相同条件下产生的电流(820mA)远远大于U型管盐桥中的电流(7.6mA)。
笔者将几种原电池在相同情况下产生的电流进行了对比,结果如图2所示。从图中可以看出,琼脂块盐桥对应的电流远远大于U型管盐桥的电流,也远大于单液原电池的电流,同时电流稳定而持续,相比之下,纸条状盐桥(包括滤纸条、棉布条和湿纸巾)的电流较U型管盐桥没有太大的优势(湿紙巾盐桥相对较好,其电流是U型管盐桥的近3倍),但纸条状盐桥具有操作简便、学生观察直观且深入的优点,另外,若增加纸条(滤纸条、棉布条或湿纸巾条)的数目或加宽纸条两端与电解质溶液的接触面积,原电池的电流将成倍上升。
三、琼脂块盐桥优化
笔者在实验过程中发现,琼脂块盐桥制备时KCl的浓度以及琼脂块的厚度对原电池产生的电流有一定的影响,因此,为了使原电池能形成相对较大、较稳定的电流,笔者从盐桥制备巾KCl的用量、盐桥的厚度两方面进行了琼脂块盐桥最优制备方案的探究。
1.琼脂块盐桥中KCl含量的影响
苏教版《化学反应原理》教材指出“盐桥中通常装有含KCl饱和溶液的琼脂”,但笔者在配制盐桥内容物时发现,若先制得KCl饱和溶液,再向其中加入琼脂,则琼脂的溶解度很小,溶解的琼脂不足以使溶液形成凝胶状。于是笔者调整加料顺序,先在1OOOmL热水中加入7g琼脂(该琼脂用量是笔者通过实验对比优化后得出的),使其完全溶解后再加入340gKCl固体[5](20℃,1OOOmL水中KCl的溶解度约为340g),完全溶解后趁热倒入矩形电解槽中,冷却后便可制得定型的琼脂凝胶。但在冷却过程中,笔者发现琼脂凝胶中有大量似雪花状的KCl晶体析出(如图3所示),经实验测定,由该琼脂块盐桥构成的原电池产生的电流极不稳定,笔者认为该电流不稳定的现象是由琼脂块盐桥固相不均一性引起的。
因此,笔者制备了不同KCl含量的琼脂块盐桥,以探究KCl含量对盐桥性能的影响。首先从琼脂块盐桥的固相均一性考虑,实验结果(如表1所示)表明,在1OOOmL水、7g琼脂的溶液中加入KCl固体不大于250g时可以制得固相均一性较好的盐桥。
同时,笔者将制得的不同KCl含量的琼脂块盐桥构成铜锌原电池,并对其进行电流测定实验。由实验结果(如图4所示)可知,在盐桥厚度相同时,盐桥中KCl浓度越大,单位时间内传输的离子越多,溶液内阻越小,实验所测得的电流越大。但是用固相不均一的盐桥进行实验时(如KCl含量为340g/L时),由于盐桥中KCl分布不均匀,电流非常不稳定,无法测定准确的电流值。图4中KCl含量为300g/L时的电流为所测初始电流,电流不稳定,很快出现衰减,而KCl含量降低至250g/L后,可以测得比较稳定的电流。在配制得到的均相盐桥中,盐桥厚度相同时,随着KCl含量的增加,实验测得的电流逐渐增大。综合上述实验结果,笔者认为在1OOOmL沸水中先加入7g琼脂,完全溶解后加入200-250g KCl固体,冷凝后制得的盐桥固相均一,实验效果相对最好。
2.琼脂块盐桥厚度的影响
图4所得的实验结果也表明:当盐桥中KCl含量一定时,盐桥厚度越小,内阻越小,所测得的电流越大。对比不同KCl含量的盐桥的电流一厚度曲线,笔者发现,当盐桥厚度大于2cm时,上述琼脂块盐桥均可得到較稳定的电流。当盐桥厚度减小至2cm以下时,产生的电流高达1.2A以上,但此时的电流开始趋于不稳定。针对该现象,笔者认为原因在于:当实验过程中电流较大时,盐桥中需要传输的离子也相应增多,而此时过窄的琼脂块盐桥无法提供给离子稳定的传输介质,从而引起了电流的不稳定,另外电流过大时,电池的正负极极化增强,伴随副反应加剧,也导致电流不稳定。因此,实验时琼脂块盐桥的厚度宜取2-3cm。
四、结语
针对U型管盐桥存在的不足,笔者得到了纸条状盐桥(包括滤纸条、棉布条以及湿纸巾)和琼脂块盐桥两种改进方案。纸条状盐桥虽然在其对应的双液原电池所产生的电流大小上较U型管盐桥没有太大的优势(当然湿纸巾盐桥的对应电流是U型管盐桥的近3倍),但是其操作简便,学生观察学习直观明了,同时对比纸条与琼脂作用的共性,加深对盐桥工作原理的理解;琼脂块盐桥的对应电流则远远大于U型管盐桥,甚至远大于单液原电池的电流,并且大电流持久而稳定,这更便于教学过程中通过实验现象科学合理地引入盐桥并进一步讲解盐桥。同时,琼脂块盐桥将U型管盐桥的内容物直接暴露在外,使学生对盐桥真实结构的了解更为直观。另外,笔者还获得了琼脂块盐桥中KCl含量、盐桥厚度两个因素对琼脂块盐桥性能的影响,并得出了琼脂块盐桥的最优制备方案:1OOOmL水中趁热溶解7g琼脂,再加入200-250g KCl固体,冷却后将盐桥厚度切至2-3cm为宜。
参考文献
[1]章建锋.“旧瓶装新酒”——盐桥新做法[J].化学教与学,2014( 10):90-91
[2]杨晓东.由“盐桥”引发的探究[J].实验教学与仪器,2013(7/8):63-65
[3]冯玲,张雄飞,陈杨杰,蒋琳琪.湿法无纺布型锂离子电池隔膜研究[J].膜科学与技术,2017,37(4):64-69
[4]蔡行雯.高中常见电池实验的改进[J].实验教学与仪器,2015(7/8):55-56
[5]卢基敏.盐桥制作实验的改进[J].实验教学与仪器,2012(2):25
