紫花苜蓿镰刀菌根腐病研究进展
2019-12-20方香玲张彩霞南志标
方香玲,张彩霞,南志标
(兰州大学草地农业生态系统国家重点实验室,兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
紫花苜蓿(Medicagosativa, 简称为苜蓿)为多年生豆科牧草,具有栽培历史悠久、种植面积大、分布广和利用价值高等特点,被誉为“牧草之王”[1-2]。全世界苜蓿种植面积约3220万hm2,在美国,紫花苜蓿和小麦(Triticumaestivum)并列成为第三大重要作物;我国紫花苜蓿种植面积约377万hm2,居各类栽培草地之首,主要分布于西北、华北和东北地区[1-4]。苜蓿蛋白质含量高(初花期粗蛋白含量18%左右)、产量高、适口性好,饲用可增加20%产奶量、提高鲜奶质量,是我国最主要的优质饲草,是发展优质畜牧业重要的物质基础[5-6];苜蓿根系发达,入土深,是理想的水土保持植物,具有显著的生态效益[7];较强的固氮能力,可以提高土壤肥力,促进其他植物的生长[8];再生性强、适应性广、具有耐盐碱、抗寒、耐旱等特点,适合在我国西北干旱地区种植,对于我国草地畜牧业和农业的可持续发展具有重要的意义[1,9]。随着产业结构的调整和供给侧结构性改革,我国苜蓿种植面积将进一步扩大,预计到2020年新增20多万hm2,其应用价值也将得到很大提升[3,10]。
国内外苜蓿生产深受根腐病的威胁,严重影响苜蓿产量与品质,制约着苜蓿的生产。据统计,全世界每年由根腐病造成的苜蓿产量损失在20%左右,严重时高达40%[11-12]。苜蓿根腐病普遍发生于我国西北(甘肃、新疆和青海等)、华北(河北和内蒙古等)和东北地区(黑龙江和吉林等)等苜蓿主要种植区,严重地块苜蓿死亡率达60%以上[13-19]。近年来,随着我国苜蓿种植面积的进一步扩大和集约化发展,根腐病日趋严重。针对该病害,国内外学者已开展一系列研究,主要集中在病害发生及严重程度调查、病原菌分离鉴定、致病性和生物学特性测定、苜蓿品种抗性评价以及农业和生物防治等方面[13-18,20-25]。
由镰刀菌(Fusariumspp.)引起的根腐病,称为镰刀菌根腐病(Fusariumroot rot),是苜蓿生产上的主要根部病害,会造成根部腐烂,导致根系吸收水分和养分的功能逐渐减弱直至植株死亡[11]。由于镰刀菌为土壤习居真菌,能在土壤中长期存活,加上苜蓿为多年生牧草,一次种植可多年利用,随着种植年限的延长,导致根腐病更加严重,但苜蓿生产中已开展的农业及生物防治等措施只能初步控制该病害。镰刀菌根腐病已成为导致苜蓿品质下降和产量损失的重要因素之一,其有效防治对于实现苜蓿这一重要牧草的可持续生产具有重要的意义。本研究从苜蓿镰刀菌根腐病的分布与危害、病原种类与生物学特性、侵染源及发病规律、镰刀菌对苜蓿的致病性及致病机理、苜蓿品种对镰刀菌的抗病性以及防治方法等方面阐述国内外苜蓿镰刀菌根腐病的研究进展,并对今后的研究方向进行了展望,以期为苜蓿镰刀菌根腐病后续研究及其防治新方法的开发利用提供理论依据。
1 苜蓿镰刀菌根腐病的分布与危害
镰刀菌根腐病是国内外苜蓿种植区普遍发生的一种土传病害。该病害最早于1937年在美国报道,后来在加拿大、新西兰、澳大利亚、印度、埃及和日本等国家陆续报道,有些地区发病率在60%以上[25-29]。镰刀菌根腐病普遍发生在我国苜蓿种植区如西北地区(甘肃、新疆和陕西等)、东北地区(吉林和黑龙江等)以及华北地区(内蒙古、河北、河南和山西等)[19,30-34](表1)。在西北地区如新疆阿勒泰地区,苜蓿镰刀菌根腐病常年发生,造成苜蓿死亡率在60%以上[15-16,35-36]。在东北地区如吉林和黑龙江,苜蓿根腐病一般发生在5-8月,发病率达20%~40%,高峰期发病率达92%左右[17,32,37]。在华北地区如内蒙古和河北,由镰刀菌引起的根腐病发生在6-10月,8月均达到高峰期,发病率在15%~30%[17]。
镰刀菌在苜蓿全生育期均可引起植株发病,进而缩短苜蓿的寿命及其利用年限,降低该牧草的固氮能力和品质,甚至导致苜蓿丧失其加工价值[16,29,36,38-39]。苜蓿在越冬时消耗贮存的有机物质,而受镰刀菌侵染的苜蓿植株可溶性糖含量明显减少,造成次年苜蓿的再生能力减弱、发芽延迟、分蘖数减少和生长缓慢等,逐渐出现地块凸显,植株稀疏,严重影响草产量[40]。镰刀菌对苜蓿种子的发芽具有较强的抑制作用;同时可以造成植株代谢紊乱,降低苜蓿的产量和品质,给奶牛业带来重大隐患[21,41-44]。此外,镰刀菌可以在土壤中长期存活,逐年累积,导致苜蓿抗病能力降低,由此形成了种植年限越长,病害越严重的现象[32]。
2 病原种类与生物学特性
2.1 病原种类
苜蓿根腐病病原种类复杂,且不同国家和地区存在差异,但多与镰刀菌有关[11,14,17,42-44]。已报道的苜蓿根腐病病原有35种,其中镰刀菌20种,包括尖孢镰刀菌(F.oxysporum)、燕麦镰刀菌(F.avenaceum)、腐皮镰刀菌(F.solani)、锐顶镰刀菌(F.acuminatum)、半裸镰刀菌(F.semitectum)、串珠镰刀菌(F.moniliforme)、黄色镰刀菌(F.culmorum)、三线镰刀菌(F.tricinctum)、接骨木镰刀菌(F.sambucinum)、链状镰刀菌(F.fusarioides)、木贼镰刀菌(F.equisti)、大刀镰刀菌(F.culmorum)、梨孢镰刀菌(F.poae)、厚垣镰刀菌(F.chlamydosporum)、拟枝孢镰刀菌(F.sporotrichioides)、雪腐镰刀菌(F.nivale)、禾谷镰刀菌(F.graminearum)、砖红镰刀菌(F.lateritum)、弯角镰刀菌(F.camptoceras)和层出镰刀菌(F.proliferatum)。镰刀菌主要侵染苜蓿根部以及根颈部。发病初期,植株地上部分生长缓慢,叶片发黄,个别枝条萎蔫枯死;后期叶片变黄枯萎,全株萎蔫枯死[45]。患病植株根部有坏死斑,纵切面呈棕色或黑色;主根变短,侧根减少,主根导管呈红褐色或暗褐色条状变色,维管束呈深褐色,根中空,严重时整个根全部腐烂;一般表现在主根和侧根的皮层,后期易从土中拔出[16,19,29,41]。
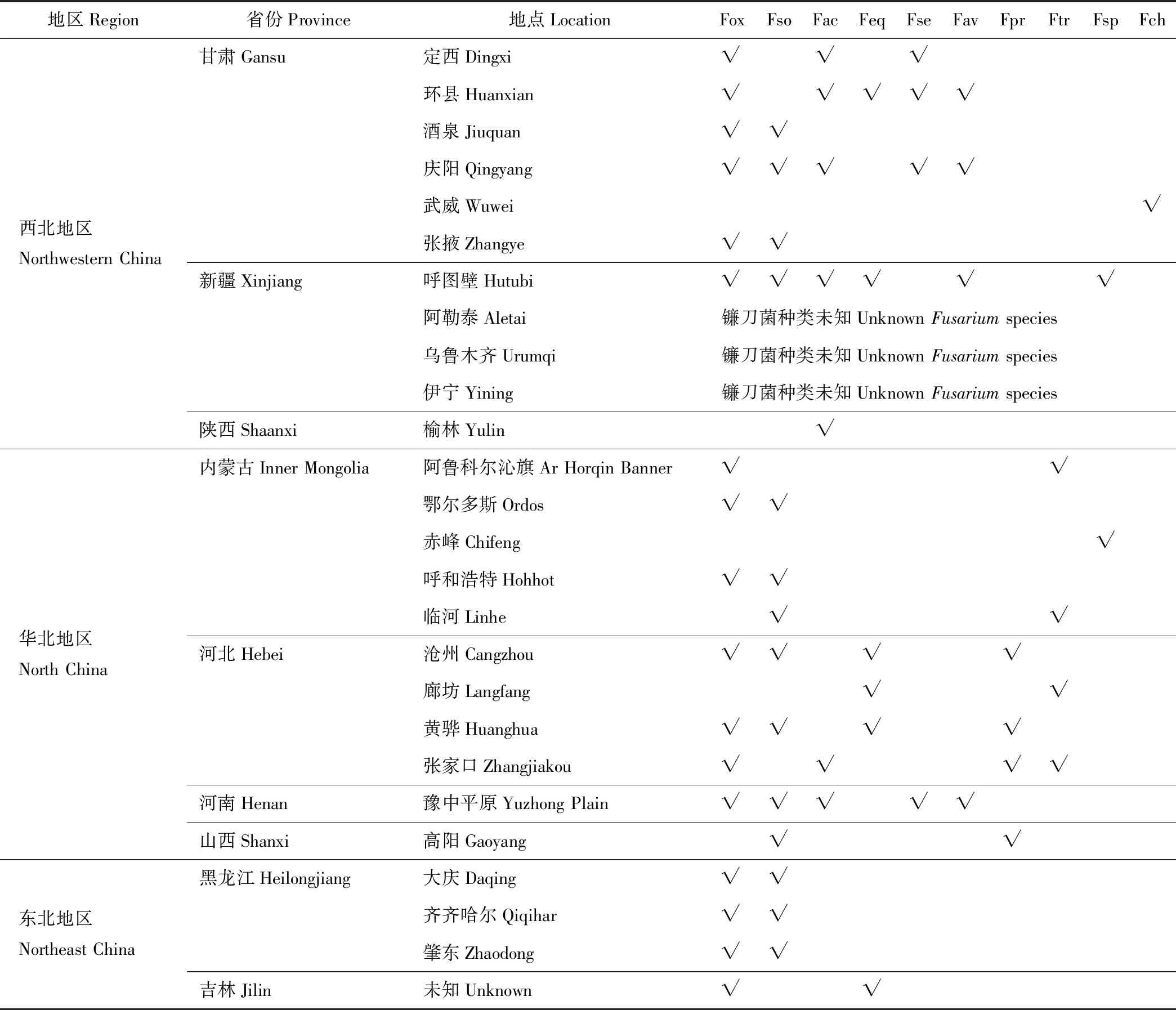
表1 不同镰刀菌在我国苜蓿种植区的分布
表1根据参考文献[11-12,17,19,34-35,42,48-50,54,67-68,72-75]汇总。Table 1 was summarized based on references[11-12,17,19,34-35,42,48-50,54,67-68,72-75].
Fox: 尖孢镰刀菌F.oxysporum; Fso: 腐皮镰刀菌F.solani; Fac: 锐顶镰刀菌F.acuminatum; Feq: 木贼镰刀菌F.equisti; Fse: 半裸镰刀菌F.semitectum; Fav: 燕麦镰刀菌F.avenaceum; Fpr: 层出镰刀菌F.proliferatum; Ftr: 三线镰刀菌F.tricinctum; Fsp: 拟枝孢镰刀菌F.sporotrichioides; Fch: 厚垣镰刀菌F.chlamydosporum. √: 每个地点分离得到的镰刀菌种类Fusariumspecies isolated from each location.
已开展研究表明,引起我国苜蓿根腐病的镰刀菌病原种类主要有8种,依次为尖孢镰刀菌、腐皮镰刀菌、锐顶镰刀菌、木贼镰刀菌、半裸镰刀菌、燕麦镰刀菌、层出镰刀菌和三线镰刀菌(表1)。其中尖孢镰刀菌为我国苜蓿根腐病的优势镰刀菌种类,占已报道镰刀菌种类分布地点的74%(23个已报道镰刀菌种类分布的地点中,17个地点有尖孢镰刀菌);其次为腐皮镰刀菌,占已报道镰刀菌种类分布地点的61%;其余镰刀菌种类占分布地点的比例都小于50%。内蒙古和黑龙江苜蓿根腐病的优势镰刀菌种类为尖孢镰刀菌和腐皮镰刀菌;其他省如甘肃省苜蓿根腐病的优势种类,除尖孢镰刀菌和腐皮镰刀菌外,还有锐顶镰刀菌和半裸镰刀菌;河北省苜蓿根腐病的优势种类,除尖孢镰刀菌外,还有木贼镰刀菌和层出镰刀菌;厚垣镰刀菌目前仅发现为甘肃省武威地区苜蓿根腐病病原。其他国家,如埃及苜蓿根腐病病原主要有尖孢镰刀菌、半裸镰刀菌、链状镰刀菌、木贼镰刀菌和锐顶镰刀菌[29];美国苜蓿根腐病的病原主要有腐皮镰刀菌、燕麦镰刀菌、锐顶镰刀菌、三线镰刀菌、接骨木镰刀菌和木贼镰刀菌[27,46];加拿大苜蓿根腐病的主要病原为锐顶镰刀菌、半裸镰刀菌、腐皮镰刀菌、接骨木镰刀菌、尖孢镰刀菌、木贼镰刀菌和燕麦镰刀菌[28,47]。
2.2 生物学特性
镰刀菌的生长、产孢和孢子萌发等特性与环境条件如温度、湿度、pH及营养成分等密切相关。镰刀菌生长的适宜温度范围为20~28 ℃,孢子萌发的适宜温度范围为25~32 ℃[11,48-50];不同镰刀菌在同一温度下的生长情况存在差异,如35 ℃条件下层出镰刀菌生长良好,但不利于尖孢镰刀菌和厚垣镰刀菌的生长[51-52]。湿度为95%~97%时镰刀菌引致的苜蓿根腐病发病率最高,而低于75%时镰刀菌孢子几乎不能萌发[53]。菌丝生长的适宜pH范围为5.0~9.0,分生孢子产生和萌发适宜pH范围为6.0~7.0[11,54]。此外,菌丝的生长、产孢和孢子萌发均需要适宜的氮源和碳源,可溶性淀粉有利于大部分镰刀菌如尖孢镰刀菌、木贼镰刀菌、层出镰刀菌、三线镰刀菌、锐顶镰刀菌和拟枝孢镰刀菌等菌丝的生长,但不利于厚垣镰刀菌菌丝的生长;蛋白胨有利于厚垣镰刀菌和拟枝孢镰刀菌菌丝的生长;碳源如葡萄糖有利于镰刀菌孢子萌发但是不利于产孢[11,51-52]。此外,研究表明,铵态氮对镰刀菌菌丝的生长具有抑制作用[54],因此推测,适度的增施氮肥可以在一定程度上降低镰刀菌根腐病的发生。虽然已有较多关于镰刀菌生物学特性方面的报道,但与苜蓿根腐病相关的镰刀菌生物学特性方面的研究较少,目前仅有尖孢镰刀菌、腐皮镰刀菌、拟枝孢镰刀菌、厚垣镰刀菌等少数几种镰刀菌种类生物学特性的初步报道[11,50-51,53]。镰刀菌尤其是尖孢镰刀菌产生的3种无性孢子(小分生孢子、大分生孢子和厚垣孢子),在病害发生和循环中发挥重要作用,孢子数量及存活状况直接影响着病害的发生及其危害程度[55-57]。
3 侵染源及其发病规律
镰刀菌为土壤习居菌,主要以菌丝体和孢子形式在病残体、带菌种子和土壤中越冬。镰刀菌尤其尖孢镰刀菌的厚垣孢子是侵染植物寄主的初侵染源,能够在土壤中持续存活数十年,一旦侵染条件合适,就再次萌发侵染植物寄主,在病害发生中发挥重要作用;大分生孢子和小分生孢子是侵染植物寄主的二次侵染源,能够在受侵染的植物表面存活,传播给相邻植物[55-57]。因此镰刀菌厚垣孢子和分生孢子在病害发生和循环中发挥重要作用,其数量及存活状况直接影响着病害的发生及其危害程度[18,55-60]。镰刀菌一般从机械损伤以及逆境条件引起的伤口处直接入侵寄主根部,最后导致植株萎蔫死亡[61-62]。其中尖孢镰刀菌不仅可以侵入植物根部引起根腐病,还可以进入维管束引起植株萎蔫枯死[63]。
苜蓿根腐病的发生和流行不仅受病原菌种类和孢子数量的影响,还受到土壤温度、湿度和pH以及苜蓿品种抗病能力等多方面因素的影响,其中最主要的是湿度和温度[36,64]。苜蓿根腐病发生的高峰期会因种植区的温度和湿度等环境条件的不同而存在差异,如北方地区(如河北张家口、内蒙古科尔沁旗)根腐病发生的高峰期在5-8月[45,65];南方地区(如云南)该病的发病高峰期在8-9月[66]。田间管理也影响苜蓿根腐病的发生和流行,如不合理施肥和灌溉,过度刈割,同一品种多年种植等措施都可以加重苜蓿根腐病[30,35]。但是,关于环境因素对镰刀菌在连作土壤中存活时间的影响,还缺乏系统的研究,同时,根据苜蓿根腐病发生的高峰期对病害发生趋势进行预测,综合分析影响病害发生流行的不同环境因素,特别是降水量、降水次数、温度及其相互关系,构建预测模型,制定出其预测技术,把握最佳防治时期,是根腐病防治工作中不可或缺的一部分[65]。后期应加强镰刀菌根腐病田间以及多年生长季的系统调查,全面了解其发生流行规律,为苜蓿的生产实践提供指导。
4 镰刀菌对苜蓿的致病性及致病机理
研究表明从苜蓿根腐病植株根部分离获得的镰刀菌菌株的致病性因其种间和种内不同菌株而存在差异(表2)。种间不同镰刀菌菌株对同一苜蓿品种表现不同的致病性,如尖孢镰刀菌和层出镰刀菌菌株对中苜1号的致病性均强于腐皮镰刀菌菌株;尖孢镰刀菌菌株对陇东苜蓿的致病性强于燕麦镰刀菌和三线镰刀菌菌株(表2)。种内不同镰刀菌菌株对同一苜蓿品种的致病性也存在显著差异,如腐皮镰刀菌和半裸镰刀菌不同菌株对甘农3号均表现出不同程度的致病性(表2),这些表明镰刀菌种间以及种内不同菌株在致病性方面的复杂性。目前研究镰刀菌对苜蓿致病性的方法主要有种子接种法、试管幼苗接种法、土壤接种法和浸根接种法等(表2)。不同接种方法所得菌株的致病性强弱不同,如通过两种不同方法(种子接种法和土壤接种法)分别测定半裸镰刀菌、锐顶镰刀菌以及木贼镰刀菌对陇东苜蓿的致病性,结果表明前者所测得的致病性强于后者(表2);不同接种方式导致病害发病时间不同,如试管幼苗接种法的发病时间比土壤接种法早7~25 d[67],土壤米粒接种体接种的发病时间比孢子悬浮液浸根法早5~8 d[45];此外,同一接种法,进行接种和致病性评价时的时期不同,导致致病性研究结果也不同,如通过种子接种法测定燕麦镰刀菌对陇东苜蓿接种后14 d的病情指数远高于甘农3号接种后7 d的病情指数(表2)。此外,苜蓿镰刀菌根腐病病因复杂,多菌株复合侵染相比较单菌株侵染能提高发病率并缩短潜伏期和发病高峰期。如尖孢镰刀菌、腐皮镰刀菌、串珠镰刀菌和黄色镰刀菌相互组合侵染苜蓿植株其发病率均达到60%以上[19,48,68]。
虽然已有较多关于镰刀菌的致病机理研究,但关于镰刀菌对豆科植物尤其是苜蓿的致病机理还了解甚少,分子机理依然未知。前期研究初步表明,镰刀菌主要通过产生致病毒素侵染植株,如玉米(Zeamays)赤霉烯酮、镰刀菌酸、脱氧雪腐镰刀菌烯醇、雪腐镰刀菌烯醇和双乙酸基草镰刀菌醇等。半裸镰刀菌产生的玉米赤霉烯酮、双乙酸基草镰刀菌醇对苜蓿种子的发芽具有较强的抑制作用,同时造成幼苗萎蔫和变色、植物鲜重减少[69];镰刀菌酸通过降低线粒体活性氧的含量、阻止ATP合成而导致根系吸收水分能力受阻[24];同时这些毒素可以参与植物的生理活动,造成代谢紊乱,降低苜蓿的产量和品质,给奶牛业带来重大隐患[21,58,70-71]。
5 苜蓿品种对镰刀菌的抗病性
5.1 苜蓿品种对镰刀菌抗病性表现
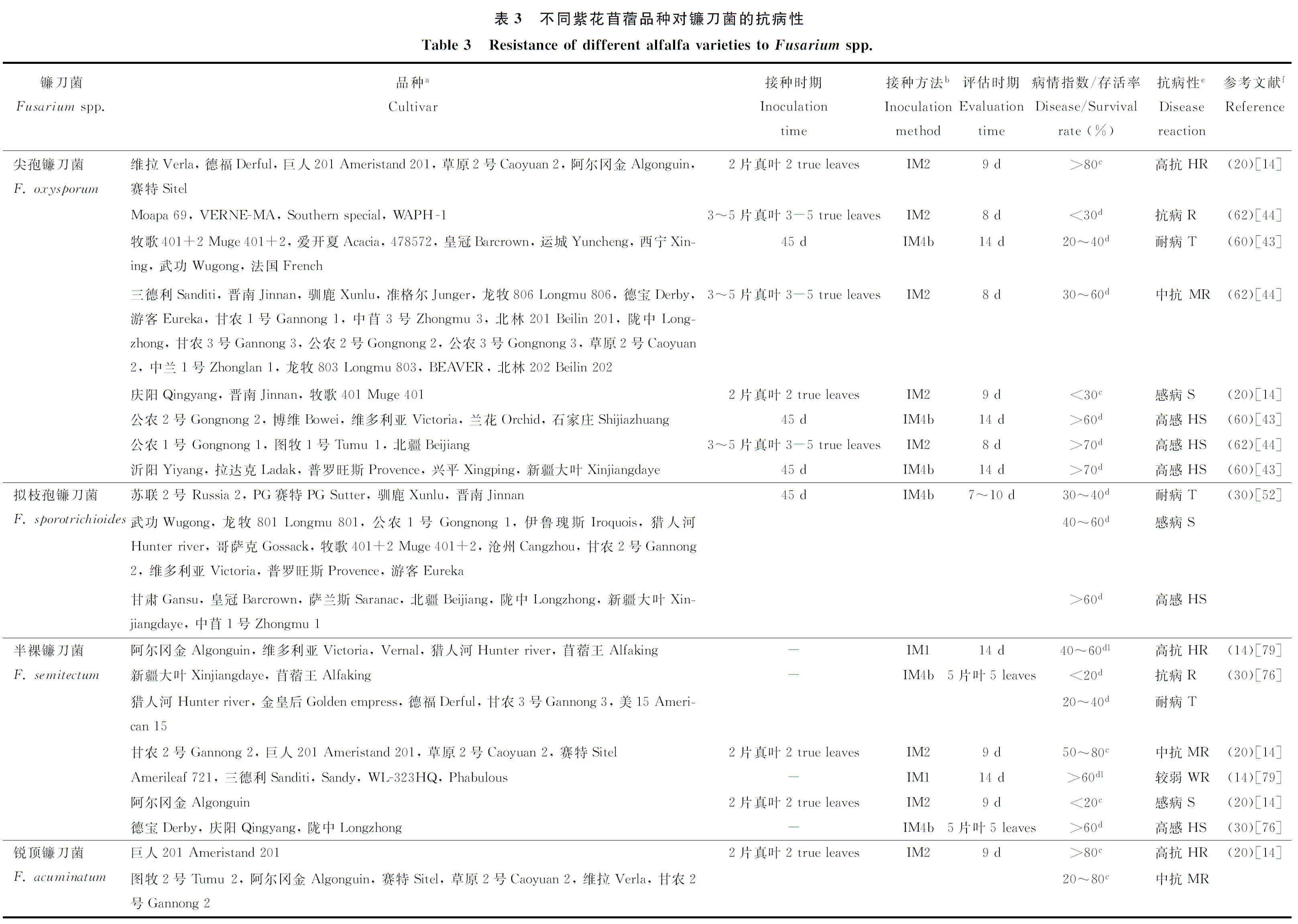
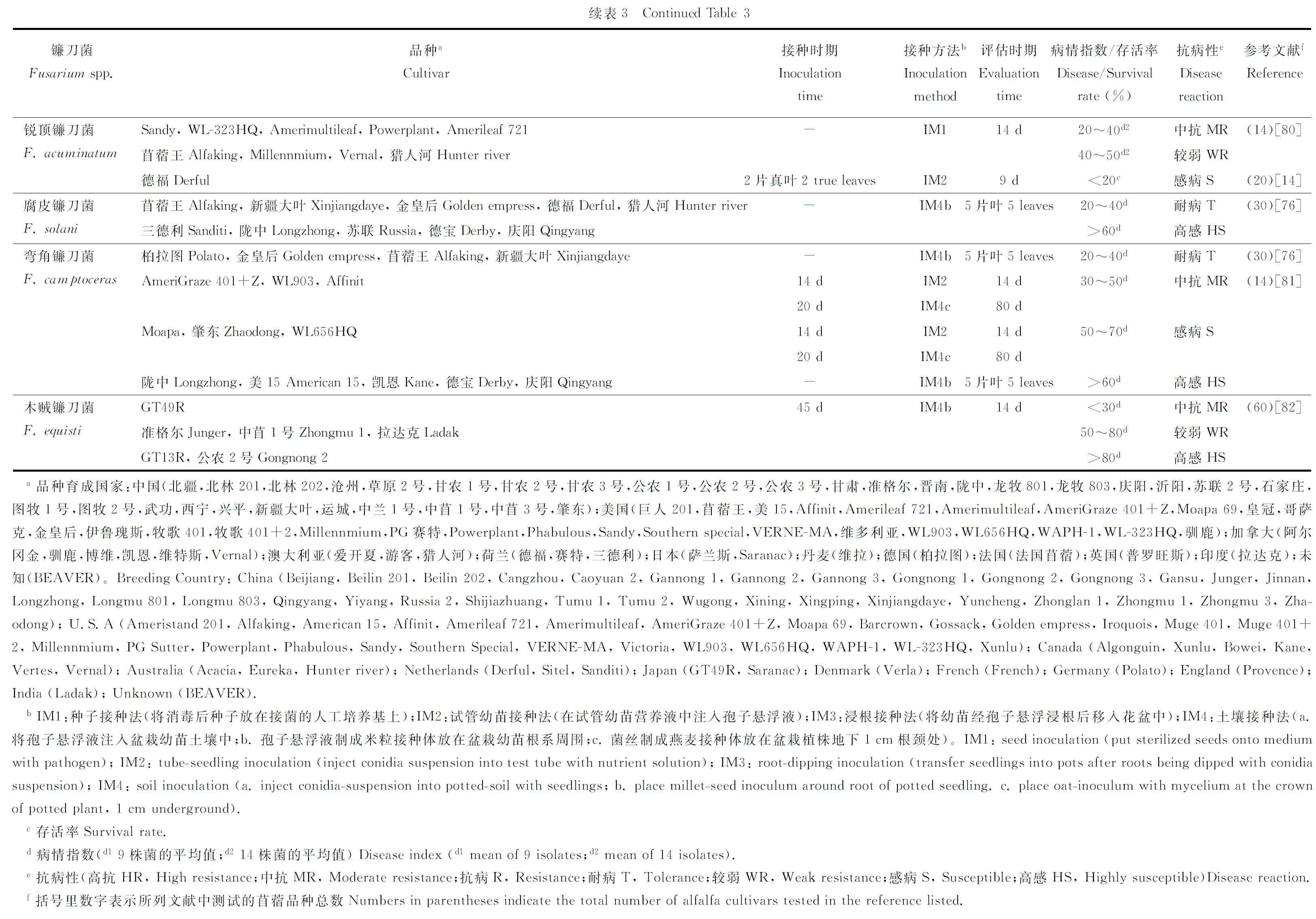
国内外研究人员对苜蓿对镰刀菌的抗病性表现已进行了一系列研究(表3)。研究表明,同一苜蓿品种对不同种镰刀菌抗病性存在差异,如德福对尖孢镰刀菌表现较强的抗性,对锐顶镰刀菌则表现为感病;陇中对尖孢镰刀菌表现在为中抗,对拟枝孢镰刀菌表现为高感(表3)。不同苜蓿品种对同一种镰刀菌的抗性也存在差异,如新疆大叶对半裸镰刀菌表现为抗病,德宝和陇中表现为高感;阿尔冈金对尖孢镰刀菌表现为高抗,德宝和草原2号等表现为中抗(表3)。研究还发现,不同接种方法以及进行接种和病害评估的时期不同,导致紫花苜蓿品种表现的抗性不同,如公农2号对尖孢镰刀菌抗病性表现,在3~5片叶时采用试管幼苗接种法表现为中抗,但在45 d时采用土壤接种法表现为高感;阿尔冈金对半裸镰刀菌的抗病性表现,在种子接种条件下接种后14 d表现出较强的抗性,但在试管幼苗接种条件下接种后9 d则表现为感病(表3)。此外,不同试验条件下苜蓿品种抗病性表现不同,如公农1号对尖孢镰刀菌以及德宝对半裸镰刀菌,在室内条件下表现为感病,但自然条件下表现为抗病[44,76]。综上所述,不同苜蓿品种对镰刀菌抗病性表现,不但受菌株种类的影响,还受到接种方法、接种和病害评估时期以及试验条件等的影响。
5.2 苜蓿品种抗病性评价标准
关于抗病性评价指标方面,目前国内外通常根据存活率和病情指数等指标评价苜蓿对镰刀菌抗病性的强弱,但由于划分标准不一,所得出的结果不同(表3)。如在同一接种条件下(如试管幼苗接种法),分别根据存活率(划分为3级)[14]和病情指数(划分为3级)[44]评价苜蓿品种对尖孢镰刀菌的抗性,结果得出的抗性程度不一样,如草原2号对尖孢镰刀菌分别表现为高抗和中抗(表3)。已开展工作还通过研究接种后植物体内防御性酶活性的变化,评价不同苜蓿品种对镰刀菌的抗病性。如苜蓿在受到镰刀菌侵染后,抗病品种防御性酶如苯丙氨酸解氨酶(PAL)的活性高于感病品种;感病品种防御性如过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)的活性高于抗病品种[52,77-78]。此外,已开展研究还通过建立对照品种,评价不同苜蓿品种对镰刀菌的抗病性表现,如黄宁等[44]通过对62个品种对镰刀菌的抗病性进行了测定,发现不同品种的抗病性存在显著差异,并首次把抗病品种VERNE-MA、中抗品种公农2号和感病品种北林203作为抗镰刀菌根腐病评价的对照品种,为苜蓿品种对镰刀菌根腐病的抗病性评价提供了初步参考。但是,目前对苜蓿抗病性的研究主要集中在田间调查和室内温室试验两个方面,缺乏大田条件下对其抗病性的评价以及对苜蓿抗镰刀菌分子机理的研究。关于苜蓿对镰刀菌的抗病性评价方面,目前缺乏统一的评价标准,评价方法比较混乱,导致同一品种出现不同的抗病等级,不能准确地判断品种的抗病性。今后应制定关于苜蓿对镰刀菌抗病性评价的统一标准,并通过不同指标如存活率、病情指数和地上、地下生物量等综合评价苜蓿品种的抗病性,为快速准确地评价苜蓿品种的抗病性奠定基础。
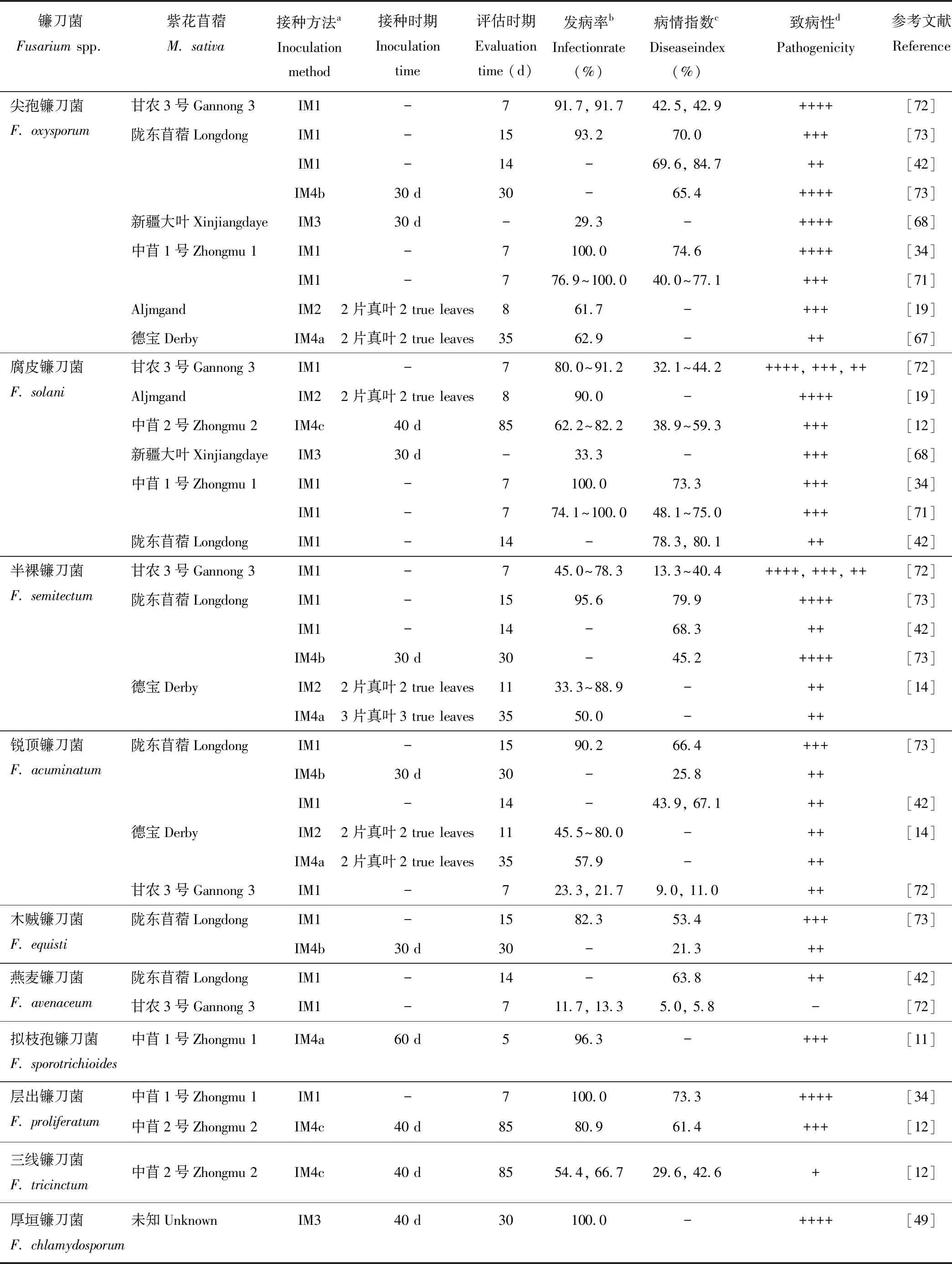
表2 不同镰刀菌对紫花苜蓿的致病性
aIM1:种子接种法(将消毒后种子放在接菌的人工培养基上);IM2:试管幼苗接种法(在试管幼苗营养液中注入孢子悬浮液);IM3:浸根接种法(将幼苗经孢子悬浮浸根后移入花盆中);IM4:土壤接种法(a. 将孢子悬浮液注入盆栽幼苗土壤中;b. 孢子悬浮液制成米粒接种体放在盆栽幼苗根系周围;c. 菌丝制成燕麦接种体放在盆栽植株地下1 cm根颈处)。IM1: seed inoculation (put sterilized seeds onto medium with pathogen); IM2: tube-seedling inoculation (inject conidia suspension into test tube with nutrient solution); IM3: root-dipping inoculation (transfer seedlings into pots after roots being dipped with conidia suspension); IM4: soil inoculation (a. inject conidia-suspension into potted-soil with seedlings; b. place millet-seed inoculum around root of potted seedling. c. place oat-inoculum with mycelium at the crown of potted plant, 1 cm underground).
b单一值,1株菌的发病率;两个数值,2株菌的发病率;区间数值,3株及以上菌株的发病率;-,未知。Single value, infection rate of one isolate; two or more value, infection rate of two or more isolates; -, unknown.
c单一值,一株菌的病情指数;两个及以上数值,两株或多株菌的病情指数;-,未知。Single value, disease index of one isolate; two or more value, disease index of two or more isolates; -, unknown.
d致病性强弱:++++,最强;+++,较强;++,致病;+,较弱;-,不致病。Pathogenicity: ++++, strongest; +++, stronger; ++, strong; +, poor; -, non-pathogenicity.
6 防治方法
6.1 选育抗病品种
利用抗病品种防治苜蓿根腐病是最有效的方法,在牧草病害防治体系中占有主导地位。但是目前我国还没有培育出抗镰刀菌根腐病的品种,仍依赖于从已有的苜蓿品种中筛选出抗病性相对较强的品种[44]。主要原因是苜蓿抗病品种的选育受以下两个因素的限制:1)苜蓿是同源四倍体植物,授粉方式为异花授粉,因此高度自交不亲和,获得纯化材料较为困难;2)根腐病的病原较为复杂,不同的生态环境引起镰刀菌根腐病的具体种类不同(表1),要培育适应不同地区抵御不同病原引起的根腐病的抗病品种十分困难。因此,通过传统的室内和田间筛选很难实现,需要通过分子育种或组织培养等手段培育苜蓿抗病品种。
6.2 加强田间管理
加强田间管理是防治苜蓿根腐病的重要措施。合理的农业管理措施如调节土壤酸碱度、添加作物残茬、增施堆肥以及轮作等方法可用来控制由镰刀菌引起的根腐病[83-84]。在苜蓿种植地主要的管理措施首先是要合理密植,播量不宜过大,影响生长;不宜过深,出土慢,增加了土壤中病菌的侵染率[16]。其次,适时刈割,秋季刈割会加重镰刀菌根腐病的严重程度;冬季刈割时留茬不易过短,否则难以越冬[28];选择适宜的刈割时间和次数在一定程度上可以减轻该病害的发生。另外,科学施肥可以提高苜蓿的抗逆性,如增施钾可以降低根腐病的发病率和镰刀菌的入侵;氮∶磷为1∶3可以有效地控制根腐病的发生[85]。
6.3 生物防治
在镰刀菌根腐病的生物防治方面已经报道的有利用绿色木霉(Trichodermaviride)、芽孢杆菌(Bacillussubtilis)、非致病尖孢镰刀菌等作为生防菌[63,86-87]。绿色木霉可以产生多种具有生物活性的酶,如几丁质酶、纤维素酶和木聚糖酶等,可防治由尖孢镰刀菌引起的根腐病,具有保护和治疗的双重作用[87];从苜蓿根部分离筛选的拮抗细菌枯草芽孢杆菌MB29,既可以抑制苜蓿根腐病菌半裸镰刀菌、锐顶镰刀菌、木贼镰刀菌和尖孢镰刀菌的生长,同时对苜蓿生长具有促生作用[88];非致病性镰刀菌是防效较好、较稳定的生防因子,尤其是对镰刀菌引起的根腐病效果较好[89]。近年来,绿肥的使用也在一定程度上对根腐病有防治作用,主要是由于绿肥可以增加土壤微生物种类、活性以及非致病性镰刀菌的含量。但是生物防治最重要的是“防”,对于病害还没有发生时起到保护作用,如果病害发生严重,使用拮抗菌的作用没有化学防治效果好。虽然生物防治受到的关注越来越多,但是在推广方面还是存在问题,后期需要多方面努力。
6.4 化学防治
化学防治是根腐病防治的有效途径,但是化学药品残留会对土壤及水资源造成严重污染。通过种子处理和土壤施药等方法,枯萎绝和枯腐宁复合使用对镰刀菌根腐病具有很好的防治作用[90]。甲基托布津、福美双进行苜蓿种子处理对该病害也具有一定的防治作用[16,58]。大田防治苜蓿镰刀菌根腐病以有效剂量250 g·hm-250%咯菌腈和43%戊唑醇的防效较好。由于根腐病病原菌主要分布在土壤中且在苗期或成株期都可以从伤口侵入根部,所以对于化学试剂的使用方法具有较高的要求,药剂量大容易造成环境的污染,量小则达不到防治的效果[18]。
综上所述,对于苜蓿镰刀菌根腐病的防治应遵循“防重于治”,对于病害还没有发生时加强田间监测,同时将抗病品种与田间管理合理结合起来,将选育出来的生长迅速、根系发达的品种种植3年左右,然后每年及时刈割,防止草产量损失,更能有效地防止根腐病的发生。合理的田间管理措施可以改变苜蓿的生长环境,降低病害的发生。化学防治是最直接的方法,筛选有效的化学药剂可以控制根腐病病原的传播。
7 问题与展望
7.1 我国苜蓿镰刀菌根腐病优势病原菌种类有待进一步明确
已开展研究表明引起我国不同地区苜蓿根腐病的镰刀菌种类较多,优势种类依次为尖孢镰刀菌和腐皮镰刀菌(表1)。但目前还缺乏关于我国苜蓿所有主要种植区镰刀菌根腐病病原的大规模分离、系统鉴定和致病性评价,有些苜蓿主要种植区尤其是西北地区的新疆、宁夏和陕西等,苜蓿根腐病的镰刀菌种类还不明确。因此,今后应进一步明确引致我国苜蓿主要种植区根腐病的优势镰刀菌种类以及不同地理和环境区域的优势镰刀菌种类,进而研究优势镰刀菌种类的生物学特性、对苜蓿的致病性及致病机理以及苜蓿的抗病性和抗病机理等,为苜蓿镰刀菌根腐病的有效防止提供前期理论依据。
7.2 建立镰刀菌对苜蓿的致病性评价以及苜蓿对镰刀菌的抗病性评价标准
关于镰刀菌对苜蓿的致病性评价,不同学者虽已开展大量研究,但所选植物材料(苜蓿品种)、接种方法、接种时间、病害评估时间、致病性评估指标等不一致,不同菌株对苜蓿的致病性评价缺乏统一的标准,导致不同学者报道的致病性研究结果很难进行对比,且研究结果不一致(表2)。今后应统一进行不同镰刀菌菌株对苜蓿致病性评价的供试品种、试验方法和致病性评价指标,为系统比较不同镰刀菌菌株对苜蓿的致病性奠定基础,从而快速准确筛选出具有不同致病力的镰刀菌菌株,为后期致病机理研究提供菌株材料。此外,目前关于镰刀菌对苜蓿的致病性测定主要集中在单一菌株的室内盆栽致病性研究,对于多种镰刀菌菌株复合侵染的致病性研究报道较少,今后应加强田间致病性试验以及多种镰刀菌菌株复合侵染对苜蓿致病性影响的研究。
关于苜蓿品种对镰刀菌的抗病性评价方面,不同学者所选病原菌(镰刀菌菌株)、接种方法、接种时间、病害评估时间和抗病性评估指标等不一致,导致不同学者报道的品种抗病性结果很难进行对比,且研究结果不一致(表3)。此外,进行苜蓿抗病性评价时大多使用单一镰刀菌菌株,无法确定所筛选品种是否具有广谱抗病性。今后应规范进行不同品种对镰刀菌的抗病性评价标准,并研究苜蓿对优势镰刀菌种内和种间不同菌株的抗性,从而系统了解不同品种对镰刀菌的抗病性并筛选广谱抗病品种,为苜蓿抗镰刀菌根腐病品种的选育和抗病机理的研究提供植物材料。
7.3 镰刀菌对苜蓿的致病机理和苜蓿对镰刀菌的抗病机理
关于镰刀菌对苜蓿的致病机理,虽然已有较多关于镰刀菌的致病机理研究,但是关于镰刀菌对豆科植物尤其是苜蓿的致病机理尤其是分子机理依然未知。今后研究中,应开展苜蓿根腐病优势镰刀菌种类种间和种内不同致病力菌株的基因组测序及比较分析,通过转录组学研究不同菌株在侵染苜蓿过程中表达的基因,并研究这些基因在镰刀菌侵染苜蓿过程中的作用,从而揭示镰刀菌对苜蓿的致病机理。通过开展不同种类镰刀菌对苜蓿致病机理的研究,发现镰刀菌主要致病因子,能够从抑制病原菌致病因子表达角度,为苜蓿根腐病防治新方法的开发应用提供理论依据。苜蓿对镰刀菌的抗病机理目前也依然未知,今后还应注重开展苜蓿对优势镰刀菌种类种间和种内不同致病力菌株的抗病机理研究,寻找苜蓿对镰刀菌的广谱和特异性抗病因子,为苜蓿抗镰刀菌根腐病品种的筛选和培育提供抗性基因,促进苜蓿的可持续生产。
7.4 镰刀菌孢子形成和萌发的适宜环境条件以及形成和萌发的机理
镰刀菌尤其是尖孢镰刀菌产生的3种无性孢子(小分生孢子、大分生孢子和厚垣孢子),在病害发生和循环中发挥重要作用,孢子数量及存活状况直接影响着病害的发生及其危害程度。但目前关于苜蓿镰刀菌根腐病病原尤其尖孢镰刀菌,不同类型孢子形成和萌发的最适环境条件等生物学特性还不明确,后期应开展该方面研究,以期为了解苜蓿根腐病的发病规律提供前期依据。同时开展关于不同类型孢子形成和萌发机理的研究,明确其关键调控因子,从而为从调控孢子形成和萌发角度,开发紫花苜蓿镰刀菌根腐病防治新方法提供理论依据。
