紫花苜蓿MsZAT10基因的克隆及其在烟草中的功能验证
2019-12-20孙亚男林茹潘晓阳陈月陶磊郭长虹
孙亚男,林茹,潘晓阳,陈月,陶磊,郭长虹
(哈尔滨师范大学生命科学与技术学院,黑龙江省分子细胞与遗传育种重点实验室,黑龙江 哈尔滨 150000)
在自然界中存在许多限制植物生长的非生物胁迫因子,其中对植物生长影响较大的是土壤盐分和低温,严重时会造成植物生长缓慢及农作物减产[1-2]。植物经过长时间的进化,在细胞、分子、形态结构和生理代谢上形成了一系列复杂的胁迫应答机制,来感知并应对外界的胁迫环境[3]。胁迫环境诱导植物体内的大量相关基因表达[4],其中多种类型的转录因子在植物的抗逆应答中起到重要作用。
锌指蛋白(zinc-finger protein)是植物应对环境胁迫的一类重要调节因子[5]。锌指蛋白根据保守基序的特点一共分为9类,分别是C2H2、C4、C6、C8、Cys3HisCys4、Cys2HisCys、Cys2HisCys5、Cys3His和Cys4HisCys3,其中以C2H2型居多[6]。研究表明,拟南芥(Arabidopsisthaliana)的C2H2型锌指转录因子在干旱,盐以及ABA(脱落酸,abscisic acid)处理早期被诱导;大豆(Glycinemax)中的C2H2型锌指蛋白基因SCOF-1可以增强转基因植株的耐冷性[7]。说明C2H2型锌指蛋白对于增强植物对盐、干旱和冷胁迫的抗性具有重要作用。本实验室之前对紫花苜蓿(Medicagosativa)的低温转录组分析中发现ZAT10上调表达,然而目前关于紫花苜蓿ZAT10基因是否参与非生物胁迫应答尚未有报道。肇东苜蓿(M.sativacv. Zhaodong)为紫花苜蓿的地方性品种,具有较强的抗寒、抗盐碱等特性[8]。本研究以肇东苜蓿为材料,克隆其MsZAT10基因,运用生物信息学方法分析其蛋白结构域特征及同源性。构建MsZAT10植物表达载体,转化烟草(Nicotianatabacum),在低温及盐胁迫条件下对转基因烟草进行相关表型分析。为揭示MsZAT10基因的功能,通过转基因技术提高植物抗逆境能力奠定基础。
1 材料与方法
1.1 试验材料与试剂
MsZAT10基因从肇东苜蓿中克隆得到;用于转化的植物材料为烟草(N.tabacumcv. SR-1);DNA胶回收试剂盒、RNA提取试剂盒、质粒提取试剂盒均来自TIANGEN公司;反转录试剂盒来自TOYOBO公司;Gelmini Purification Kit(ZOMANBIO)胶回收试剂盒来自TAKARA公司。大肠杆菌Top10、根瘤农杆菌EHA105、克隆载体pMD18-T Vector和表达载体pCBM均由本实验室提供,试验时间为2014-2016年。
1.2 紫花苜蓿叶片RNA的提取
将紫花苜蓿的组培苗驯化移入蛭石和土混合(1∶1)的基质中,在室温(25 ℃,16 h光照)条件下培养1个月左右,每周浇Hoagland营养液2~3次。将培养1个月的紫花苜蓿置于4 ℃条件下处理4 h,取其叶片用液氮快速冷冻,用RNA提取试剂盒(TIANGEN)提取RNA,在-80 ℃中保存备用。
1.3 MsZAT10基因的克隆
以紫花苜蓿叶片RNA为模板,利用反转录试剂盒获得cDNA。反应结束后,将其保存于-20 ℃。根据转录组测序获得紫花苜蓿MsZAT10基因序列,应用Primer 3软件设计克隆引物 (表1)。将上一步获得的cDNA进行稀释,利用ExTaqDNA polymerase (5 U·μL-1)进行PCR扩增。反应体系包含模板DNA (50 ng·μL-1) 10 μL、10×PCR Buffer 5 μL、dNTP Mix 4 μL、ExTaq DNA polymerase 0.25 μL、正、反向引物(10 μmol·L-1)各2 μL,用ddH2O补足50 μL。反应条件为94 ℃ 5 min、94 ℃ 30 s、53.5 ℃ 30 s、72 ℃ 65 s、30个循环。用1%琼脂糖凝胶分离PCR产物,将目的片段用胶回收试剂盒回收后与pMD18-T Vector载体连接,送至上海生工公司测序。
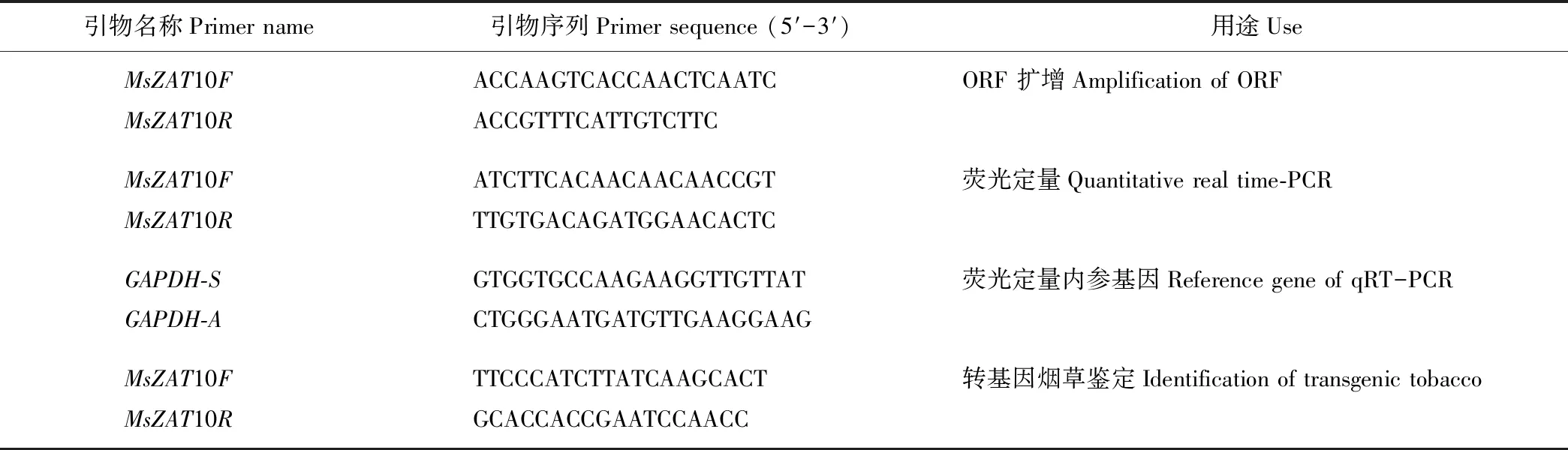
表1 本研究中所用的引物
1.4 生物信息学分析
利用Contig Express软件对测序结果进行拼接,通过在线ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)找到MsZAT10基因的开放读码框。利用SMART软件对MsZAT10开放读码框氨基酸序列进行结构域预测,将预测的MsZAT10的氨基酸序列利用NCBI protein BLAST进行比对,同MtZAT10蛋白的结构域比较,利用Clustal X 2.1软件找出其所相对应的结构域中氨基酸的差异位点。从NCBI获取蒺藜苜蓿(Medicagotruncatula)、大豆等其他物种ZAT10同源的氨基酸序列,利用Clustal X 2.1和MEGA 4软件进行比对并构建系统发育进化树。
1.5 转MsZAT10基因烟草的获得及qRT-PCR检测
将MsZAT10基因与pMD18-T Vector载体连接,转化大肠杆菌,提取质粒,进行PCR和酶切检测,筛选出正向插入的阳性克隆,用PstⅠ和SacⅠ对pMD18-T-MsZAT10和pCBM进行酶切并连接,然后进行PCR和酶切鉴定,获得植物表达载体pCBM-MsZAT10。利用冻融法将阳性克隆转入到农杆菌EHA105中,采用叶盘法对烟草进行遗传转化[9],经过草丁膦(phosphinothricin, PPT)抗性筛选和PCR鉴定,获得转基因烟草植株。
将长势相对一致,生长状态良好的转MsZAT10基因烟草进行qRT-PCR,选取的植株为OX1,OX2,OX3,OX5,OX15,OX21,OX22,OX23,OX24(过表达株系overexpression line 1、2、3、5、15、21、22、23和24号)。应用Primer 3软件设计PCR定量引物,引物序列(表1,其中GAPDH为内参基因),引物退火温度为55 ℃左右,引物长度20 nt,GC含量40%~60%,扩增片段长度180~250 bp。使用TOYOBO公司qRT-PCR试剂盒(THUNDERBIRD SYBR®qPCR Mix),每个样品设置3次技术重复,qRT-PCR反应总体系20 μL,内含SYBR 10 μL、50×ROX 0.4 μL、上下游引物各0.8 μL、模板2 μL、ddH2O 6 μL。反应程序为95 ℃ 5 min、94 ℃ 15 s、55 ℃ 30 s,40个循环;72 ℃ 30 s、95 ℃ 15 s、60 ℃ 20 s、95 ℃ 15 s。其中最后一步为扩增产物的溶解曲线分析。定量结果采用比较2-ΔΔCT法[10]计算基因表达量。
1.6 低温处理下转MsZAT10基因烟草表型的观察和电导率的测定
选取大小及生长状态一致的4周龄转MsZAT10基因烟草和野生型烟草,将其先置于4 ℃条件下处理4 h,之后再继续降温至-4 ℃条件下处理2 h,观察其表型变化。参照Zhao等[11]测定相对电导率,取低温处理后的转MsZAT10基因烟草和野生型烟草的第2~3片叶子,每片叶子用直径约5 mm的打孔器进行打孔,将烟草叶圆片放于20 mL去离子水(大约为10个叶圆片),通过真空泵抽真空15 min,静置20 min后,利用电导仪测得S1。再煮沸20 min,凉置室温,测得S2,S1/S2×100%即为电导率。每个处理设置3次重复。
1.7 转MsZAT10基因烟草的盐胁迫处理方法
选取大小及生长状态一致的4周龄转MsZAT10基因烟草和野生型烟草用直径9 mm的打孔器在叶片的相同部位打孔(打孔时尽量避免叶脉部分),将取得的叶圆片浸泡在含有300 mmol·L-1NaCl的1/2MS溶液中,观察叶片变化。采用80%丙酮抽提比色法测定叶片中叶绿素含量[12]。
1.8 生理指标测定
选取大小及生长状态一致的4周龄转MsZAT10基因烟草和野生型烟草,将低温处理组置于0 ℃,对照组置于25 ℃培养5 h后,取烟草第2~3片叶子,每份0.1 g称好后采用硫代巴比妥酸(thiobarbituric acid,TBA)比色法测定丙二醛(malondialdehyde,MDA)含量[12]、采用考马斯亮蓝G-250染色法测定可溶性蛋白含量[13]、采用酸性茚三酮法测定脯氨酸含量[13]。所有指标测定均设置3次重复。
1.9 数据分析
所有试验均设置3次重复,所用数据为3次重复的平均值。用生物统计学软件SPSS 13.0对数据进行显著性分析,数据用平均值±标准误差(mean±SE)表示。两组以上采用单因素方差分析(One-way ANOVA)进行检验分析,不同小写字母表示差异显著(P<0.05)。两组之间采用t检验,*代表P<0.05;**代表P<0.01;***代表P<0.001。
2 结果与分析
2.1 紫花苜蓿MsZAT10基因的克隆及蛋白结构域分析
提取紫花苜蓿总RNA,反转录成cDNA,以cDNA为模板,根据转录组测序结果设计MsZAT10的上下游克隆引物,利用RT-PCR技术扩增MsZAT10,将其克隆到pMD18-T Vector。经测序该基因全长762 bp,编码253个氨基酸。利用软件SMART对MsZAT10开放读码框氨基酸序列进行结构域预测,发现MsZAT10含有2个单C2H2型的保守结构域(图1),有典型的QALGGH保守基序,属于C2H2型锌指蛋白。
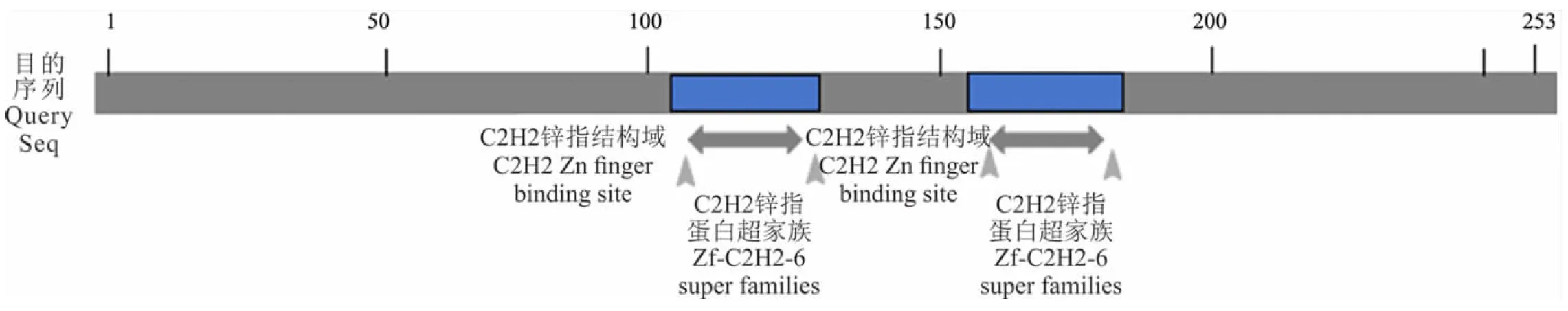
图1 MsZAT10的蛋白结构域

图2 物种间的ZAT10构建的系统发育进化树
2.2 MsZAT10氨基酸序列同源性分析
将紫花苜蓿MsZAT10氨基酸序列与蒺藜苜蓿、大豆等10种不同物种的ZAT10氨基酸序列进行比对,利用MEGA 4制作系统进化树,得知MsZAT10与大豆、花生(Arachishypogaea)等物种中ZAT10氨基酸序列的亲缘关系较近,与蒺藜苜蓿序列的亲缘关系最近(图2)。通过NCBI protein BLAST对MsZAT10的氨基酸序列进行分析,与蒺藜苜蓿的氨基酸相似性为76%。MsZAT10的氨基酸序列与MtZAT10的保守结构域相同,非保守结构域氨基酸序列差异很大。MsZAT10的氨基酸序列与MtZAT10的氨基酸序列相比有30个缺失、31个替换以及32个插入(图3)。
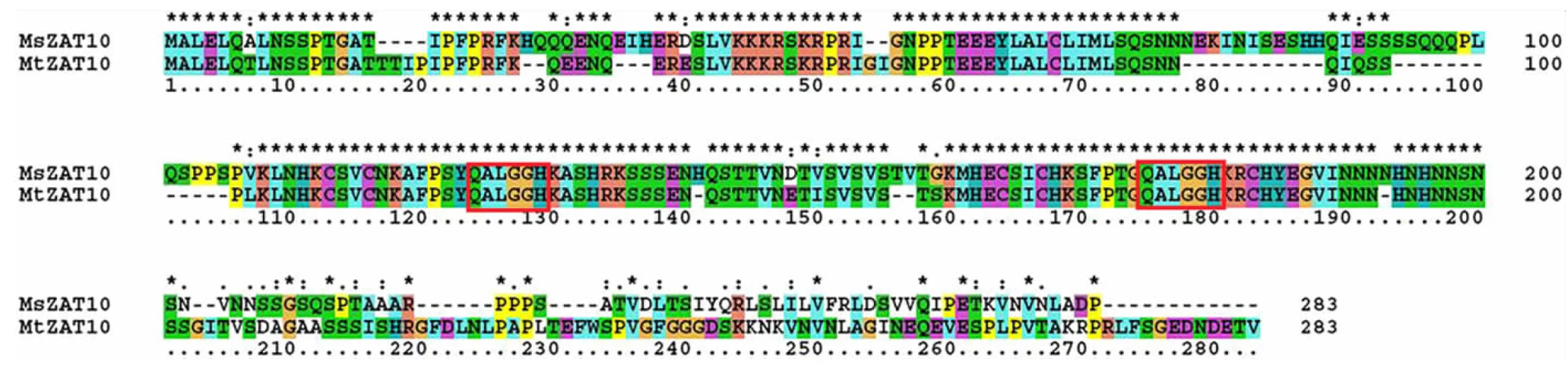
图3 MsZAT10和MtZAT10氨基酸的比对
2.3 植物表达载体pCBM-MsZAT10的构建与转MsZAT10基因烟草的qRT-PCR检测
用PstⅠ和SacⅠ对pMD18-T-MsZAT10和pCBM进行酶切并连接,然后进行PCR和酶切鉴定,获得植物表达载体pCBM-MsZAT10(图4)。通过农杆菌介导法对烟草进行遗传转化,获得PCR阳性植株25株。通过qRT-PCR(表1)分析转基因烟草中MsZAT10的表达量(图5),结果显示,MsZAT10在转基因烟草中均有表达,其中有3个株系的MsZAT10基因表达量较高,分别是OX3、OX15和OX23,因此后续研究以这3个转基因株系为材料。
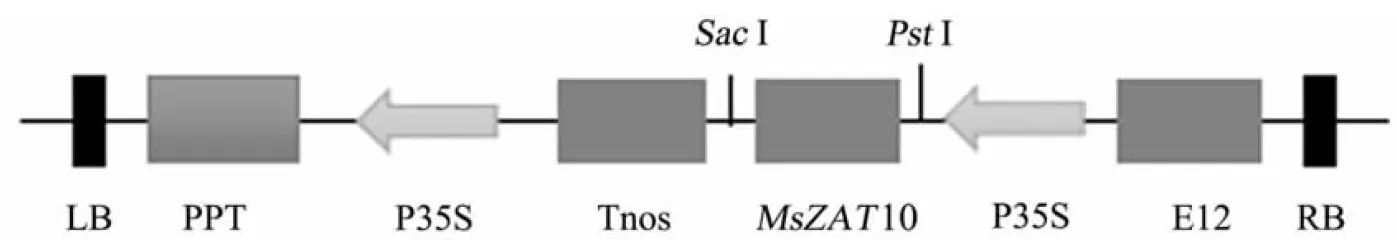
图4 植物pCBM-MsZAT10过表达载体的构建
2.4 转MsZAT10基因烟草低温胁迫表型及电导率分析

图5 过表达MsZAT10幼苗中的MsZAT10表达水平
选取大小及生长状态一致的4周龄转MsZAT10基因烟草和野生型烟草置于4 ℃处理4 h后,再置于-4 ℃处理2 h,观察表型变化,可以看到转MsZAT10基因烟草叶片的萎蔫程度明显低于野生型烟草(图6A)。测烟草叶片的电导率发现转MsZAT10基因烟草叶片的电导率比野生型烟草低。其中OX23的电导率较野生型烟草相比下降了21.47%,其次是OX3下降了18.07%,最后是OX15下降了15.31%。说明转MsZAT10基因烟草的细胞质膜受损伤程度较野生型烟草轻(图6B),说明转MsZAT10基因烟草具有较强的抗寒能力。
2.5 低温胁迫下转基因烟草生理指标的测定
选取大小及生长状态一致的4周龄转MsZAT10基因烟草和野生型烟草经0 ℃处理5 h,取叶片测定其生理指标(图 7)。低温处理后,3个转MsZAT10基因烟草的脯氨酸和可溶性蛋白含量均显著高于野生型烟草,其中OX3较野生型相比升高55%和52%,OX15升高48%和42%,OX23升高62%和57%。而3个转MsZAT10基因烟草的MDA含量明显低于野生型烟草,其中OX3较野生型相比下降38%、OX15下降31%、OX23下降35%。以上结果表明转MsZAT10基因烟草具有较强的抗寒能力。

图6 低温处理后WT和转MsZAT10基因烟草的表型和电导率

图7 低温胁迫下WT和转MsZAT10基因烟草的生理指标

图8 在300 mmol·L-1 NaCl处理下,WT和转MsZAT10基因烟草的表型和叶绿素含量
2.6 转MsZAT10基因烟草耐盐性分析
取叶圆片,在300 mmol·L-1NaCl中处理(图 8A),随着时间的增长转MsZAT10基因烟草和野生型烟草的叶圆片均受到不同程度的盐胁迫损伤。处理4 d后观察到野生型烟草叶圆片白化,而转MsZAT10基因烟草叶圆片保持绿色。对照组中转MsZAT10基因烟草和野生型烟草的叶绿素含量差异不显著,但在处理组中转MsZAT10基因烟草的叶绿素含量显著高于野生型烟草,其中最高的是OX15,比野生型高82%;其次是OX23,比野生型高81%;最后是OX3,比野生型高62%(图 8B)。以上结果表明,转MsZAT10基因烟草具有较强的抗盐能力。
3 讨论与结论
C2H2型锌指蛋白家族是植物中转录因子数目居多的庞大家族,功能也较复杂。研究表明,C2H2型锌指蛋白广泛参与植物生长和发育等生物过程,包括表皮形成,种子发芽,花器官发育,主要的microRNA生物合成等[14]。一些C2H2型锌指蛋白也参与了非生物胁迫应答。近年来克隆获得了许多与非生物胁迫相关的植物锌指蛋白基因,这些基因在应对外界不利的环境中发挥了重要的作用。Zhang等[15]从番茄(Lycopersiconesculentum)克隆到C2H2型基因SlCZFP1,该基因受低温、干旱、盐胁迫诱导,过表达SlCZFP1可显著提高转基因拟南芥的低温抗性。拟南芥ZAT18基因受干旱胁迫诱导,过表达ZAT18基因的拟南芥植株表现出较强的干旱抗性,而该基因的突变体则降低了对干旱胁迫的抗性[16]。番茄的SIZF3基因被盐诱导,转SIZF3基因的番茄和拟南芥表现出较强的抗盐性[17]。小麦(Triticumaestivum)的一个新型C2H2型锌指蛋白TaZNF的编码基因受盐胁迫诱导。转TaZNF拟南芥植株,会极大地增强耐盐能力[11]。在紫花苜蓿低温胁迫转录组测序工作中,发现MsZAT10基因明显上调表达,暗示该基因可能在紫花苜蓿抵抗低温胁迫过程中发挥重要作用。ZAT10属于双锌指结构域类的锌指蛋白,有研究表明ZAT10参与植物不依赖ABA的低温信号转导途径,还受到上游ZAT12与CBFs信号通路的调控,同时下游的低温相关基因COR被其调控[18]。此外还有研究表明,MAPK激酶磷酸化途径可能直接调节转录因子ZAT10[19-20]。本研究克隆获得的MsZAT10基因具有2个锌指蛋白结构域(图1),有典型的QALGGH保守基序(图3),属于C2H2型锌指蛋白。紫花苜蓿MsZAT10与蒺藜苜蓿MtZAT10的氨基酸有76%的同源性,有93个氨基酸差异位点,其中有31个替换、30个缺失以及32个插入(图3)。肇东苜蓿为多年生牧草,具有较强的抗寒、抗盐碱等抗逆能力,这些氨基酸差异可能是MsZAT10在肇东苜蓿抗逆性中起作用的关键位点。
为了研究MsZAT10在抗逆方面的功能,本研究通过农杆菌介导法获得过表达MsZAT10的烟草。在低温和盐胁迫下,转MsZAT10基因烟草表现出较强的抗性表型。同时,在低温胁迫下,转MsZAT10基因烟草的脯氨酸和可溶性蛋白含量都高于野生型烟草,而MDA含量低于野生型烟草。在逆境胁迫下,植物体内会积累大量的渗透调节物质,这些物质的含量变化可以作为评价植物耐受性的指标之一。其中最常见的渗透调节物质是脯氨酸和可溶性蛋白,其积累量与植物的抗逆性呈正相关[21]。比如,转枳(Poncirustrifoliata)PtrZPT2-1基因的烟草,在低温和盐胁迫下积累了更多的游离脯氨酸[22],转OsMSR15基因的拟南芥,在干旱胁迫下,积累了更多的游离脯氨酸[23]。脯氨酸含有亚氨基,可以与蛋白质的疏水结构域结合,积累更多的可溶性蛋白,进而维持低温胁迫时酶的构象[24]。研究发现低温胁迫后转HuCAT基因烟草的可溶性糖含量的增加幅度大于野生型烟草,由此可见,转HuCAT基因烟草有更强的耐寒性[25]。崔旭昕[26]研究表明,在低温处理条件下,转OsC2H2-12基因水稻(Oryzasativa)跟野生型相比积累了更高含量的可溶性蛋白和可溶性糖、更高的过氧化物酶活性,并且转OsC2H2-12基因水稻的叶绿素降解速度较野生型更慢一些,由此证明OsC2H2-12基因可以增强水稻的耐冷性。Xu等[27]研究表明,在低温处理下,转EjDHN1基因材料与对照组相比,转EjDHN1基因株系的植物生长明显优于野生型。EjDHN1可以保护细胞免受冷胁迫下活性氧产生的氧化损伤。EjDHN1过表达导致的耐寒性增强可部分归因于它们通过减轻氧化应激对膜的保护作用。Wang等[28]研究的转SlNAC35基因植株在低温胁迫下表现出高叶绿素含量、低活性氧物质积累和膜损伤。SlNAC35过表达增强了转基因番茄的耐寒性。本研究中,在低温胁迫下,转MsZAT10基因烟草与野生型烟草相比积累了更多的脯氨酸和可溶性蛋白,推测转MsZAT10基因烟草增强了耐冷性,可能是通过积累更多的渗透调节物质,减少胁迫带来的损伤,使植物细胞维持正常的生命活动。植物在受到低温胁迫时,细胞内会产生ROS,而ROS的产生和积累会导致膜脂发生过氧化作用,最后造成植物细胞的损伤[29]。MDA是膜脂过氧化产物,其含量的变化是衡量质膜受损程度的重要标志之一[30]。大豆GsZFP1基因在拟南芥植株中过量表达,提高了转基因植株的耐冷性,降低了转基因植株在低温胁迫下的MDA含量[31]。本研究中,在低温胁迫下,转MsZAT10基因烟草MDA含量明显低于野生型烟草,这说明过表达MsZAT10基因能够降低植物膜脂过氧化程度和膜系统的损伤,增强了转MsZAT10基因烟草对低温胁迫的耐受性。因此MsZAT10基因可以提高烟草对低温及盐胁迫的耐受性,本研究结果丰富了植物逆境胁迫抗性基因资源,并在植物抗逆分子育种中具有重要价值,为今后改良植物抗逆性奠定了基础。
