甘露糖对白三叶抗旱性、糖及糖醇类代谢物积累的影响
2019-12-20李州彭燕尹淑霞韩烈保
李州,彭燕,尹淑霞,韩烈保*
(1.北京林业大学草坪研究所,北京 100083;2.四川农业大学动物科技学院草学系,四川 成都 611130)
随着全球气候变暖,极端气候频发,可利用灌溉水资源锐减,干旱已成为威胁植物生长发育最主要的逆境胁迫因子之一[1]。白三叶(Trifoliumrepens)是一种重要的冷季型豆科草类植物,因其具有产量高、适口性好、粗蛋白含量高和生物固氮能力强等特点,在我国南方地区常作为优良牧草栽培种植。同时,由于白三叶具有匍匐生长特性强、再生速度快和叶型优美等特点,亦被广泛应用于观赏性草坪[2]。但白三叶喜冷凉湿润的环境,生长过程中需水量大,根系较浅,自身抗蒸腾能力差,干旱是限制白三叶栽培利用的关键阻碍因子[3]。因此,如何提高栽培管理过程中白三叶的抗旱性显得尤为重要。
前人研究已表明,在草坪养护管理和牧草栽培利用过程中,施用外源植物生长调节剂提高植物抗逆性具有操作简单、见效快和实用价值高等特点, 并已成功应用于提高白三叶、匍匐翦股颖(Agrostisstolonifera)、草地早熟禾(Poapratensis)等牧草及草坪草的抗旱性[4-6]。甘露糖(mannose,MAS)是一种植物体内广泛存在的单糖,可直接被利用合成糖蛋白参与免疫调节,也可合成其他代谢物例如抗坏血酸等,且相较于其他植物生长调节剂具有价格低廉、无毒副作用、低浓度调节效应显著等特点[7]。相关研究已发现匍匐翦股颖的抗旱性与甘露糖积累有关[5];转入甘露糖合成基因的拟南芥(Arabidopsisthaliana)耐旱性、耐酸性及耐盐性均显著提高[8];外源甘露糖浸种也能有效提高干旱胁迫下小麦(Triticumaestivum)种子的萌发[9]。这些研究证实甘露糖在提高植物抗旱性上发挥重要作用,但其调节植物抗旱性相关作用机制尚未完全揭示清楚,甘露糖是否能有效调节白三叶抗旱性也未见报道。因此,研究外源甘露糖提高白三叶抗旱性具有实际应用和理论研究意义双重价值。
本试验拟通过外施甘露糖提高白三叶抗旱性,并通过分析干旱胁迫下白三叶叶片水分含量变化、渗透调节能力、细胞膜透性、膜脂过氧化、抗氧化能力、光合响应等,并借助气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)技术检测胁迫下叶片内关键糖和糖醇类代谢物积累变化,从生理和代谢上揭示甘露糖提高白三叶抗旱性相关机制,也为将甘露糖应用到提高白三叶抗旱性栽培管理中奠定基础。
1 材料与方法
1.1 供试材料与处理
以广泛栽培种植的白三叶品种“拉丁诺”作为供试材料。于2018年进行试验,选取饱满良好的种子用0.1%高锰酸钾溶液消毒5 min后,蒸馏水反复清洗3次备用。将消过毒的种子均匀播种在装满石英砂的育苗盘中,每盘播种量为0.1 g。将播种好的育苗盘放入光照培养箱(21 ℃/18 ℃,白天/黑夜;时长各为12 h;相对湿度为75%;光强为700 μmol·m-1·s-1)中正常培养,用蒸馏水发芽7 d后改用霍格兰营养液继续培养23 d。当幼苗长至30 d时选取长势一致的材料进行聚乙二醇(polyethylene glycol,PEG)6000模拟干旱胁迫处理。
设置4个不同处理,每个处理4个独立重复,分别为1)处理1:C(对照,营养液正常培养生长);2)处理2:MAS+C(在营养液中加入50 mmol·L-1的MAS预处理3 d,然后更换为营养液继续正常培养);3)处理3:D(未经过MAS预处理的材料使用含-0.3 MPa PEG 6000的营养液进行模拟干旱胁迫);4)处理4:MAS+D(50 mmol·L-1的MAS预处理3 d,然后更换为含-0.3 MPa PEG 6000的营养液进行模拟干旱胁迫处理)。胁迫9 d后剪取叶片测定各项生理生化指标。
1.2 测定方法
1.2.1叶片相对含水量 剪取新鲜叶片0.2 g,用吸水纸包好后放入装有40 mL水的离心管中,室温下避光静置12 h,待叶片吸水饱和后取出,擦干叶片表面水分,称量饱和鲜重,然后置于鼓风烘箱中在105 ℃下杀青45 min,然后75 ℃下烘至恒重,称其干重,重复4次,取平均值。计算公式:相对含水量(%)=(鲜重-干重)/(饱和鲜重-干重)×100%。
1.2.2叶片渗透势 取0.2 g植物新鲜叶片,用吸水纸包好后放入装有40 mL去离子水的离心管中,室温下静置12 h,待叶片充分吸水后取出叶片,用吸水纸轻轻擦干叶片表面水分后,将叶片放入1.5 mL离心管中备用。使用挤压棒将叶片汁液充分挤压出来,吸取10 μL汁液放入渗透势测定仪中测定汁液渗透压。渗透势(MPa)=渗透压×0.001×2.58。
1.2.3叶绿素含量及光合相关参数 称取叶片0.1 g将其剪碎至2 cm长,装入具塞刻度试管中,加入丙酮-乙醇混合液(1∶1,V/V)10 mL,使叶片完全浸入混合液中,置于35 ℃恒温箱黑暗浸提。直至叶片完全变白,倾出浸提液,以提取液为对照,分别在分光光度计上测定OD645和OD663,并计算叶绿素含量[10]。采用PocketPEA连续激发式荧光仪(Hansatech,the United Kingdom)测定叶片叶绿素荧光(photochemical efficiency,Fv/Fm)。使用CIRAS-3便携式植物光合仪(PP Systems,USA)测定净光合速率(net photosynthetic rate,Pn)和水分利用效率(water use efficiency,WUE)。
1.2.4总抗氧化能力和丙二醛含量 自苏州科铭生物技术有限公司购买植物叶片总抗氧化能力测定试剂盒,根据说明书称取0.2 g新鲜植物叶片进行提取和反应,采用分光光度计法测定反应液吸光值。采用硫代巴比妥酸法测定丙二醛(malondialdehyde,MDA)含量,称取植物叶片0.4 g放入研钵中,加入液氮充分研磨均匀,待液氮完全挥发后加入2 mL预冷的磷酸缓冲液和0.1 g 聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)在冰上再次充分研磨,然后转入离心管中,用2 mL缓冲液充分清洗研钵,一并转入离心管中。4 ℃下15000 r·min-1离心20 min,上清液即为测定用提取液。向0.5 mL的提取液中加入1 mL的反应液(20% W/V的三氯乙酸和0.5% W/V的硫代巴比妥酸溶液),95 ℃水浴30 min,取出后在冰浴上快速冷却至室温,10000 r·min-1离心10 min,取上清液在532和600 nm处测定吸光值[11]。
1.2.5电解质渗透率 称取0.2 g新鲜叶片用去离子水冲洗4次后,用洁净滤纸吸去浮水,放入装有10 mL去离子水的试管中,真空渗入30 min使叶片完全浸入水中,在25 ℃下放置4 h,用电导仪测初电导率(S1),然后在沸水浴中煮15 min直到叶片完全杀死,冷却至室温后测定煮后终电导率(S2)。相对电导率=(煮前电导率S1/煮后电导率S2)×100%。
1.2.6可溶性总糖 将烘干至恒重后的叶片放入研钵中充分磨碎,准确称取5 mg磨碎的样品并倒入10 mL刻度离心管中,然后加入4 mL 80%乙醇,置于80 ℃水浴中不停搅拌40 min,离心,收集上清液,其残渣加2 mL 80%乙醇重复提取2次,合并上清液。在上清液中放入10 mg活性炭,80 ℃脱色30 min,然后用80%乙醇定容至10 mL,过滤后用于测定糖含量。吸取上述糖提取液1 mL,加入5 mL蒽酮试剂混合均匀,盖上塞子后在沸水浴中煮沸10 min,取出立即用冷水冷却至室温,在625 nm波长下测定溶液吸光值[12]。
采用气相色谱-质谱联用(GC-MS,PerkinElmer Inc., Waltham, USA)测定糖和糖醇含量:将植物叶片用锡箔纸包好放入冻干机中冻干至恒重,将冻干的叶片放入研钵中研磨均匀成粉末,准确称取0.05 g研磨均匀的粉末放入离心管中,加100 μL水和500 μL甲醇(甲醇∶氯仿=3∶1)充分震荡均匀,混匀后超声提取20 min。12000 r·min-1离心10 min,将300 μL上清液和10 μL氯苯丙氨酸(内标)转移至进样瓶中,置于浓缩仪中浓缩、干燥。在完全干燥(2.5 h)的样品加入 80 μL 15 mg·mL-1的甲氧胺/吡啶重新溶解,密封并混匀。置于30 ℃ 恒温培养箱内甲氧基化2 h。甲氧基化后开启瓶盖,加入80 μL BSTFA∶TMCS(99∶1),密封后充分混匀,70 ℃硅烷化1 h,然后放入GC-MS测定仪中进样分析[13]。
1.3 统计分析
采用Excel 2003统计数据并进行绘图,采用SAS 9.1进行方差分析和显著性检验(P<0.05)。
2 结果与分析
2.1 甘露糖对干旱胁迫下白三叶叶片水分和光合特性的影响
2.1.1甘露糖对干旱胁迫下白三叶叶片水分状况的影响 在干旱胁迫下,叶片相对含水量显著降低,但外源施用 MAS 预处理后则显著提高,MAS+D处理比D处理高29%。但正常水分条件下施用MAS对叶片相对含水量没有显著影响(图1)。在干旱胁迫下,叶片渗透势显著降低,MAS预处理下进一步降低。
2.1.2甘露糖对干旱胁迫下白三叶叶片光合特性的影响 外源施用MAS显著提高叶片叶绿素含量(图2),MAS+C处理比C处理高12%,且MAS+D处理比D处理高50%。与C处理相比,干旱胁迫显著降低了白三叶叶片Fv/Fm和净光合速率,但添加MAS则能显著提高。干旱胁迫能显著诱导叶片水分利用效率的提高,MAS+D处理比D处理高28%。
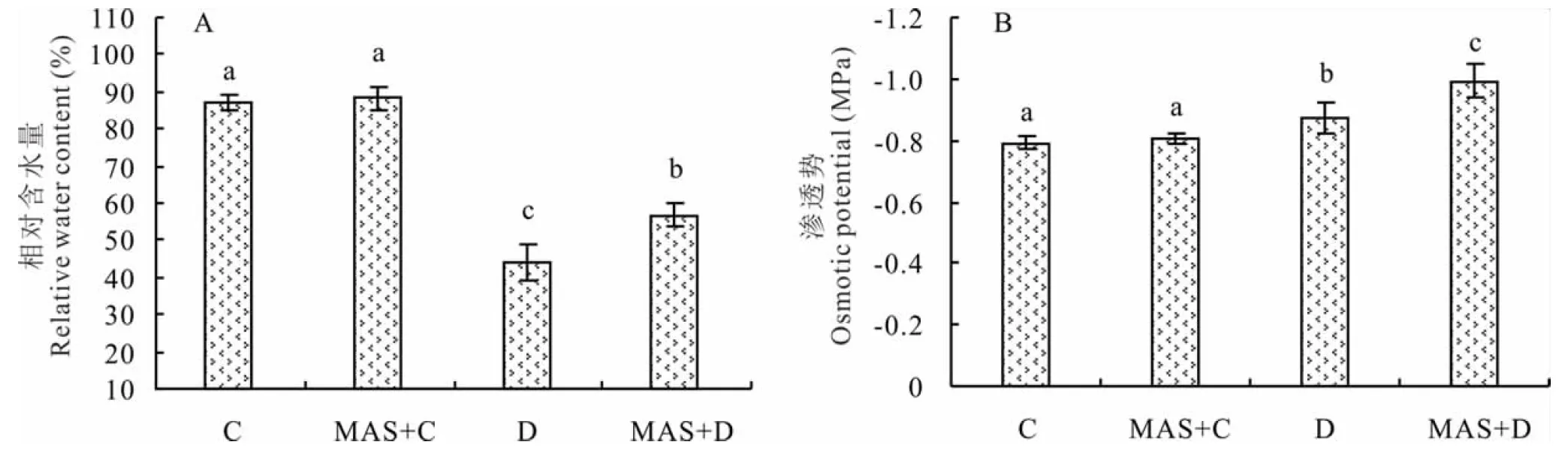
图1 甘露糖对干旱胁迫下白三叶叶片相对含水量和渗透势的影响
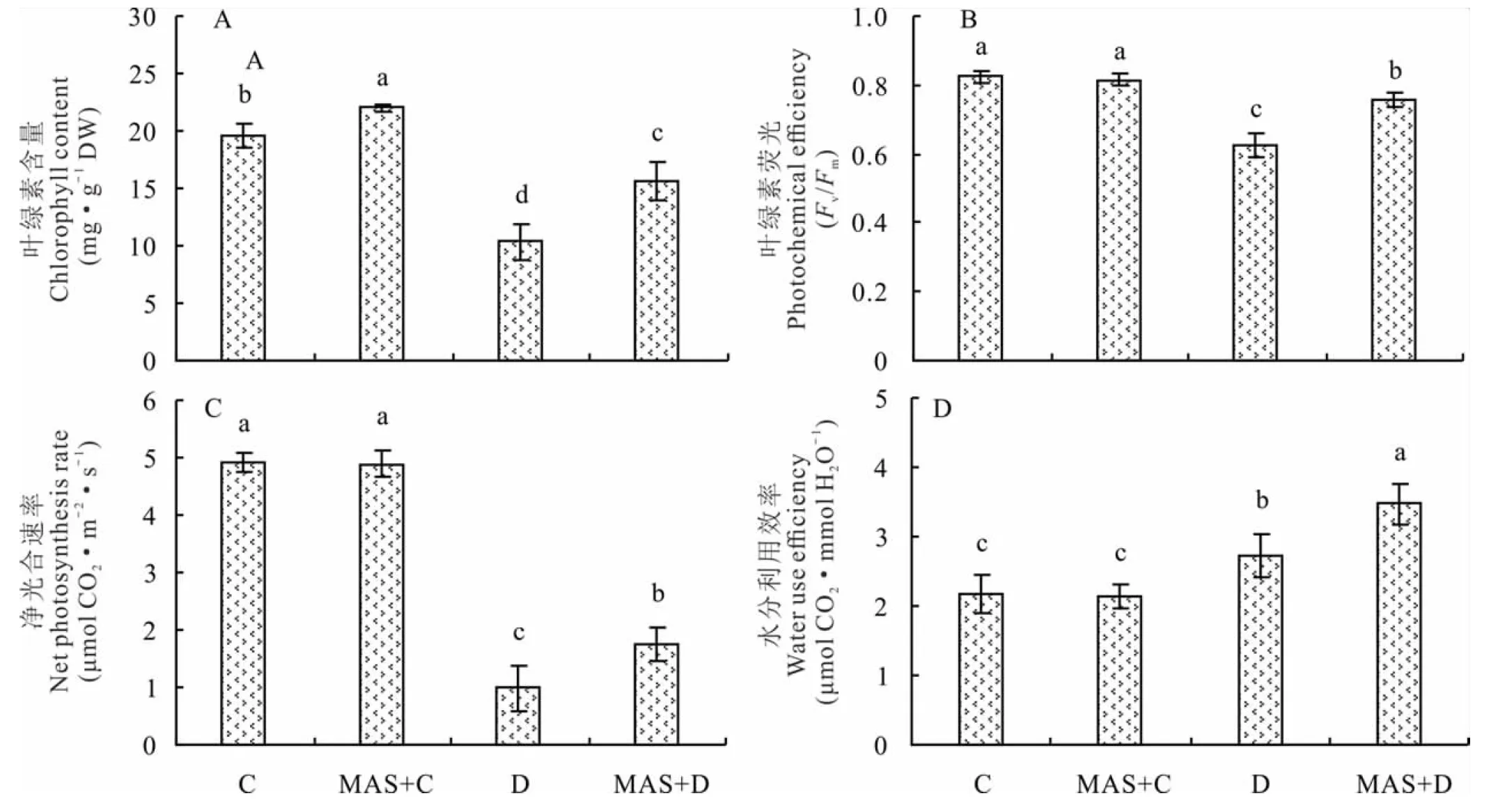
图2 甘露糖对干旱胁迫下白三叶叶片叶绿素和光合参数的影响
2.2 甘露糖对干旱胁迫下白三叶叶片抗氧化能力及细胞膜稳定性的影响
正常水分条件下,外源施用MAS没有对叶片总抗氧化能力、丙二醛含量和电解质渗透率产生显著影响(图3)。D处理下,叶片总抗氧化能力有所提升,幅度不大,但D+MAS处理的总抗氧化能力急剧上升。D+MAS处理的叶片总抗氧化能力是D处理的1.8倍。D+MAS和D处理均能显著提高叶片丙二醛含量和电解质渗透率,但D+MAS处理比D处理均降低22%。

图3 甘露糖对干旱胁迫下白三叶叶片抗氧化能力和膜稳定性的影响
2.3 甘露糖对干旱胁迫下白三叶叶片糖及糖醇的影响

图4 甘露糖对干旱胁迫下白三叶叶片可溶性总糖的影响
2.3.1甘露糖对干旱胁迫下白三叶叶片可溶性总糖的影响 干旱胁迫诱导白三叶叶片内可溶性糖含量显著升高,与正常处理C相比较,D处理和MAS+D处理的可溶性糖含量分别上升了94%和124%(图4)。正常条件下,施用外源MAS略微提高叶片可溶性糖含量,但差异不显著。干旱条件下,外施MAS能显著提高叶片可溶性糖含量,即MAS+D处理比D处理高15%。
2.3.2甘露糖对干旱胁迫下白三叶叶片单糖的影响 通过GC-MS分析鉴定,6种不同的单糖被检测到,包括甘露糖、葡萄糖、果糖、半乳糖、木糖和来苏糖(图5)。在没有外施MAS的情况下, 干旱胁迫没有引起叶片内甘露糖含量的积累,而应用外源MAS显著提高。与正常条件相比较,干旱胁迫显著降低了叶片内葡萄糖含量,但MAS预处理后维持在正常水平。干旱胁迫导致果糖在叶片内显著积累,MAS+C处理是C处理的2.27倍,MAS+D处理比D处理高30%。在正常条件和干旱胁迫下,MAS预处理均能显著提高半乳糖和木糖在叶片内的积累。MAS+C处理的来苏糖含量是C处理的2倍,处理D和MAS+D中显著提高,但两处理间差异不显著。
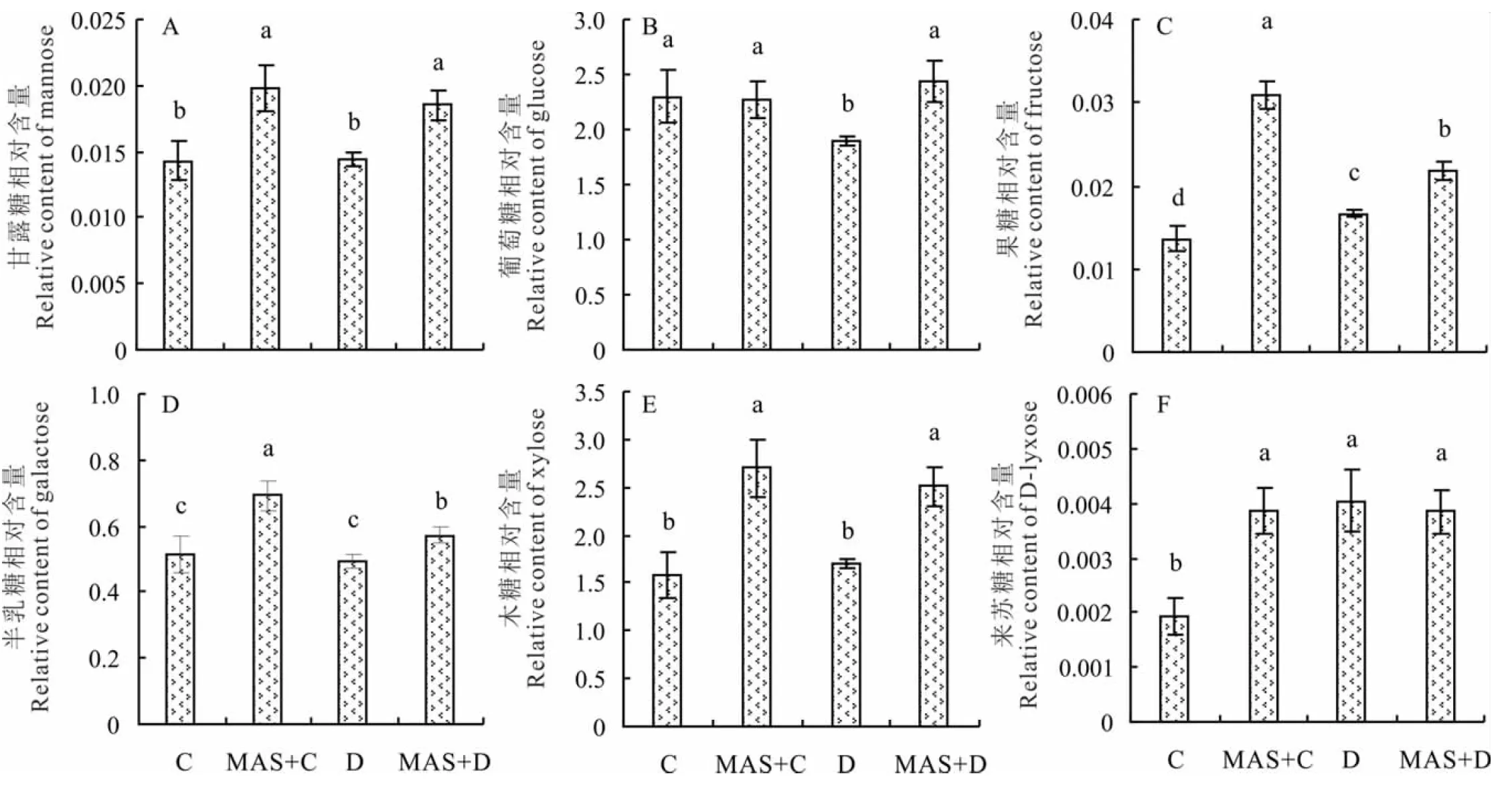
图5 甘露糖对干旱胁迫下白三叶叶片单糖的影响
2.3.3甘露糖对干旱胁迫下白三叶叶片双糖的影响 3种不同的多糖(蔗糖、麦芽糖和海藻糖)在白三叶叶片内被检测到。叶片蔗糖含量在干旱胁迫下显著升高,外施MAS预处理进一步提高了干旱胁迫诱导的蔗糖积累(图6)。MAS诱导了麦芽糖的显著积累,MAS+C处理是C处理的4.9倍。白三叶叶片内海藻糖含量在干旱胁迫下显著下降,MAS+C处理比C处理低27%,而MAS+D处理比D处理高38%。
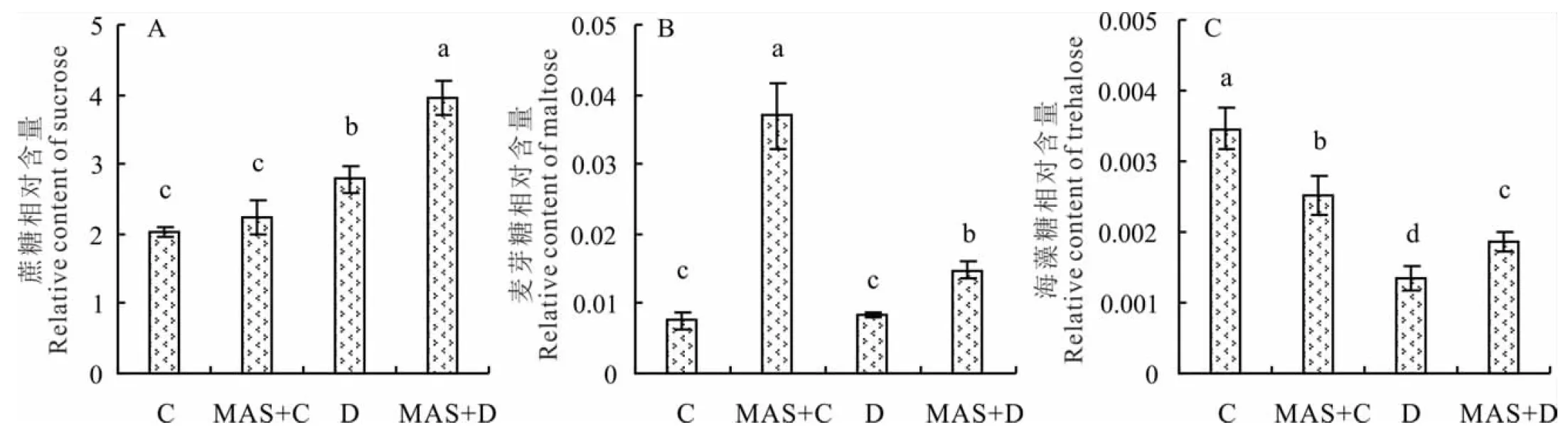
图6 甘露糖对干旱胁迫下白三叶叶片双糖的影响
2.3.4甘露糖对干旱胁迫下白三叶叶片糖醇的影响 外施MAS对白三叶叶片内肌醇的积累影响较小,干旱胁迫没有显著诱导肌醇的积累,但干旱胁迫显著提高了外施MAS后叶片中肌醇的积累(图7)。MAS+D处理的丙三醇含量显著高于D处理,而处理C和处理MAS+C之间没有显著差异。4个不同处理之间松醇含量均差异显著,其中MAS+D处理最高,D处理次之,MAS+C处理第3,C处理最低。
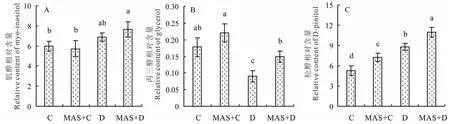
图7 甘露糖对干旱胁迫下白三叶叶片糖醇的影响
3 讨论与结论
叶片萎蔫是植物响应干旱胁迫最明显的症状,但在长期进化适应过程中,植物产生了许多调节机制以应对干旱胁迫造成的水分亏缺,其中渗透调节能力显得尤为重要。植物渗透调节作用主要受细胞内有机渗透溶质和无机渗透调节离子积累的影响。有机渗透调节物质包括可溶性糖类和游离氨基酸等,而无机离子Na+、K+、Ca2+及Mg2+等也参与细胞渗透调节[14]。研究发现,积累渗透调节溶质除具有调节细胞渗透势,维持干旱胁迫下水分平衡和防止叶片萎蔫外,还具有重要的渗透保护功能,起到维持细胞膜稳定性及蛋白质结构等作用[15]。本试验研究结果显示,外施甘露糖预处理能使白三叶在干旱胁迫下维持显著较高的叶片相对含水量,说明甘露糖能显著缓解干旱造成的叶片失水。通过进一步测定叶片渗透势发现,叶片渗透势随干旱胁迫而下降,甘露糖处理后能使叶片渗透势进一步降低,说明甘露糖通过调节细胞渗透势从而有助于维持叶片水分平衡,增强植株抗旱性。此外,干旱胁迫促进叶绿素降解从而加快叶片衰老,植物光合作用受到抑制。干旱胁迫下植物保持较高的光合作用有助于代谢物合成从而有利于维持生长和渗透调节物质积累[16]。本研究发现,干旱胁迫下白三叶叶片叶绿素含量、叶绿素荧光和净光合速率急剧下降,植株受损严重。但外施甘露糖后白三叶在干旱胁迫下维持了显著较高的叶绿素荧光参数和净光合速率,叶绿素降解减慢,说明甘露糖调节白三叶抗旱性与提高植株光合特性有关。前人的研究也表明,干旱胁迫下提高水分利用效率是植物增强抗旱性的有效途径之一[17-18]。在本试验中,白三叶叶片在干旱胁迫下水分利用效率显著提高,说明白三叶在遭遇干旱胁迫时通过提高自身水分利用效率进而提高抗旱性。有趣的是,当外施甘露糖后白三叶叶片水分利用效率进一步提升,表明白三叶植株在干旱胁迫下维持水分利用和平衡的能力得到进一步增强,有利于白三叶更好地适应干旱环境。
干旱等逆境胁迫会诱导过氧化氢(H2O2)和超氧阴离子(O2-·)等活性氧(ROS)大量积累,打破植物细胞正常条件下所维持的ROS动态平衡。逆境胁迫下ROS的大量积累必然引起细胞氧化损伤,膜脂过氧化产物积累,细胞膜透性增强等,严重影响植物生长发育直至植株死亡[19-21]。本试验发现,外施甘露糖显著提升了白三叶叶片总抗氧化能力,并有效降低干旱胁迫诱导积累MDA,增强干旱胁迫下细胞膜稳定性。已有研究表明,1%的甘露糖可以显著增强小麦叶片黄化过程中过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)和抗坏血酸过氧化物酶(ascorbate peroxidase,AXP)多种抗氧化酶活性,减轻氧化伤害,从而延缓叶片衰老[22]。Ai等[23]研究发现,转导甘露糖合成相关基因PpGMP的烟草(Nicotianatabacum)抗旱性和耐盐性显著提高,这与转基因植株在干旱和盐胁迫下具有显著较高的抗坏血酸(ascorbic acid,AsA)含量和超氧化物歧化酶(superoxide dismutase,SOD)活性有关,使得转基因植株能在胁迫下维持显著较高的抗氧化防御能力,降低MDA和H2O2积累。此外,过量表达DoGMP1的拟南芥在盐胁迫下也具有显著较高的AsA含量,增强了细胞清除ROS的能力,转基因植株比野生型表现出更强的耐盐性[24]。本试验结果与这些研究相一致,即甘露糖通过提高白三叶抗氧化防御能力有效缓解干旱引起的细胞氧化伤害,提高植株抗旱性。
如上所述,干旱胁迫下植物通过积累可溶性糖类以降低细胞渗透势,调节水分平衡,增强植株抗旱能力。通过测定白三叶叶片内可溶性糖含量发现,干旱胁迫显著诱导了叶片内可溶性糖含量积累,而外源添加甘露糖预处理能进一步促进干旱下可溶性总糖在叶片内的积累,这与甘露糖进一步降低干旱胁迫下叶片内渗透势相一致。此结果也表明甘露糖促进糖类代谢物积累可能是诱导干旱胁迫下白三叶细胞水势降低的重要原因。进一步利用 GC-MS 检测不同糖和糖醇类代谢物在白三叶叶片内的变化后发现,甘露糖显著诱导干旱胁迫下白三叶叶片内积累更多的甘露糖、葡萄糖、果糖、半乳糖、木糖、蔗糖、麦芽糖和海藻糖。干旱胁迫下积累碳水化合物不仅有利于提高植物细胞渗透势,而且也起到保护细胞膜和其他细胞大分子的作用[15,25-26]。近期的研究发现外源壳聚糖通过促进干旱胁迫下白三叶叶片积累多种糖类并增强渗透调节能力,从而维持较好的生长和抗旱能力[27]。伽马氨基丁酸显著提高干旱胁迫下匍匐翦股颖抗旱性与甘露糖和麦芽糖积累有关[5]。本试验也显示,正常条件下外施甘露糖也能显著提高内源甘露糖、果糖、半乳糖、木糖和来苏糖的含量。结合这些研究结果,一方面说明白三叶叶片中不同糖类对干旱胁迫的响应有所不同,另一方面证实甘露糖能诱导或维持多种单糖和多糖的积累,在白三叶应对干旱胁迫过程中维持渗透调节和能量供给起重要作用,且为植株生长提供保障。此外,外施甘露糖也能显著提高干旱胁迫下肌醇、丙三醇和松醇的含量。Yildizli等[28]研究显示,外源喷施肌醇通过显著降低细胞膜氧化伤害及调节叶片水分状况从而有效提高胡椒(Capsicumannuum)幼苗抗旱性。丙三醇具有很强的水合作用,也涉及细胞信号转导的调节,其积累有利于细胞抗冻和抗旱性的提高[29]。因此本研究中甘露糖诱导白三叶积累更多的糖醇也参与调节细胞渗透势和抗氧化能力,进而提高白三叶抗旱性。
综上所述,干旱胁迫显著降低白三叶叶片含水量、叶绿素含量、叶绿素荧光和净光合速率,导致膜脂过氧化加剧,细胞膜稳定性降低,植株受损严重。但白三叶能够通过提高自身水分利用效率及降低渗透势以适应干旱胁迫。外施适宜浓度的甘露糖(30 mmol·L-1)能显著提高干旱胁迫下白三叶叶片光合作用、抗氧化和渗透调节能力,从而有效缓解干旱诱导的氧化伤害并维持良好的水分状况,提高植株抗旱性。通过对不同糖及糖醇类代谢物含量变化的测定发现,不同糖类积累对干旱胁迫响应有所不同,甘露糖能在正常及干旱条件下诱导多种糖和糖醇的积累,这既提高了干旱胁迫下细胞渗透调节能力,也为白三叶生长和代谢供能提供更多的可利用碳水化合物。
