锰胁迫对黄花草种子萌发及幼苗生理生化特征的影响
2019-12-20肖泽华李欣航潘高吴耀文杨灿鑫匡雪韶刘文胜
肖泽华,李欣航,潘高,吴耀文,杨灿鑫,匡雪韶,刘文胜*
(1.中南林业科技大学生命科学与技术学院,湖南 长沙 410004;2.湖南省环境资源植物开发与利用工程技术研究中心,湖南 长沙 410004)
锰作为植物生长所必需的微量元素之一,参与植物光合作用、酶促反应和氧化还原等活动,在植物生命活动中具有不可替代的作用[1]。过量的锰则抑制植物生长,甚至通过食物链危害人类健康[2]。我国因锰矿开采等原因造成了大面积的锰污染区,严重影响人民生产生活。因而,治理锰矿区污染刻不容缓。植物修复作为一种成本低、适应范围广、环境扰动小且治理效果持久的重金属修复技术,是环境领域的研究热点[3]。因此,植物修复技术是锰污染治理的重要选择。
植物修复的前提是筛选出对重金属具有耐性,且经济利用价值较高的植物。种子萌发至幼苗生长是植物对环境胁迫最敏感的时期,是筛选修复植物的较好时期。胁迫环境下植物的生长往往会受到抑制,主要表现为生物量、叶绿素含量下降及积累大量丙二醛(malondialdehyde,MDA),而抗氧化酶活性及渗透调节物质等的变化是植物对胁迫的直接反应,体现了植物对胁迫的耐性,是其适应胁迫环境的重要依据[4]。抗氧化酶系统主要由超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)组成,SOD是一种可清除植物体内具有强烈毒性超氧阴离子自由基的酶,反应产物H2O2可被CAT进一步分解或被POD利用。渗透调节物质中的脯氨酸、可溶性蛋白和可溶性糖在植物适应重金属胁迫中发挥着重要作用,能够维持细胞的含水率和渗透势,保护生物大分子,降低因渗透失水所带来的损伤。因此,研究种子萌发和幼苗生理的变化特征对污染土壤的修复具有实际意义。
黄花草(Cleomeviscosa)为山柑科(Capparaceae)白花菜属(Cleome)的一种一年生草本植物,在全世界热带与亚热带均广泛分布,主要分布在我国南方各省。该植物生物量大、株型美观、生长速度快、抗逆性强、种子量大,可作为植被恢复的先锋物种[5]。通过在湖南湘潭锰尾矿实地调研,发现该植物是锰矿废弃地优势植物之一,在该锰矿废弃地能正常开花结实,是一种值得开发用于锰尾矿植物修复的材料。目前,对黄花草的研究较少,主要集中于种子萌发特性、植被恢复和药用价值等方面[5-6],关于锰胁迫下种子萌发、幼苗生长及生理特性的研究尚未见报道。
本研究根据不同锰浓度胁迫下黄花草种子的萌发特性、幼苗生长和生理特征,探明该植物在锰胁迫下的生理耐受机制,研究结果可作为认识植物生长适应锰污染的基础数据,同时为利用黄花草作为锰污染的修复植物提供理论依据。
1 材料与方法
1.1 试验材料
供试黄花草种子于2016年11月下旬种子成熟时期采于湖南省湘潭锰矿区。该矿是我国开发最早的锰矿之一,矿区废弃地污染严重。现场调查显示,该地黄花草长势良好,以草丛形式在多处出现。选择该地区长势相同的100株黄花草,采集其种子并置于信封带回实验室室温保存备用。
1.2 试验方法
1.2.1种子萌发试验 挑选颗粒饱满、大小及色泽一致的种子进行萌发试验。将种子在0.5%的KMnO4溶液中浸泡30 min,然后用去离子水彻底清洗干净。根据赵怀宝等[5]和预试验的研究结果,本研究认为500 mg·L-1赤霉素(gibberellin,GA)溶液浸种能提高黄花草种子的萌发率。为检验赤霉素的效果,一批种子在500 mg·L-1赤霉素溶液中浸泡24 h;作为对照,另一批种子则在去离子水中浸泡24 h。然后将种子置于直径为120 mm的培养皿中,其内装200 mL经过清洗灭菌及过2 mm筛的沙子。参照潘高等[7]的方法,利用MnCl2·4H2O分别设置0,1000,5000,10000,15000,20000 μmol·L-1(分别记为CK、T1、T2、T3、T4、T5,下同) 6个锰浓度(组)。每组处理5个重复,每个培养皿30粒种子。将培养皿放置在人工气候培养箱,设置温度为(30±0.5)℃,12 h光照/12 h黑暗,相对湿度为70%。每天添加去离子水保持培养基质湿润。播种后每天定时观察并记录种子萌发情况,以胚根伸出种皮且长度达到种子直径1/2作为种子萌发的标志。连续统计萌发率直至连续3 d无新种子萌发即认为萌发结束,在第7天统计发芽势,第16天统计萌发率。萌发结束后测定黄花草幼苗的根长、芽长、鲜重、干重,并计算发芽指数、活力指数、根冠比。
1.2.2幼苗生长试验设计 幼苗生长试验采用盆栽沙培法,盆钵内装200 mL过2 mm筛的洁净沙子,置于与萌发试验相同条件的人工气候培养箱中。挑选与萌发试验同一批的黄花草种子进行播种,每盆10粒种子。每天添加去离子水保持种子萌发环境所需水分,幼苗长出2至4片真叶时用Hoagland营养液进行培养。设置与萌发试验相同的锰浓度处理,每个处理重复10次,待长出6至8片真叶且长势相同时利用MnCl2·4H2O进行锰胁迫[8]。分别在胁迫后的第7、15和30天时选取黄花草幼苗中、上部位的叶片进行生理生化试验。
1.3 测定项目和方法
1.3.1种子萌发指标测定 黄花草种子萌发相关指标的测定参考黄玉梅等[8]的方法。
发芽率=16 d内正常发芽的种子数/供试种子数×100%
发芽势=7 d内正常发芽种子数/供试种子数×100%
发芽指数(GI)=∑(Gt/Dt)
活力指数(VI)=GI×S
式中:Gt为在t日的发芽种子数;Dt为发芽天数;S为幼苗高度。
1.3.2幼苗生物量指标测定 萌发第16天时,每个浓度处理随机选取10株幼苗,用精度为0.1 mm的游标卡尺测定幼苗的根长、芽长;用滤纸吸去幼苗表面的水分后称量鲜重,再于95 ℃下杀青10 min,70 ℃下烘至恒重。
根冠比=根干重/地上部干重
1.3.3生理生化指标测定 采用丙酮浸提法测定叶绿素含量[9];采用蒽酮比色法测定可溶性糖含量[9];采用考马斯亮蓝法测定可溶性蛋白含量[9];采用酸性茚三酮显色法测定游离脯氨酸含量[9];采用硫代巴比妥酸法测定丙二醛含量[9];采用氮蓝四唑法测定超氧化物歧化酶活性[9];采用愈创木酚法测定过氧化物酶活性[9];采用紫外吸收法测定过氧化氢酶活性[9]。各指标测定重复3次,每次称取新鲜黄花草叶片0.3 g。
1.4 数据处理
种子萌发及幼苗生理各指标的数据结果均以“平均值±标准差”表示。采用SPSS 19.0统计软件对数据进行单因素方差分析(One-way ANOVA),并利用最小显著差数法(LSD法)对每个指标不同处理间的差异显著性进行多重比较。最后使用Sigma Plot 12.5作图。
2 结果与分析
2.1 锰胁迫对黄花草种子萌发及幼苗生长的影响
在去离子水浸种的处理下,黄花草种子的发芽势、发芽指数和活力指数随着锰浓度的增加(表1),总体呈下降趋势。T1处理与对照相比黄花草种子萌发各项指标差距不大,但T2~T5处理与对照和T1相比均形成显著性差异。T2~T5处理使黄花草种子的发芽率分别降低了38.78%,36.72%,28.56%,30.60%。可见当锰浓度达到T2处理时,对黄花草种子的萌发产生较强的抑制作用。在500 mg·L-1赤霉素浸种的处理下,黄花草种子的发芽势、发芽率、发芽指数和活力指数均随着锰浓度的增加,呈现总体下降的趋势,且比去离子水浸种处理的下降幅度大。CK(GA)、T1(GA)和T2(GA)处理的各项萌发指标均显著高于CK、T1和T2处理,可见赤霉素浸种对黄花草种子在较低浓度锰处理下的萌发具有促进作用。T5(GA)处理下的黄花草种子发芽率与T5无显著差异,但发芽势、发芽指数和活力指数均显著低于T5处理,分别降低了41.94%,29.52%,85.79%。可见当锰浓度达到T5处理时,赤霉素浸种处理对黄花草种子的萌发产生了较强的抑制作用。

表1 锰胁迫对黄花草种子萌发的影响
注:同列不同大写字母分别表示不同浸种处理下相同锰处理之间差异显著,不同小写字母分别表示相同浸种处理下不同锰处理下之间差异显著(P<0.05),下同。
Note: Different capital letters within the same column show significant differences among the same manganese treatments under different soaking treatments, different lowercase letters within the same column show significant differences among different manganese treatments under the same soaking treatments (P<0.05). The same below.
幼苗生长是植物对胁迫响应的综合体现[10]。随着锰浓度的增加,黄花草幼苗芽长、根长、生物量和根冠比均呈现先升高后下降的变化趋势(表2),且均在T2处理达到最大值,在T5处理达到最低值。说明低浓度锰对黄花草幼苗生长具有促进作用,高浓度则有抑制作用。
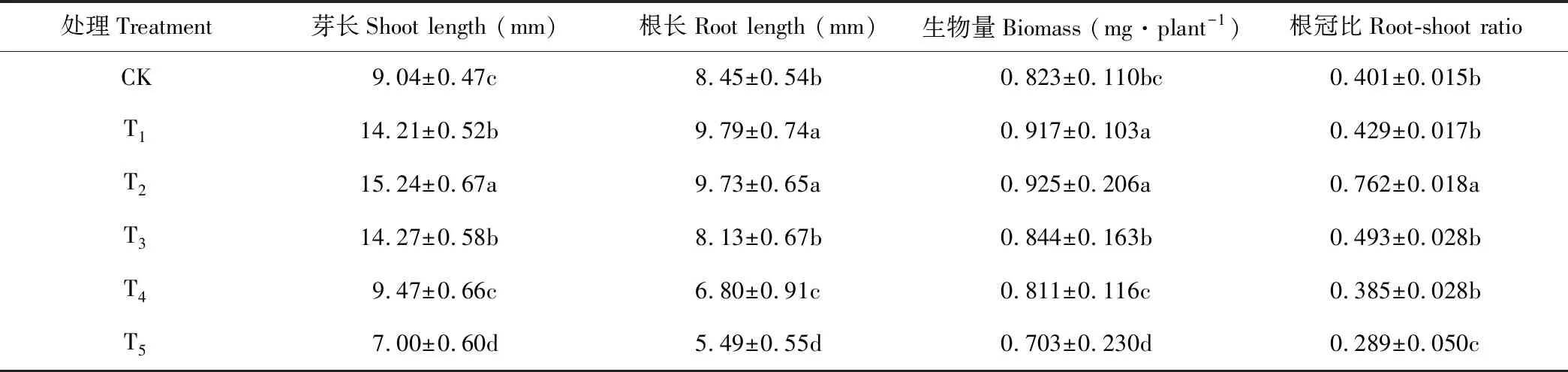
表2 锰胁迫对黄花草幼苗生长的影响
2.2 锰胁迫对黄花草幼苗叶绿素含量的影响
叶片叶绿素含量是反映植物光合能力的重要指标。在锰胁迫7 d时,黄花草幼苗叶绿素a、叶绿素b、叶绿素a+b含量及叶绿素a/b值随锰浓度的增加均呈现先上升后下降的趋势(表3),其中,T2处理显著提高了叶绿素含量,T3处理叶绿素a/b的值最高,呈现显著性差异。在处理15 d时,随着锰浓度的增加黄花草幼苗叶片叶绿素a、叶绿素b及叶绿素a+b含量值均呈先下降后升高的变化趋势,且在T3处理达到最低值,T5处理的叶绿素a、叶绿素a+b、叶绿素a/b值均比对照组要高,且差异达到显著水平,表明T3、T4和T5处理对黄花草叶绿素的合成产生了较大影响。在锰胁迫30 d时,T1处理下叶绿素a、叶绿素b、叶绿素a+b含量及叶绿素a/b值达到峰值,分别比对照增加了43.6%,2.9%,35.1%,38.4%,T5处理叶绿素a、叶绿素b、叶绿素a+b含量降到最低,叶绿素a含量降幅较大。整体上,T1、T2处理可增加黄花草叶绿素含量,T1增加效果最显著;T5处理会降低叶绿素含量,可能是因为高浓度锰抑制了黄花草叶绿素的合成。
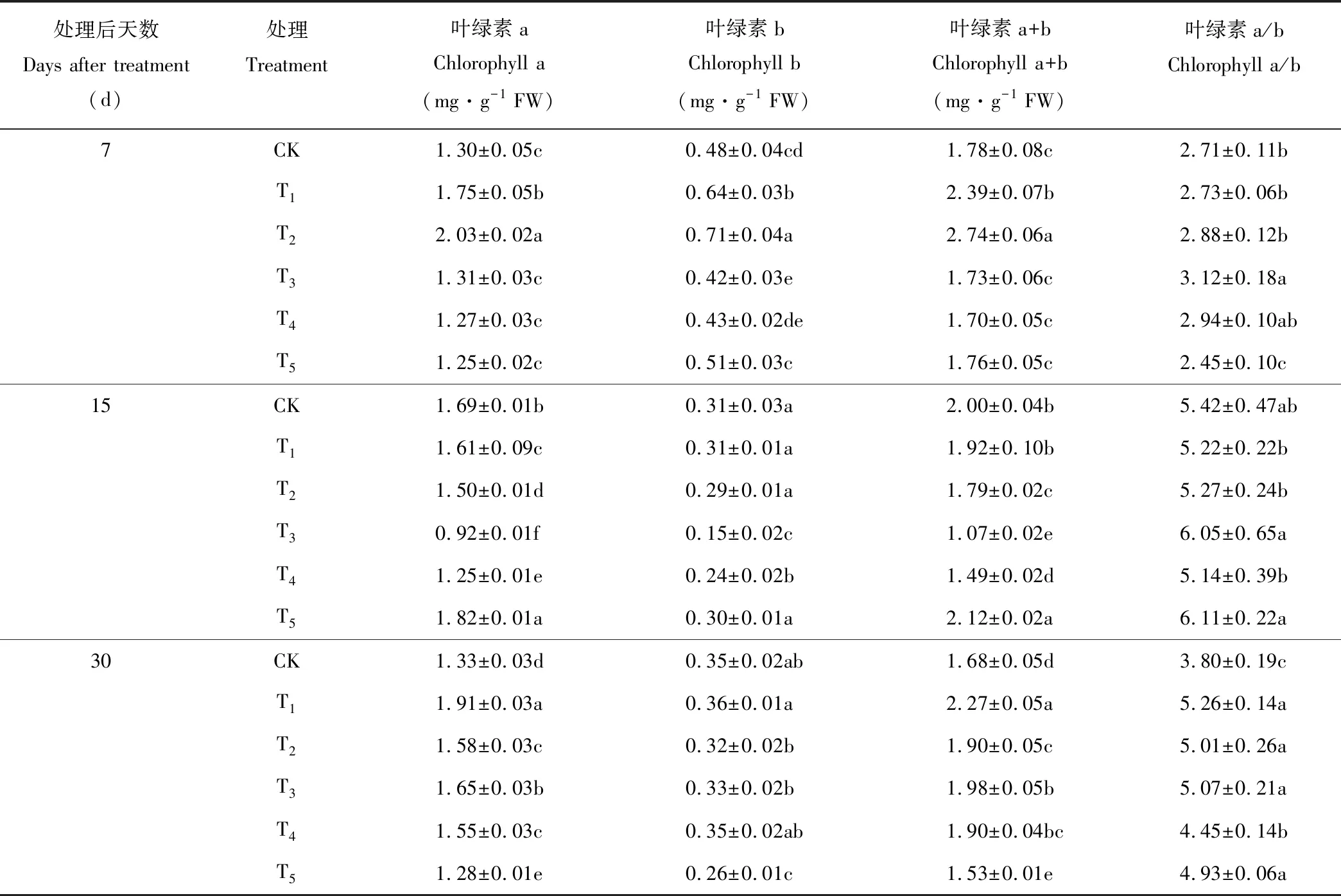
表3 锰胁迫对黄花草幼苗叶绿素含量的影响
2.3 锰胁迫对黄花草幼苗抗氧化酶活性的影响
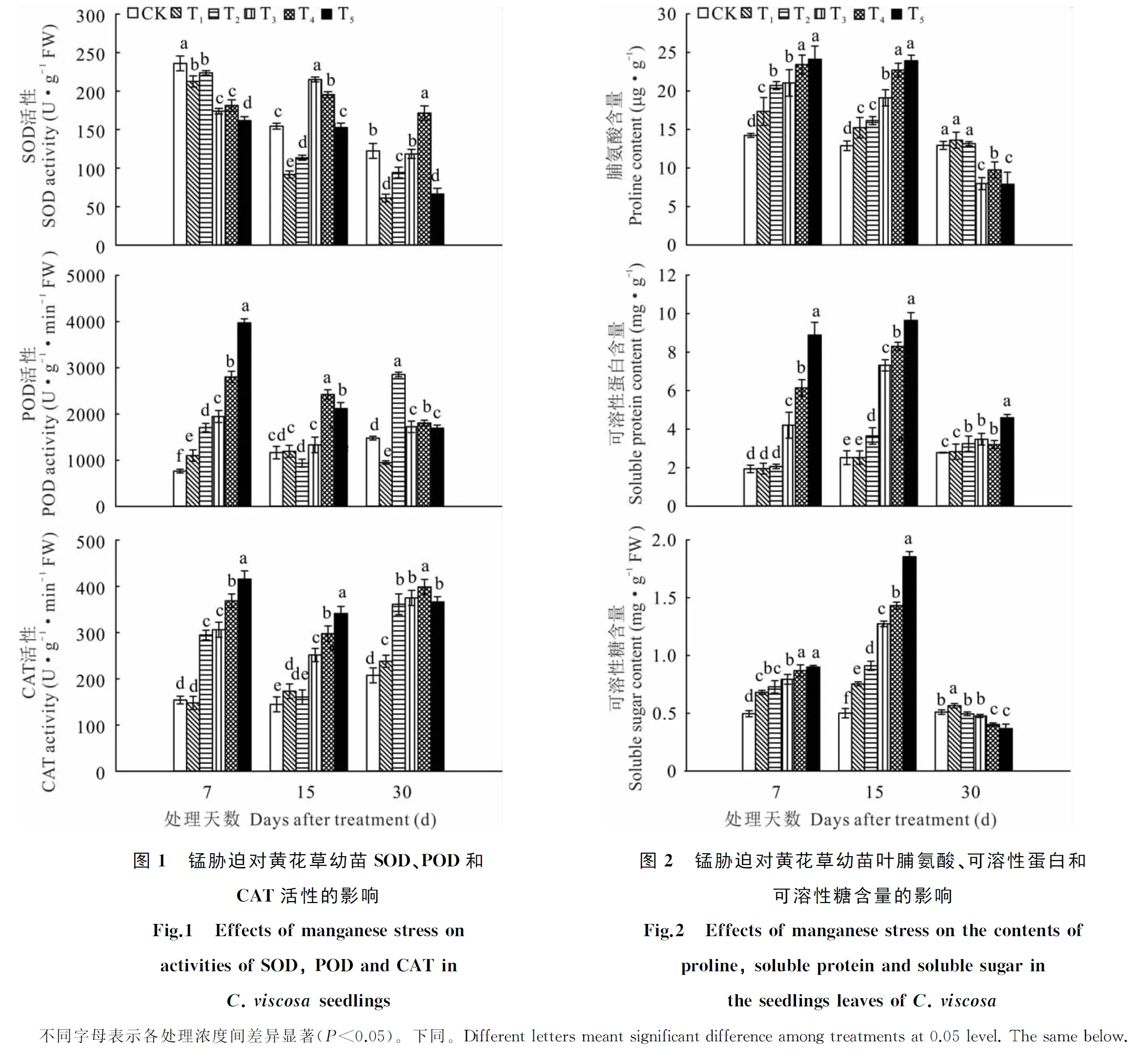
黄花草幼苗叶片SOD、POD和CAT活性在处理至第7天时具有明显的变化趋势(图1),但随处理时间延长,3种抗氧化酶活性的变化趋势则无明显规律。黄花草叶片SOD活性在胁迫第7天时,随处理浓度的增加呈下降趋势;15 d时,T3、T4处理下SOD活性达到最高值,T5处理与对照差异不显著;30 d时,只有T4处理下的SOD活性高于对照,T5比对照低45.7%。黄花草叶片POD的活性在处理第7天时随浓度的增加呈上升趋势,处理间差异显著;15 d时,T2~T5处理下的POD活性均分别低于第7天时各处理活性;在30 d时,T2处理达到该处理最大值,T4、T5处理继续下降。随处理时间的延长,T1处理的CAT活性逐渐升高;T2~T5处理下黄花草叶片CAT活性呈先下降后升高的变化趋势,T2~T4处理的最高值则出现在第30天,T5处理的最高值出现在第7天。结果表明,黄花草幼苗3种抗氧化酶活性在锰胁迫初期较高,可缓解高浓度锰胁迫造成的伤害,但随着胁迫时间的延长SOD和POD的活性出现不同程度的下降,而CAT的活性有所提高,说明高浓度锰胁迫后期黄花草的抗氧化能力衰退,CAT起清除活性氧的关键作用。
2.4 锰胁迫对黄花草幼苗叶片脯氨酸、可溶性蛋白、可溶性糖含量的影响
随处理浓度的增加,黄花草叶片中脯氨酸、可溶性蛋白和可溶性糖含量在第7、15天呈上升的趋势(图2)。处理第30天时,黄花草叶片中脯氨酸、可溶性糖含量随锰浓度的增加呈下降趋势,且相较第15天,可溶性糖含量的总体下降幅度大于脯氨酸,表明可溶性糖对锰胁迫更加敏感。可溶性蛋白含量在处理第30天依然呈随浓度增加而上升的趋势,但T3~T5处理明显降低了其含量。综上所述,黄花草幼苗在高浓度锰胁迫的前、中期可通过提高渗透调节物质来缓解毒害,但随胁迫时间的增加,这一机制就会受到破坏,主要表现在T3~T5处理。
2.5 锰胁迫对黄花草幼苗MDA含量的影响
植物器官衰老或在逆境下遭受胁迫时往往发生膜脂过氧化作用,MDA是膜脂过氧化的最终分解产物,其含量的高低可反映植物细胞遭受逆境胁迫的程度。随着锰浓度的增加,黄花草幼苗的MDA含量与对照相比呈先下降后升高的变化趋势;随着胁迫时间增加,高锰浓度处理下MDA含量均显著升高(图3)。T1处理下黄花草叶片MDA含量均低于对照组,但差异不显著;T2~T5处理MDA含量随锰浓度的增加和时间的延长上升幅度增大。在7、15和30 d时,T5处理下叶片MDA含量分别是对照组的3.1、3.5、3.6倍。综上表明,T1处理并不会胁迫损伤黄花草幼苗,T2处理会随时间延长逐渐表现出较小的胁迫效果,T3、T4、T5处理对黄花草幼苗表现出的胁迫效应会随时间延长而加大。
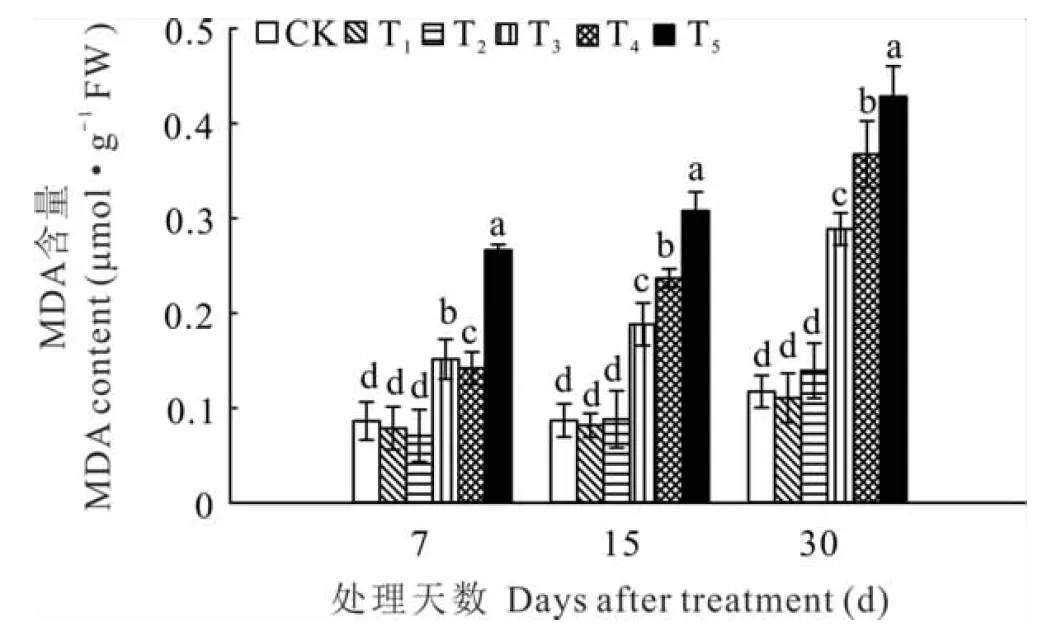
图3 锰胁迫对黄花草幼苗MDA含量的影响
3 讨论
3.1 锰胁迫对黄花草种子萌发及幼苗生长的影响
种子萌发与幼苗生长是植物对外界环境变化最敏感的阶段,也是植物生活史中最脆弱的时期,能够反映植物的适应能力[11]。植物能否在锰污染土壤上生存取决于其种子及幼苗在锰胁迫下是否可以萌发、生长,幼苗生长状况直接影响植株以后的生长发育。本研究中,黄花草种子的发芽势、发芽率、发芽指数和活力指数均随锰浓度的增加而下降,说明锰胁迫对黄花草种子的萌发有抑制作用。这与文珂等[10]对锰胁迫下野大豆(Glycinesoja)以及徐雅梅等[12]对锰、铅胁迫下垂穗披碱草(Elymusnutans)的研究结果一致。这表明锰胁迫对植物种子萌发有抑制作用是一种常见现象,原因可能是锰胁迫环境下种子内部储存物质的分解及转化受到抑制,进而影响种子萌发。
黄花草种子存在休眠现象,本研究前期试验显示采集种子后放置6个月,未见种子萌发。本研究是将该植物种子于室温下放置一年后开展萌发试验,但发芽率仍较低(50%左右)。采用500 mg·L-1赤霉素浸种处理后黄花草种子的发芽势、发芽率、发芽指数和活力指数在0~5000 μmol·L-1锰处理时均显著高于去离子水浸种处理,最高可达74.44%,说明赤霉素浸种对黄花草种子的萌发具有促进作用。当锰浓度达到15000~20000 μmol·L-1时,发芽率则无明显差异,说明赤霉素浸种对高浓度锰处理下种子的萌发无促进作用。这与陈志飞等[13]对干旱胁迫下赤霉素对高羊茅(Festucaelata)种子萌发以及牛宋芳等[14]对盐胁迫下赤霉素对红砂(Reaumuriasoongorica)种子萌发的研究结果一致。这说明胁迫条件下赤霉素处理效果具有交互作用。其原因可能是赤霉素在高胁迫条件下加速了种子的新陈代谢活动,却产生了较多的废物,导致种子发芽情况未能显著提高。这需要有更多的研究来验证这一结果。
本研究显示,在1000~5000 μmol·L-1锰处理下黄花草幼苗芽长、根长、干重和根冠比均高于对照且差异显著;当锰浓度达到20000 μmol·L-1时,幼苗芽长、根长、干重和根冠比则均显著低于对照,表明高浓度锰处理会对黄花草幼苗的生长产生显著抑制作用,这种低促高抑的现象与王佳等[15]对锰胁迫下美洲商陆(Phytolaccaamericana)幼苗生长的研究结果一致。本研究显示随着锰浓度的增加,黄花草幼苗根受到的抑制作用比芽大,这与多数研究结果一致[7-16]。原因可能是因为根最先接触锰,且是植物吸收和转运重金属的主要器官,导致受到的抑制程度大于芽。
3.2 锰胁迫对黄花草幼苗叶绿素含量的影响
叶绿素含量是衡量植物光合作用强弱的重要生理参数,间接体现植物对胁迫的适应能力[17]。在本研究中,低浓度(1000~5000 μmol·L-1)锰处理下黄花草幼苗叶片叶绿素a、叶绿素b、叶绿素a+b和叶绿素a/b均比对照组有所增加,而随着锰浓度的增加,这些指标则逐渐下降并在较高浓度低于对照组。这与侯明等[18]对钒、铬单一和复合胁迫下小麦(Triticumaestivum)幼苗叶片叶绿素含量及张雯莉等[19]对枸杞(Lyciumbarbarum)叶片在混合盐胁迫下叶绿素含量的研究结果一致。这说明低浓度锰处理会促进叶绿素的合成,更有利于光合作用;而在锰处理浓度超出植物耐受范围时,叶绿体受到损伤,叶绿素分解速度加快,光合能力减弱。其可能原因是锰既是组成叶绿体的必要元素,又直接参与光合放氧过程,所以低浓度锰处理下叶绿素含量增加,而高浓度锰处理下植物体内锰含量过高,受到毒害,抑制了叶绿体正常结构的合成及相关酶活性,叶绿素含量降低[1]。
此外,本研究还显示,在胁迫第7天时,叶绿素a+b最大含量和叶绿素a/b最大值分别出现在5000 μmol·L-1处理和10000 μmol·L-1处理,胁迫至第30天时,则均出现在1000 μmol·L-1处理。这与燕江伟等[20]对干旱与镉复合胁迫下互叶醉鱼草(Buddlejaalternifolia)幼苗叶绿素含量的研究结果一致。一般认为植物叶绿素a/b的值越大,类囊体堆叠的程度越大,光能利用率越高[21]。随着锰胁迫时间的延长,1000 μmol·L-1锰处理下的黄花草幼苗能保持叶绿素a+b含量和叶绿素a/b值高于对照,这说明该浓度处理能够促进黄花草幼苗叶绿素的合成,维持自身正常的生长发育。
3.3 锰胁迫对黄花草幼苗抗氧化酶活性的影响
一般情况下,植物体内活性氧的产生和消除处于一种动态平衡的状态。而当植物处于逆境中时,植物细胞会产生更多的活性氧自由基,造成膜脂过氧化,降低酶活及细胞渗透调节能力,对植物产生毒害。植物的抗氧化酶系统主要由SOD、POD和CAT协同构成,起着清除活性氧、降低胁迫所造成毒害的重要作用。本研究中,黄花草幼苗叶片中SOD活性在胁迫第7天随锰胁迫浓度的增加而下降,但在整个试验期内属于较高水平;随胁迫时间的延长SOD活性有所下降,20000 μmol·L-1处理下降最显著。这与段才绪等[22]对盐胁迫下决明(Cassiaobtusifolia)的研究结果一致。说明高浓度长时间的锰胁迫会降低SOD活性。在胁迫第7天,黄花草幼苗叶片POD和CAT呈现相同的变化趋势,活性均随锰浓度增加而快速增加,但随胁迫时间延长,高浓度处理下的POD活性会下降,而CAT的活性变化不明显。辛建攀等[23]研究表明随着镉浓度的增加和胁迫时间的延长,梭鱼草(Pontederiacordata)叶片SOD和POD活性下降明显,CAT活性无明显变化。这与本研究结果一致。说明随着锰浓度的增加和胁迫时间的延长,植物体内活性氧的产生已大于清除能力,加剧了植物细胞功能膜及酶系统的损伤。综上,黄花草通过SOD、POD和CAT协同作用缓解氧化损伤,可忍受较高浓度锰胁迫。
3.4 锰胁迫对黄花草幼苗叶片脯氨酸、可溶性蛋白、可溶性糖含量的影响
植物在遭受各种逆境胁迫时,会迅速产生并积累脯氨酸、可溶性蛋白、可溶性糖等渗透调节物质,以保持细胞正常含水率及膨压,对抗外界的不利环境[24]。脯氨酸是植物体内最常见且有效的小分子渗透调节物质;可溶性糖在参与渗透调节的同时可为植物生长和对抗不利环境因素提供能量;可溶性蛋白不仅参与植物体内大部分的代谢活动,还具有较强的亲水性,可缓解因渗透胁迫所造成的细胞失水[7-8]。渗透调节物质含量在一定程度上反映了植物的抗逆性,含量越多表示抗性越强。但当胁迫超过植物的耐受范围时,则会破坏这一机制,渗透调节物质的合成受到阻碍,含量减少[25]。本研究中,黄花草幼苗叶片中脯氨酸、可溶性蛋白和可溶性糖含量在胁迫第7、15天均快速积累增加,至第30天时急剧下降,浓度高的下降更为明显。这与张虎等[26]对钴胁迫下紫花苜蓿(Medicagosativa)的研究结果一致。说明黄花草幼苗通过提高脯氨酸、可溶性蛋白和可溶性糖含量缓解较高浓度锰胁迫带来的毒害,但随着胁迫时间的延长,渗透调节物质含量减少,平衡机制受到破坏,抗逆性降低。
3.5 锰胁迫对黄花草幼苗MDA含量的影响
逆境条件下,植物体内会产生大量活性氧,使细胞膜脂发生过氧化,细胞膜通透性增大。MDA作为细胞膜脂过氧化的产物,其含量高低代表植物遭受毒害的强度和对逆境条件下的反应能力。在本研究中,随着锰浓度的增加,黄花草幼苗叶片MDA呈先降低后升高的变化趋势,但随着处理时间的延长,仅1000 μmol·L-1处理下的MDA含量低于对照组,说明该浓度处理不会对黄花草幼苗产生胁迫作用,与本研究中关于叶绿素含量的结果一致。高浓度锰处理下黄花草幼苗叶片MDA含量会随浓度增加和胁迫时间的延长明显增加,这与汪结明等[27]对4种藤本植物在锰污染土壤中的生理响应研究结果一致。说明高浓度锰胁迫导致黄花草幼苗细胞膜脂过氧化,植株所受毒害程度加大。
4 结论
锰胁迫会降低黄花草种子发芽势、发芽率、发芽指数和活力指数。赤霉素浸种处理可增加黄花草种子发芽势、发芽率、发芽指数和活力指数。随着锰浓度的增加,黄花草幼苗芽长、根长、生物量和根冠比呈现“低促高抑”的现象。黄花草可通过提高SOD、POD和CAT活性及积累脯氨酸、可溶性糖和可溶性蛋白含量来缓解锰胁迫所造成的毒害。同时,本研究发现1000 μmol·L-1锰处理能够促进黄花草的生长,表现为叶绿素含量的增加。但当锰浓度高于15000 μmol·L-1时,黄花草叶片MDA含量急剧增加,且抗氧化酶活性和渗透调节物质含量降低,说明黄花草生长受到抑制,且随胁迫时间延长抑制作用更加明显。
