sFRP-2抑制皮肤恶性黑色素瘤增殖的影响
2019-12-20赵振霞董华君于强陈新蹇露
赵振霞 董华君 于强 陈新 蹇露
(1.山东省聊城市第二人民医院整形外科,山东 聊城 252600;2.湖北医药学院附属太和医院病理科,湖北 十堰 442000)
皮肤黑色素瘤(Cutaneous melanoma,CM)是一种极具侵袭性的癌症,生存率低,死亡率高[1-3]。早期手术切除以及放化疗为主的综合治疗是临床中CM的主要治疗方案,但CM极易发生转移,一旦发生转移患者的预后通常较差;且化疗药物对绝大多数CM患者没有疗效或表现出肿瘤耐药性,这使得治疗无效。近年来分子生物学和肿瘤表观遗传学的深入研究,研究者提出肿瘤的发生与癌基因的激活和抑癌基因的失活密切相关;各种基因的异常表达导致细胞逃避正常机体生理调控功能,出现增殖异常和凋亡失控等现象。因此临床中寻找早期诊断与判断CM预后的靶点具有重要意义。sFRP-2是WNT信号通路的负调控因子,是一种分泌性糖蛋白,作为一个负调控因子参与多种肿瘤细胞生长、细胞免疫、干细胞分化等[4-5]。已有文献报道在包括头颈部肿瘤、前列腺癌等肿瘤中具有重要的抑癌作用[6-7]。但对其参与CM的研究的甚少。本研究旨在评估sFRP-2对CM侵袭和转移的功能和分子机制进行初步探讨。
1 材料与方法
1.1试剂、材料仪器 胎牛血清和RAPI-1640培养液购自美国Gibico公司;RNA提取试剂盒和逆转录试剂盒购自日本TaKaRa 公司;Trans5α 感受态细胞、293T 细胞购自天根生化科技有限公司; Lipofectamine 3 000脂质体转染试剂盒购自美国Invitrogen 公司;慢病毒质粒载体pLVX-IRES-ZsGreen1 购自美国ProliantProliant公司;质粒载体sFRP-2、质粒载体包装质粒购自上海碧云天实验公司; CCK-8 试剂盒购自日本同仁化学实验公司。实验用一抗、二抗均购自美国Abcam 公司。sFRP-2 基因引物由广州复能基因公司设计并合成。
1.2细胞系和临床组织样本 黑色素瘤细胞系(HM、A375、WM451和SK-MEL-1)购自上海生科院细胞库;对2005年1月至2018年12月于本院收治并由两名以上病理科高年资医师确诊的并收治的共80例CM患者的临床病例样本。在这些患者中男49例以及女31名。年龄范围在29~76岁之间,中位年龄49.7岁。所有病人临床分期依据第8版AJCC版TNM分期,其中Ⅰ期13例、Ⅱ期22例、Ⅲ期28例及Ⅳ期17例。在2005~2018年的持续随访过程中共死亡56例,存活24例。本研究得到了我医院的伦理委员会的批准,组织标本诊断由我院病理科高年制医师诊断。
1.3实验方法
1.3.1细胞和组织RNA和蛋白提取 CM细胞和组织的RNA和蛋白以及上述临床样本中RNA和蛋白提取步骤同已有的文献报道[8-9]。提取后RNA在Landdrop仪器中测得浓度,通过RNA逆转录试剂盒将RNA逆转为cDNA,实验方法及步骤参考样品实验说明书及已有的参考文献[10]。将逆转录后的cDNA放于-20 ℃冰箱中保存。
1.3.2sFRP-2过表达载体构建和细胞感染 慢病毒感染方法和步骤同参考文献[11-12]。取细胞状态良好,处于对数生长期的293T细胞接种于10 cm细胞培养皿,37 ℃,5% CO2培养箱内培养;参照Lipofectamine 3 000使用说明,将包装质粒共转染293T细胞,转染后8h更换为完全培养基,继续培养48 h后;收集富含慢病毒颗粒的细胞上清液,进行细胞感染。慢病毒感染方法:取活性状态下A375细胞,将慢病毒上清液置于A375细胞中共培养约6~8 h,更换完全培养基后继续培养48 h,进行细胞功能实验。
1.3.3免疫组化实验 免疫组化方法和步骤同参考文献[13],主要包括了:组织切片脱蜡(3 μm,60 ℃,2 h)、脱缸(10 min/次)、抗原修复[热诱导抗原表位修复、柠檬酸盐缓冲液(pH=6),30 min]、H2O2室温下封闭(室温下2h)、孵一抗(4 ℃冻库,12 h)和二抗(37 ℃,2 h)、DAB显色(室温下5 min)、染核(苏木紫及伊红复染,室温下5 min)、封片镜检等。在倒置显微镜下随机5个视野,计算相对光密度。选用已知阳性切片作阳性对照,PBS代替一抗作阴性对照。根据病理评分标准:独立评估阳性肿瘤细胞的相对数量(范围:0%~100%)和染色强度(范围:0~3分:0分=无染色,1分=弱染色,2分=中度染色,3分=强染色)。
1.3.4qRT-PCR检测sFRP-2在组织表达 qRT-PCR的步骤同试剂盒使用说明书和文献所述[14-15]。sFRP-2-F:5’-CGTCAGAAGAAGCTGCTGCTCC-3’,sFRP-4-R:5’-TAATGGTCTCCACAGCACTCATA-3’。使用HT7500生物系统以及SYBRGreen的试剂盒。通过实时监测PCR扩增,选择β-actin为内参基因,每个样品做三个重复;用2-△△Ct法对样本基因进行表达差异相对定量分析,在扩增的指数期对起始模板进行定量,扩增指数越高,相对表达越高。
1.3.5细胞增殖实验 对照组和实验组的细胞处理同前,取对数生长期的细胞进行消化,按每孔3 000 个细胞接种96孔板,完全培养基过夜培养。待细胞完全贴壁后,实验前3 h在各孔中分别加入20 μL CCK-8试剂,培养0、24、48和72 h时分别检测细胞增殖活性,通过酶联免疫检测仪在波长480 nm 处检测各孔的D值,根据D480 nm值绘制细胞生长曲线。
1.3.6软琼脂平板克隆实验 软琼脂平板克隆实验方法和步骤同参考文献[15]。取对数生长期实验组和对照组细胞,消化、离心、计数;将细胞稀释成1×103细胞/mL备用。蒸馏水分别制备出1.3%和0.8%两个浓度的低溶点琼脂糖液。分别使用1∶1比例将琼脂糖液与1 640完全培养液混合后,平铺于平皿中自然冷却凝固形成双侧琼脂层。待上层琼脂凝固后,置于细胞孵育箱中继续培养约两周;观察克隆形态并计数。以上实验组和对照组各重复三次。
1.3.7免疫蛋白印迹实验 蛋白质印迹法检测 A375在细胞系中的相对表达:收集实验组和对照组,提取细胞蛋白后测定蛋白浓度[16]。取50 μg/孔细胞蛋白进行凝胶电泳,常温下将电泳分离后的蛋白转膜于PVDF膜上,5%脱脂牛奶的TBST室温下封闭2 h,加入一抗及内参GAPDH(美国Abcam公司),4 ℃冻库封闭过夜。24 h后常温下复温约30 min,TBST液洗膜后,二抗封闭液室温下摇床孵育2 h,显色剂(DAB)显色、成像仪曝光,并用Quantity One软件分析蛋白灰度值,以目的蛋白条带灰度值与内参GAPDH之比来表示相对表达差异。

2 结 果
2.1sFRP-2 mRNA在黑色素瘤细胞系和组织中的表达 qRT-PCR实验发现,与正常色素痣相比,sFRP-2 mRNA在黑色素瘤细胞系中表达下调(图1A,P<0.001),差异具有统计学意义。同时qRT-PCR发现,与癌旁组织相比,sFRP-2 mRNA在黑色素瘤组织中表达下调,差异有统计学意义(图1B,P<0.001),差异具有统计学意义。

(A)qRT-PCR显示:与色素痣相比,sFRP-2 mRNA在黑色素瘤细胞中表达下调;***P<0.001.(B)qRT-PCR显示:与癌旁组织相比,sFRP-2 mRNA在黑色素瘤组织中低表达,P<0.001。
图1sFRP-2 mRNA 的表达
2.2sFRP-2 蛋白在黑色素瘤组织中的表达 通过免疫组织化学分析80例黑色素瘤组织和色素痣的蛋白相对表达;结果显示:与色素痣相比,sFRP-2 蛋白在黑色素瘤组织中表达下调(图2A),差异具有统计学意义。通过IPP 6.0软件分析 sFRP-2 蛋白表达光密度显示,与色素痣组织相比(0.324±0.012),sFRP-2 在黑色素瘤中光密度降低(0.123±0.034)(图2B,t=15.34,P<0.01)。

(A)与正常色素痣相比,sFRP-2 蛋白在黑色素瘤中表达下调;(B)光密度分析:sFRP-2 蛋白在黑色素瘤中表达下调,P<0.01。
图2sFRP-2 蛋白在黑色素瘤中的表达
2.3sFRP-2蛋白表达与患者临床特征的关系 sFRP-2 的表达与不同性别、不同年龄的基线特征无明显统计学意义(P>0.05);随着病理分级增加,sFRP-2 蛋白在黑色素瘤组织中阳性率逐步降低,差异有统计学意义(P=0.034)。见表1。

表1 临床特征与 sFRP-2 蛋白表达的关系
2.4sFRP-2表达对患者生存时间的影响 sFRP-2 高表达患者中位生存时间为 56.12 个月,其三年存活率为56.78%; sFRP-2 低表达患者中位生存时间为 26.62 个月,其三年存活率为22.19%。Log-Rank 检验结果提示 sFRP-2 高表达患者与 sFRP-2 低表达患者生存时间的差异有统计学意义(P<0.05)。见图3。

图3 sFRP-2 蛋白的表达情况与K-M 生存曲线
2.5sFRP-2 基因过表达对黑色素瘤细胞增殖的影响 我们对黑色素瘤细胞 A375 进行 sFRP-2 基因过表达,免疫蛋白印迹实验验证了sFRP-2的过表达(图4A)。CCK-8实验结果显示,实验组 A375 细胞感染sFRP-2后细胞存活率显著下降(图4B,P<0.01);克隆形成实验结果显示,实验组 A375 细胞克隆形成的效率显著下降(图4C,P<0.001)。

(A)免疫蛋白印迹实验验证sFRP-2在A375中的过表达;(B)CCK-8实验sFRP-2抑制细胞活性,P<0.01;(C)软琼脂平板克隆显示sFRP-2 在抑制细胞克隆的形成,***P<0.001。
图4sFRP-2表达对黑色素瘤细胞A375增殖的影响
2.6过表达sFRP-2对 Wnt/β-catenin 信号通路的影响 通过免疫蛋白质印迹检测过表达 sFRP-2 后对active-β-catenin及下游靶基因的影响,结果显示:过表达 sFRP-2 后,active-β-catenin及下游靶基因c-Myc、cyclinD1的表达明显受到抑制;同时细胞周期相关蛋白p21 和 p27等表达上调(图5A,5B,P<0.001)。
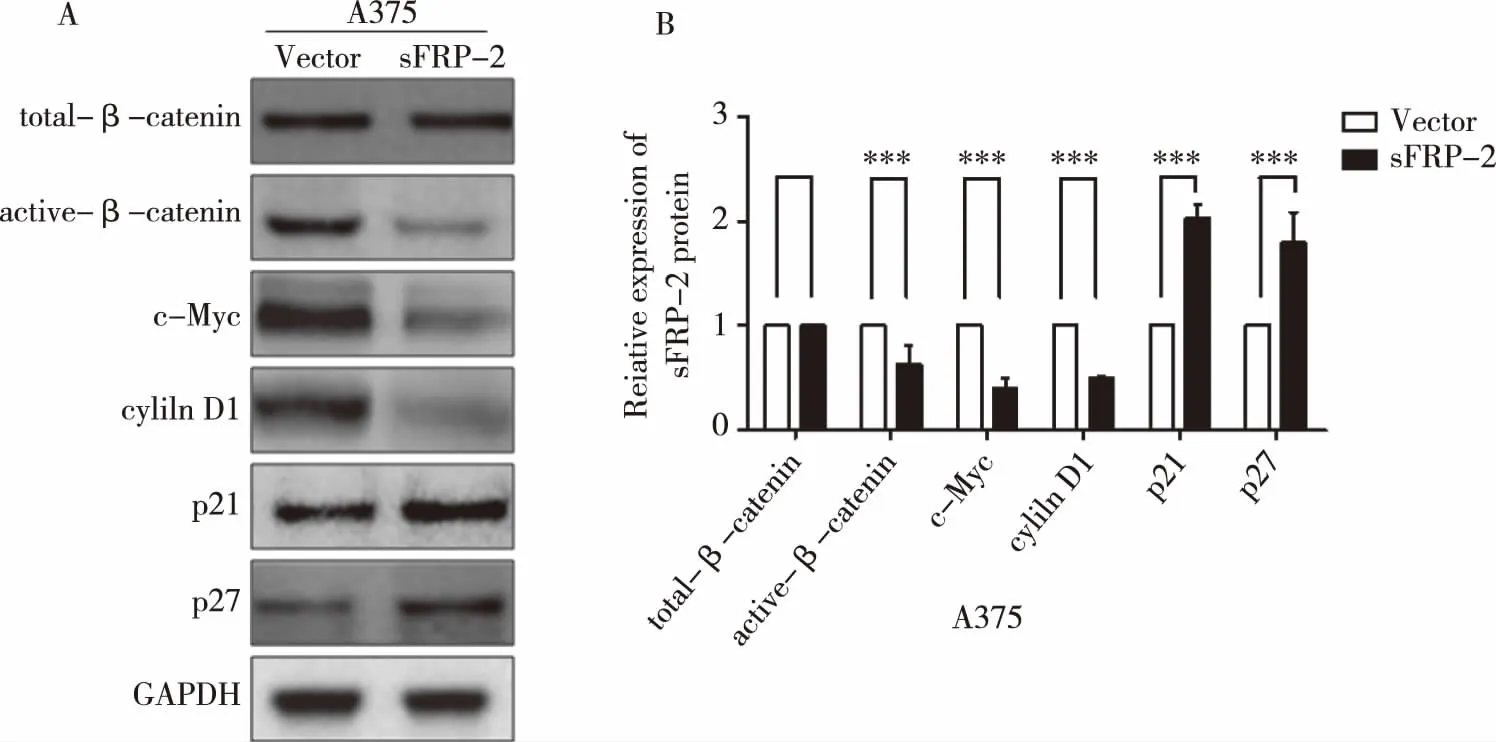
(A)免疫蛋白印迹实验分析过表达sFRP-2对Wnt/β-catenin信号通路的影响;(B)灰度定量分析过表达sFRP-2对Wnt/β-catenin信号通路相关靶点的影响,两组比较,***P<0.001。
图5sFRP-2 过表达后对Wnt/β-catenin信号通路的影响
3 讨 论
黑色素瘤的发病率在皮肤肿瘤中仅次于鳞状细胞癌和基底细胞癌,是最常见的三种皮肤癌的类型之一。其具有高度转移潜能,能在淋巴结、肝、肺和脑等部位发生转移;是目前死亡率最高的皮肤肿瘤。尽管发病率不高,但世界范围内患有黑色素瘤的人数不断增加,且黑色素瘤患者的预后仍不理想,平均生存期不到6个月。针对黑色素瘤的治疗方法取得了巨大的发展:包括达巴芬尼、维穆拉芬尼和曲美替尼等激酶抑制剂用于BRAF V600E突变患者,单克隆抗体,PD-1的免疫治疗等[17]。但黑色素瘤患者的预后和生存率仍然不佳。因此,迫切需要寻找早期预测黑色素瘤发生发展和预后的治疗靶点。
Wnt 信号调节因子 sFRPs 因其在肿瘤中的作用而备受关注。作为sFRPs家族成员之一,sFRP-2作为一种抑制基因在多种肿瘤的发生发展中起着重要的作用。文献报道[18], sFRP-4在头颈部/口腔鳞状细胞癌中表达上调;高表达的sFRP-4在头颈部/口腔鳞状细胞癌容易发生远处转移且预后较差。sFRP-5在黑色素瘤中低表达,sFRP-5 的表达可能在黑色素瘤的侵袭和转移中发挥潜在的作用,并作为人类黑色素瘤治疗的一个有希望的靶点[18]。但 sFRP-2表达对黑色素瘤的影响尚未见报道和研究。
本研究首先通过qRT-PCR 和免疫组化法分别检测了 sFRP-2 在黑色素瘤细胞系和组织中相对表达,结果显示:sFRP-2 在黑色素瘤细胞和组织中的表达下调,并可能在黑色素瘤进展中发挥关键作用。因此,我们采用慢病毒转移来过表达 sFRP-2,通过CCK-8和软琼脂平板克隆实验验证 sFRP-2对黑色素瘤细胞的直接生物学效应。结果表明,sFRP-2 的过度表达能明显抑制细胞增殖和细胞活性。同时,对 sFRP-2 表达的临床病理特征进行了进一步分析,结果发现:在排除了性别、年龄与 sFRP-2 表达可能存在的相关性的情况下,sFRP-2 表达可能与黑色素瘤的生存有密切的关联。有研究认为在一些肿瘤中 sFRP-2 高表达能增加患者的生存期,本本研究得到了相似的结论。文献研究显示,sFRPs 家族对多种肿瘤的Wnt信号都有拮抗作用,我们通过 Western blot 分析检测了 A375 细胞中 Wnt 信号通路的蛋白表达水平,以探讨 sFRP-2 抑制黑色素瘤细胞增殖的分子机制。结果显示sFRP-2 的过表达下调了 Wnt/β-catenin 及相关通路中关键因子的蛋白表达,表明 sFRP-2 抑制了典型 Wnt 信号。
综述,本课题研究显示 sFRP-2 基因在黑色素瘤组织中表达下调,过表达 sFRP-2 基因后能通过抑制Wnt/β-catenin来调控黑色素瘤的进展;可能作为重要的肿瘤性基因参与黑色素瘤的发生发展。
