青藏高原不同海拔梯度黄花棘豆内生真菌多样性研究
2019-12-20姜哲浩张德罡陈建纲柳小妮
姜哲浩, 周 恒, 张德罡, 陈建纲, 柳小妮
(甘肃农业大学草业学院,草业生态系统教育部重点实验室, 甘肃省草业工程实验室, 中-美草地畜牧业可持续研究中心,甘肃 兰州 730070)
黄花棘豆(Oxytropisochrocephala)是草场危害最严重的毒草之一[1],动物长期或过量采食会发生以神经系统机能紊乱为特征的慢性中毒病,严重时会致死[2]。苦马豆素(Swainonine,SW)是黄花棘豆的主要毒性成分[3,4],但SW在医学上具有抗肿瘤活性[5,6]、免疫调节[7,8]、抗病毒[9]、抗菌[10]等药理作用。目前主要通过生物合成、提取及人工合成的方法获得,但这些途径成本较高[11]。
真菌在微生物中具有种类多、酶系丰富、次生代谢产物多、培养条件较简单等特点,常作为发酵中药的主要功能菌。此外,植物中内生真菌可参与合成和宿主植物相同或相似的活性成分[12]。近年研究结果表明,疯草(Locoweed)中普遍存在能产生SW的内生真菌,且内生真菌的数量越多,SW的产量越高[13]。20世纪末,Braun[14]从3种美国疯草中均分离到一类能产生SW的内生真菌,该类真菌生长特性和形态结构相近,根据真菌内部转录间隔区(Internal transcribed space,ITS)序列信息,将其初步划分为链格孢属(Alternaria)真菌;2006 年,Wang等[15]从我国青海的甘肃棘豆(Oxytropiskansuensis)中分离出棘豆埃里砖格孢属内生真菌(Embellisiaoxytropis),其形态与Embellisiasp.极为相似,现名为Undifiliumoxytropis。余永涛[16]分别在小花棘豆(Oxytropisglabra)、冰川棘豆(Oxytropisglacialis)、毛瓣棘豆(Oxytropissericopetala)、黄花棘豆和甘肃棘豆等疯草中分离出菌丝中含有苦马豆素的埃里砖格孢属内生真菌,并且将分离自甘肃棘豆的 1株生成苦马豆素的内生真菌确定为Embellisiasp.。钱亚光等[17]检测到小花棘豆植株的苦马豆素含量低于其内生真菌苦马豆素含量。马尧等[18]从急弯棘豆(Oxytropisdeflexa)和甘肃棘豆的种子、叶、茎及根中分离到的镰孢菌属三线镰刀菌(Fusariumtricinctum)也检测到含有苦马豆素。在小花棘豆中,卢围等[19]还分离出2株产苦马豆素的层出镰刀菌(Fusariumproliferatum)。
野外采集黄花棘豆进行分离以及室内组织培养法获得的试验结果不能对植物内生真菌的群落组成进行真实的反映,本试验拟对黄花棘豆内生真菌的多样性进行研究,基于IonS5TMXL测序平台的测序技术,选择黄花棘豆大量生长的不同海拔梯度,对黄花棘豆未检测到的以及痕量内生真菌的种类进行高通量测序分析,从而更全面地探析黄花棘豆内生真菌的多样性,为抑制或高产苦马豆素提供新的途径。
1 材料与方法
1.1 研究区概况
研究区位于青海省南部(31°39′~36°19′ N,89°45′~102°23′ E),海拔2 500~4 800 m,属高原大陆性气候,年日照时数2 550~2 760 h,年均温—5.6~—3.8℃,年平均降水251~565 mm,6—9月降水量占全年降水量的75%,冷季漫长,无明显暖季。草地类型为高寒草原,草层高度25~70 cm,草层盖度56%~95%,土壤类型为高山草原土[20],土壤质地为砂土[21],采样地为冬季牧场,采样时样地处于休牧时期,样地详情见表1。
1.2 样品采集
2018年8月在研究区进行植被和土壤样品采集,在海拔2 500~4 500 m范围以约500 m高差为间隔分别选取5个样地(表1)。每个样地设置3个200 m×200 m的采样区,选择30株长势良好的黄花棘豆,生长时期为盛花期,采集根、茎、叶和花,共计150株,草地上黄花棘豆的密度为7~10 株·m-2。黄花棘豆表面消毒程序为:首先,用体积分数为70%的乙醇浸泡30 s,再用有效氯含量为1%的次氯酸钠溶液浸泡3 min,然后用灭菌的去离子水清洗3次,每次1 min,最后使用50 mL灭菌离心管,放入液氮保存;其余部分,带回实验室,阴干后粉碎备用。去除土层上的枯落物后,使用土钻采集0~20 cm土层的样品,每个海拔梯度5次重复。样品经过混合密封后带回实验室,去除土壤动物和植物残体,一份土样测定土壤含水量,另一份自然风干后磨碎,过孔径0.15 mm和2 mm筛用于指标测定。同时,采用环刀法[22](100 cm3)取样,测定土壤容重(Soil bulk density,SBD)。
1.3 植物营养成分测定
粗蛋白(Crude protein,CP):凯氏定氮法[23]测定;粗纤维(Crude fiber,CF):范式洗涤法[24]测定;粗脂肪(Ether extract,EE):索氏抽提法[25]测定;粗灰分(Crude ash,ASH):干灰法[26]测定;无氮浸出物(Nitrogen-free extract,NFE):NFE%=100%-(CP%+EE%+ASH%+CF%)。
1.4 土壤理化指标
土壤理化指标及测定方法[27]为:土壤含水量(Soil water content,SWC):105℃烘干法测定;土壤pH值:电位法(水土比为2.5∶1)测定;土壤有机碳(Soil organic carbon,SOC):重铬酸钾氧化-外加热法测定;土壤全氮(Total nitrogen,TN):凯氏定氮法测定;土壤全磷(Total phosphorus,TP):酸熔-钼锑抗比色法测定;土壤全钾(Total potassium,TK):火焰光度计法测定。
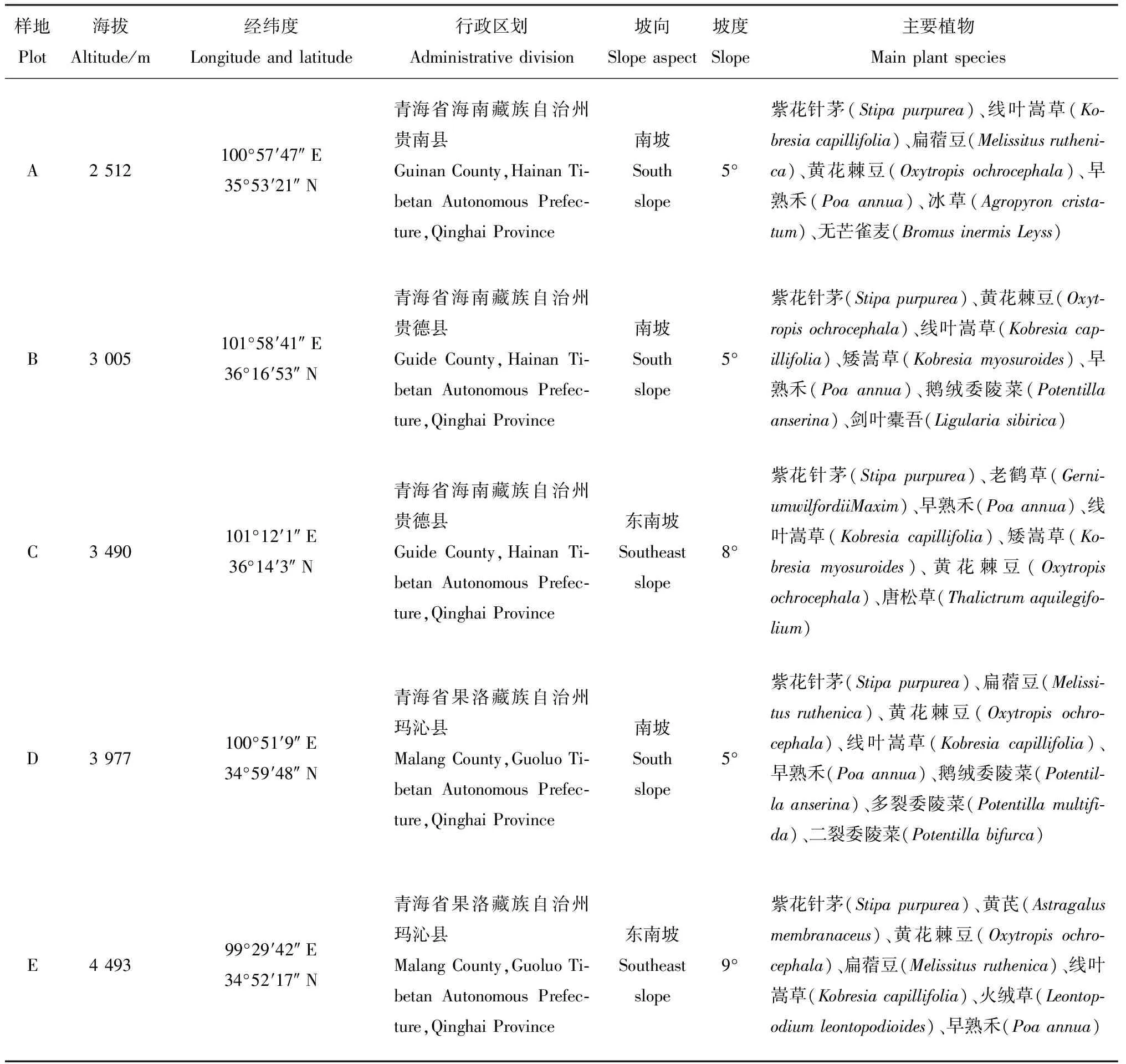
表1 样地基本信息Table 1 Basic information of the sample plots
1.5 DNA提取及PCR扩增
用真菌DNA提取试剂盒提取植物总基因组DNA,方法参见试剂盒说明书,每个样品3个重复并进行混合以降低在DNA提取过程中试验操作产生的误差。采用ITS5-1737F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS2-2043R(5′-GCTGCGTTCTTCATCGATGC-3′)进行PCR扩增。PCR扩增体系为:2×Taq PCR MaterMix12.5 μL,上下游引物各1 μL,DNA模板1 μL (对照加1 μL双蒸水),最后用双蒸水补足至25 μL。PCR扩增程序:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环;72℃延伸5 min[28]。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后,送至天津诺禾致源生物信息科技有限公司测序,每个植物样品3个生物学重复。
1.6 测序数据的处理
使用Cutadapt[29]先对reads进行低质量部分剪切,再根据Barcode从得到的reads中拆分出各样品数据,截去Barcode和引物序列初步质控得到原始数据(Raw reads) 经过以上处理后得到的Reads需要进行去除嵌合体序列的处理,Reads序列通过与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到最终的有效数据(Clean Reads)。利用Uparse软件[30]对所有样品的全部Clean Reads进行聚类,默认以97%的一致性将序列聚类成为OTUs(Operational Taxonomic Units),同时选取OTUs的代表性序列,依据其算法原则,筛选的是OTUs中出现频数最高的序列作为OTUs的代表序列。再对OTUs序列进行物种注释,用Qiime软件中的blast方法与Unit数据库进行物种注释分析。对各样本的数据进行均一化处理,以样本中数据量最少的作为标准进行均一化处理。
1.7 统计分析
采用SigmaPlot 14.0作图,SPSS 21.0软件对数据进行One-Way ANOVA统计分析和Duncan极差法进行差异显著性检验。使用Qiime软件(Version 1.9.1)计算Chao1指数和Shannon指数,使用R软件(Version 2.15.3)绘制稀释曲线和非度量多维尺度分析(Non-metric multidimensional scaling analysis,NMDS),以门分类水平进行加权Unifrac距离矩阵做UPGMA(Unweighted Pair-group Method with Arithmetic Mean)聚类分析,以及曼特尔(Mantel test)分析。采用Canoco 5.0软件对真菌类群及丰度进行除趋势对应分析(Detrended correspondence analysis,DCA),对不同物种进行分组和排序,计算其第一排序轴的梯度范围,根据梯度范围数值,采用冗余分析(Redundancy analysis,RDA)对真菌群落与植物营养和土壤环境因子间的相互关系进行分析。数据为平均值±标准误。
2 结果与分析
2.1 黄花棘豆营养成分及土壤理化性质
不同海拔梯度黄花棘豆营养成分差异显著(P<0.05)。如表2所示,随着海拔高度的增加,CP、CF和EE均呈现先升高后降低趋势,ASH和NFE均呈现先降低后升高趋势。
在不同海拔梯度草地土壤中,各样地理化性质间均差异显著(P<0.05)。如表3所示,随着海拔梯度的升高,TP和TK含量逐渐升高,SWC、SBD、SOC和TN均呈先升高后降低趋势,pH呈先降低后升高趋势。
注:同列不同小写字母表示不同海拔梯度之间差异显著性(P<0.05),下同
Note:Different lowercase letters in the same column indicate significant differences between different altitudinal gradients at the 0.05 level,the same as below

表3 各采样点土壤基本理化性质Table 3 Basic soil physical and chemical properties in different sampling sites
2.2 真菌群落丰度及多样性差异
Chao1指数可估算样品中所含OTU数目,数值越大样本中所含物种越多;Shannon指数可评估样本中物种组成的丰富度和均匀度。数值越大表示该环境的物种越丰富,各物种分配越均匀。本研究通过高通量测序共得到有效序列3 615 854条(表4),质控过滤后得到3 607 129条优质序列,片段长度245~292 bp,在97%的相似水平下对序列进行OTUs聚类,共产生750个OTUs(图1)。质控有效率达99.76%,OTUs的稀释曲线均趋于平缓,说明所测数据能够准确反映植物真菌群落信息(图2)。从表4可以看出Chao1指数为E>B>D>C>A;Shannon指数为B>C>E>A>D。从图1可以看出,5个海拔梯度植物样品所共有的OTUs为159个,其中A,B,C,D,E中所特有的OTUs数目分别为42,27,23,27和41个。
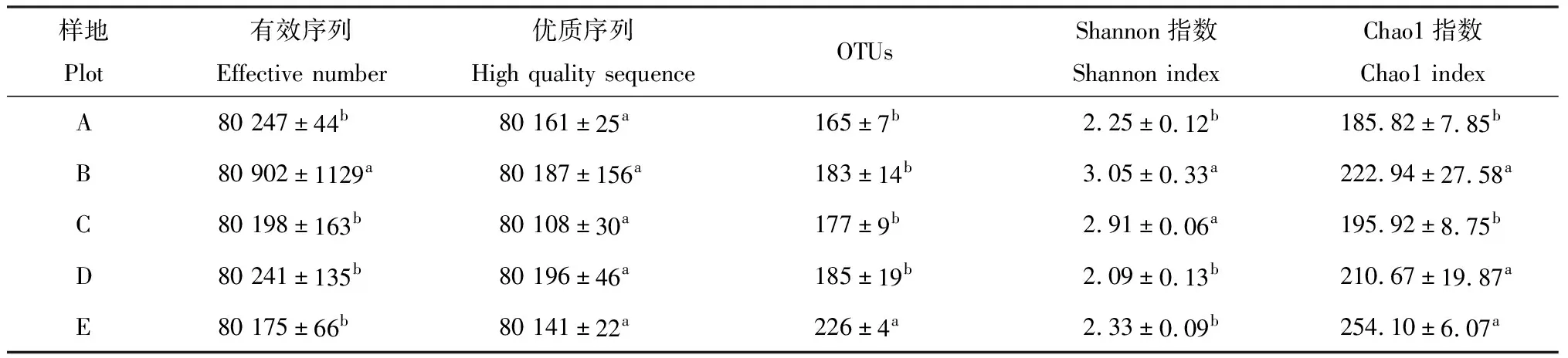
表4 样品序列数统计、丰富度与多样性指数Table 4 Sample sequence statistics,richness and diversity indices
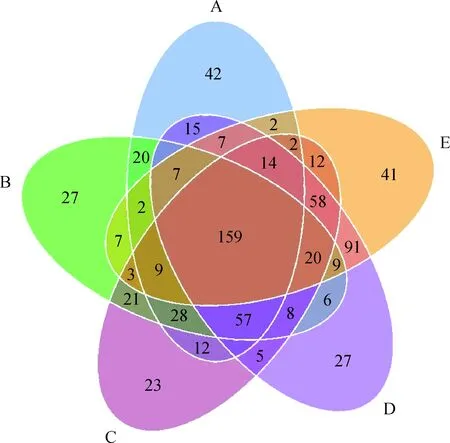
图1 样品韦恩图Fig.1 Venn diagrams of samples

图2 样品稀释曲线Fig.2 Rarefaction curves for samples
2.3 内生真菌群落分布特征
从门的分类水平看,相对丰度>0.001%的门在A梯度为子囊菌门(Ascomycota,0.657%)、担子菌门(Basidiomycota,0.466%)、被孢霉门(Mortierellomycota,0.010%)和毛霉门(Mucoromycota,0.001%);B梯度为子囊菌门(Ascomycota,1.671%)、担子菌门(Basidiomycota,2.175%)和被孢霉门(Mortierellomycota,0.006%);C梯度为子囊菌门(Ascomycota,1.282%)、担子菌门(Basidiomycota,0.171%)、被孢霉门(Mortierellomycota,0.019%)、球囊菌门(Glomeromycota,0.001%)、芽枝霉门(Blastocladiomycota,0.001%)和虫霉门(Entomophthoromycota,0.001%);D梯度为子囊菌门(Ascomycota,1.618%)、担子菌门(Basidiomycota,0.242%)、被孢霉门(Mortierellomycota,0.109%)和球囊菌门(Glomeromycota,0.004%);E梯度为子囊菌门(Ascomycota,0.830%)、担子菌门(Basidiomycota,0.187%)、被孢霉门(Mortierellomycota,0.294%)、球囊菌门(Glomeromycota,0.010%)、油壶菌门(Olpidiomycota,0.002%)和壶菌门(Chytridiomycota,0.001%)。主要优势类群为子囊菌门和担子菌门。
从纲的分类水平看,相对丰度>0.01%的纲在A梯度为锤舌菌纲(Leotiomycetes,0.028%)、银耳纲(Tremellomycetes,0.392%)、座囊菌纲(Dothideomycetes,0.529%)、被孢霉纲(Mortierellomycetes,0.010%)、散囊菌纲(Eurotiomycetes,0.010%)、子囊菌纲(Sordariomycetes,0.020%)和伞菌纲(Agaricomycetes,0.012%);B梯度为锤舌菌纲(Leotiomycetes,0.031%)、银耳纲(Tremellomycetes,1.669%)、座囊菌纲(Dothideomycetes,1.344%)、被孢霉纲(Mortierellomycetes,0.010%)、子囊菌纲(Sordariomycetes,0.024%)、伞菌纲(Agaricomycetes,0.010%)和外囊菌纲(Taphrinomycetes,0.010%);C梯度为锤舌菌纲(Leotiomycetes,0.012%)、银耳纲(Tremellomycetes,0.117%)、座囊菌纲(Dothideomycetes,0.683%)、被孢霉纲(Mortierellomycetes,0.019%)、散囊菌纲(Eurotiomycetes,0.044%)、子囊菌纲(Sordariomycetes,0.028%)、伞菌纲(Agaricomycetes,0.021%)、外囊菌纲(Taphrinomycetes,0.010%)和微球黑粉菌纲(Microbotryomycetes,0.010%);D梯度为锤舌菌纲(Leotiomycetes,1.044%)、银耳纲(Tremellomycetes,0.141%)、座囊菌纲(Dothideomycetes,0.384%)、被孢霉纲(Mortierellomycetes,0.107%)、散囊菌纲(Eurotiomycetes,0.010%)、原囊霉纲(Archaeorhizomycetes,0.043%)、子囊菌纲(Sordariomycetes,0.051%)和伞菌纲(Agaricomycetes,0.037%);E梯度为锤舌菌纲(Leotiomycetes,0.068%)、银耳纲(Tremellomycetes,0.061%)、座囊菌纲(Dothideomycetes,0.448%)、被孢霉纲(Mortierellomycetes,0.290%)、散囊菌纲(Eurotiomycetes,0.015%)、原囊霉纲(Archaeorhizomycetes,0.119%)、子囊菌纲(Sordariomycetes,0.060%)和伞菌纲(Agaricomycetes,0.083%)。锤舌菌纲随海拔升高呈先下降后上升趋势,银耳纲、座囊菌纲、被孢霉纲、散囊菌纲和外囊菌纲则是先上升后下降,子囊菌纲和伞菌纲随海拔升高呈上升趋势,原囊霉纲仅在海拔D、E梯度出现,微球黑粉菌纲仅在C梯度出现。
从属的分类水平看,相对丰度>0.01%的属在A梯度为葡萄孢属(Botrytis,0.010%)、菌属(Filobasidium,0.214%)、亚隔孢壳属(Didymella,0.158%)、Boeremia(0.034%)、枝孢属(Cladosporium,0.054%)、Vishniacozyma(0.089%)、链格孢属(Alternaria,0.064%)、附球菌属(Epicoccum,0.030%)和被孢霉属(Mortierella,0.010%);B梯度为葡萄孢属(Botrytis,0.010%)、菌属(Filobasidium,1.141%)、亚隔孢壳属(Didymella,0.487%)、Boeremia(0.216%)、枝孢属(Cladosporium,0.354%)、Vishniacozyma(0.367%)、链格孢属(Alternaria,0.010%)和附球菌属(Epicoccum,0.092%);C梯度为菌属(Filobasidium,0.028%)、亚隔孢壳属(Didymella,0.117%)、Boeremia(0.208%)、枝孢属(Cladosporium,0.028%)、Vishniacozyma(0.038%)、链格孢属(Alternaria,0.139%)、拟球藻属(Sphaerellopsis,0.065%)、附球菌属(Epicoccum,0.012%)和被孢霉属(Mortierella,0.015%);D梯度为葡萄孢属(Botrytis,0.987%)、菌属(Filobasidium,0.010%)、亚隔孢壳属(Didymella,0.102%)、Boeremia(0.010%)、枝孢属(Cladosporium,0.018%)、Vishniacozyma(0.024%)、链格孢属(Alternaria,0.096%)、附球菌属(Epicoccum,0.010%)和被孢霉属(Mortierella,0.094%);E梯度为葡萄孢属(Botrytis,0.014%)、亚隔孢壳属(Didymella,0.010%)、Boeremia(0.010%)、链格孢属(Alternaria,0.134%)、附球菌属(Epicoccum,0.015%)和被孢霉属(Mortierella,0.262%)。除被孢霉属呈上升趋势外,其余各属均随海拔升高呈先上升后下降趋势,拟球藻属仅在C梯度出现,而葡萄孢属仅在C梯度未出现。


图3 真菌群落相对丰度Fig.3 Relative abundance of fungus community注:(a):门分类水平;(b):纲分类水平;(c):属分类水平;As:子囊菌门;Ba:担子菌门;Mo:被孢霉门;Gl:球囊菌门;Bl:芽枝霉门;En:虫霉门;Ch:壶菌门;Ro:隐真菌门;Ol:油壶菌门;Mu:毛霉门;Le:舌菌纲;Tr:银耳纲;Do:座囊菌纲;Mo:被孢霉纲;Eu:散囊菌纲;Ar:原囊霉纲;So:子囊菌纲;Ag:伞菌纲;Ta:外囊菌纲;Mi:微球黑粉菌纲;Bo:葡萄孢属;Fi:菌属;Di:亚隔孢壳属;Boe:Boeremia;Cl:枝孢属;Vi:Vishniacozyma;Al:链格孢属;Sp:拟球藻属;Ep:附球菌属;Mo:被孢霉属;Ot:其他;下同Note:(a):Phyla level;(b):Class level;(c):Genus level;As:Ascomycota;Ba:Basidiomycota;Mo:Mortierellomycota;Gl:Glomeromycota;Bl:Blastocladiomycota;En:Entomophthoromycota;Ch:Chytridiomycota;Ro:Rozellomycota;Ol:Olpidiomycota;Mu:Mucoromycota;Le:Leotiomycetes;Tr:Tremellomycetes;Do:Dothideomycetes;Mo:Mortierellomycetes;Eu:Eurotiomycetes;Ar:Archaeorhizomycetes;So:Sordariomycetes;Ag:Agaricomycetes;Ta:Taphrinomycetes;Mi:Microbotryomycetes;Bo:Botrytis;Fi:Filobasidium;Di:Didymella;Boe:Boeremia;Cl:Cladosporium;Vi:Vishniacozyma;Al:Alternaria;Sp:Sphaerellopsis;Ep:Epicoccum;Mo:Mortierella;Ot:Other;the same as below
2.4 Beta多样性
对5个不同海拔梯度黄花棘豆选用加权Unifrac距离来衡量2个梯度间的差异系数,相异系数越小,2个海拔梯度间物种多样性的差异越小。如图4所示,各梯度加权Unifrac差异系数为AB(0.321),AC(0.107),AD(0.122),AE(0.133),BC(0.252),BD(0.273),BE(0.281),CD(0.040),CE(0.047),DE(0.028)。通过对各样品进行UPGMA聚类分析(图5)发现,D,E梯度间内生真菌组成及丰度相似性较高,B梯度内生真菌组成及丰度与其他梯度差异较大。

图4 各样地间OTUs的heatmap分析Fig.4 Heatmap analysis between OTUs of plots
对不同海拔梯度黄花棘豆内生真菌群落进行NMDS分析,结果如图6所示。同一梯度样品基本聚集,不同梯度样品彼此分离,表明不同海拔梯度黄花棘豆内生真菌群落结构组间差异显著。此外,相较于B,C,D梯度,A梯度与E梯度样品群落结构距离更远,表明随海拔的增加,内生真菌群落结构差异增大。

图5 门水平上物种组成的UPGMA聚类树图Fig.5 UPMGA clustering tree diagram of species composition at phyla level

图6 各样地间NMDS分析Fig.6 NMDS analysis of plots
2.5 真菌优势类群与植物营养成分和土壤环境因子间RDA分析
基于CANOCO 5.0软件分析,将真菌类群及丰度进行物种间的DCA,对不同物种进行分组和排序,计算其第一排序轴的梯度范围为1.1,说明真菌优势类群与植物营养成分和土壤环境因子之间适合RDA分析。通过RDA分析并结合Pearson相关系数分析,初步说明真菌优势类群与植物营养成分和土壤环境因子间的相互关系(图7,表5)。RDA分析表明:第一、二排序轴特征值分别为0.5976和0.3289,第一、二排序轴累计解释率分别为59.76%和92.65%,具有生物统计学意义。其中优势类群子囊菌门与NFE呈显著负相关(相关系数为—0.616);担子菌门与TN、TP呈显著负相关(相关系数分别为—0.537,—0.558);被孢霉门和壶菌门与ASH呈极显著正相关(相关系数为0.882,0.754);球囊菌门和油壶菌门与海拔呈极显著正相关(相关系数分别为0.812,0.661);虫霉门与SOC呈极显著正相关(相关系数为0.668);毛霉门和隐真菌门与植物营养和土壤环境因子无显著相关性。

图7 真菌优势类群与植物营养成分和土壤环境因子之间的冗余分析Fig.7 Redundancy analysis of dominant fungal groups,plant nutrients and soil environmental factors注:As:子囊菌门;Ba:担子菌门;Mo:被孢霉门;Gl:球囊菌门;Bl:芽枝霉门;En:虫霉门;Ch:壶菌门;Ro:隐真菌门;Ol:油壶菌门;Mu:毛霉门;CP:粗蛋白;CF:粗纤维;EE:粗脂肪;ASH:粗灰分;NFE:无氮浸出物;SWC:土壤含水量;SBD:土壤容重;SOC:土壤有机碳;TN:全氮;TP:全磷;TK:全钾Note:As:Ascomycota;Ba:Basidiomycota;Mo:Mortierellomycota;Gl:Glomeromycota;Bl:Blastocladiomycota;En:Entomophthoromycota;Ch:Chytridiomycota;Ro:Rozellomycota;Ol:Olpidiomycota;Mu:Mucoromycota;CP:Crude protein;CF:Crude fiber;EE:Ether extract;ASH:Crude ash;NFE:Nitrogen-free extract;SWC:Soil water content;SBD:Soil bulk density;SOC:Soil organic carbon;TN:Total nitrogen;TP:Total phosphorus;TK:Total potassium

表5 真菌优势类群与植物营养成分和土壤环境因子之间的相关性分析Table 5 The correlation analysis of dominant fungal groups,plant nutrients and soil environmental factors
注:*表示显著相关(P<0.05);**表示极显著相关(P<0.01)
Note:*means significant correlation at the 0.05 level;**means extremely significant correlation at the 0.01 level
Mantel test分析(表6)表明,植物CP以及土壤pH,SOC,TN,TP和TK是影响不同海拔黄花棘豆内生真菌群落的主要因子(P<0.01);植物EE和SWC对真菌植物优势类群影响较小;Mantel test与RDA分析结果基本吻合。
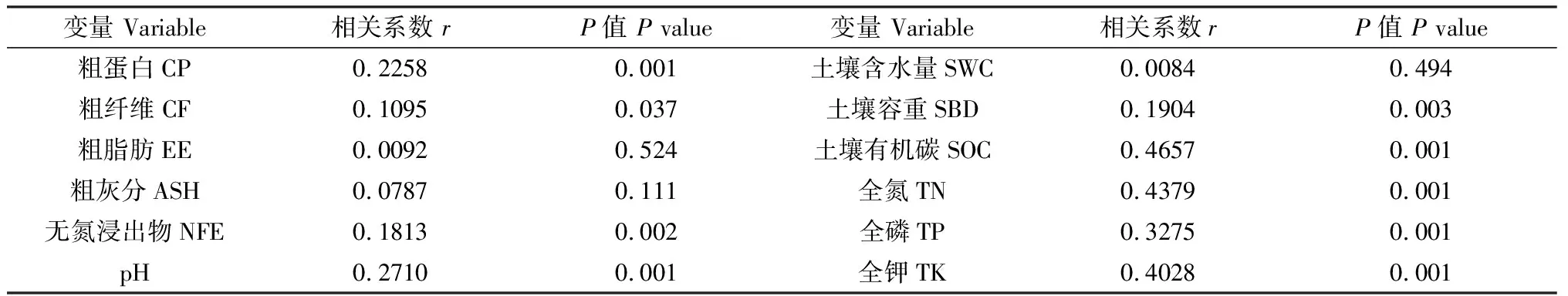
表6 植物营养成分和土壤环境因子的曼特尔分析Table 6 Mantel test analysis of plant nutrients and soil environmental factors
3 讨论
植物体内分布有大量的微生物,这些微生物与寄主植物体内相应的生态空间结构相互作用,形成生理性统一体[31]。内生真菌是共生于健康植物组织内而不引起植物病变和排斥的真菌[32]。本研究基于IonS5TMXL平台,利用Single-End的方法,研究了不同海拔梯度的黄花棘豆真菌群落。研究发现,真菌群落Chao1指数为E>B>D>C>A,表明随海拔升高,物种丰富度大致呈增长趋势,在海拔4 493 m处,物种丰度达到最大,该海拔NFE含量较高,反映了淀粉糖类的积累有利于真菌的生长;Shannon指数为B>C>E>A>D,表明物种多样性在海拔3 000~3 500 m左右达到最高,过高或过低的海拔均会对内生真菌物种多样性造成影响。随着海拔的增高,气温降低、昼夜温差加大,严酷的环境限制了一些真菌的生长,进而限制了黄花棘豆内生真菌数量[33]。
本研究发现,海拔梯度对黄花棘豆微生物群落的影响主要在于微生物量的变化,对于微生物群落结构的影响并不明显,各海拔梯度间具有相类似的优势菌群,从门水平上来看,随海拔的上升,子囊菌门和担子菌门均属优势菌群,数量呈先上升后下降的趋势,均在海拔3 005 m处达到最高,但两种真菌丰度变化差异较大。Frey[34]研究表明,子囊菌门多数为腐生菌,主要作用是分解植物残体和降解土壤有机质,而担子菌门分解木质纤维素的能力较强。本试验中子囊菌门之所以能占比最大,可能是因为其无性繁殖能力很强,能产生大量的分生孢子,增长迅速,使其在数量上占优势[35],这说明海拔梯度对黄花棘豆微生物量的影响强度高于对微生物群落结构的影响,或本研究中海拔梯度变化程度未达到引起黄花棘豆微生物群落结构显著变化的阈值。从属的水平来看,每个海拔梯度均发现目前已知的能产生苦马豆素的链格孢属真菌,但随海拔梯度的上升,数量增加,在海拔3 490 m处达到最高,说明高海拔地区可能更加利于产苦马豆素,但链格孢属真菌在整个属分类水平下所占的相对物种丰度比例仅为0.01%~0.14%。海拔3 005 m处,物种丰富度与多样性均较高,但链格孢属真菌所占的物种丰度比例反而是各个海拔梯度中最低的,仅为0.01%,这表明链格孢属可能在植物体内不属于具有竞争性的优势菌种。
本研究采取的植物样品所测得的试验结果,内生真菌群落的相对丰度均较小,样品稀释曲线表明测序深度已基本达到,但仍出现这种结果,究其原因可能是因为黄花棘豆内生真菌数量只在植物体内占极少部分,也可能是因为青藏高原特殊的环境因素,研究区低温环境限制有机物的可利用性,不利于植物的生长,微生物遇到恶劣环境时进入休眠状态更是普遍现象。研究发现[36],土壤有机碳含量变化与物种多样性变化规律相一致,土壤有机碳作为土壤性质的重要指标,在一定程度上影响了植物的生长,进而影响植物内生真菌的分布。有研究[37,38]表明,微生物在pH近中性时多样性最高,土壤pH一旦偏离中性,植物微生物群落会受到环境胁迫压力,导致多样性降低。土壤肥力和植物营养与植物内生真菌密切相关。本研究通过RDA并结合Mantel test分析了真菌优势类群与植物营养以及土壤环境因子之间的相互关系,结果表明,内生真菌种群数量的变化主要受植物体内CP及土壤环境因子(pH,SOC,TN,TP和TK)的影响,究其原因可能是土壤营养物质及植物营养的减少引起微生物生存与繁殖环境变劣,使微生物数量和活力大幅度下降。
4 结论
不同海拔梯度黄花棘豆真菌群落的多样性无明显差异;而真菌群落丰度在海拔3 005 m处最高。研究区各海拔黄花棘豆真菌群落组成的优势类群均为子囊菌门和担子菌门。随着海拔升高,黄花棘豆内生真菌多样性先增后降,内生真菌种群数量的变化主要受植物体内CP及土壤pH,SOC,TN,TP和TK的影响。
