核受体Nur77基因缺失诱导再生肝细胞凋亡及肝损伤
2019-12-19聂玉强
詹 琪 缪 旋 聂玉强
广州市第一人民医院消化内科(广州510180)
肝脏的再生能力是肝损伤后肝功能恢复正常的重要保障机制。小鼠的肝大部分切除术(partial hepatectomy,PHx)是研究肝再生的主要动物模型[1],PHx术后肝内枯否细胞(kupffer cell,KC)被激活[2],后者释放大量炎症因子诱导肝细胞进入增殖周期,启动肝再生。
核受体Nur77是调控癌基因表达的重要转录因子,与细胞增殖和凋亡均密切相关[3],在前列腺、胃及胰腺恶性肿瘤中均表达上调[4- 6]。然而我们的前期研究发现,Nur77基因缺失小鼠PHx术后早期肝再生的进程加速,同时Nur77的靶基因PAI-1的表达下调,提示Nur77及其下游基因对肝再生早期的促增殖信号通路起抑制作用[7]。本研究进一步深入探讨Nur77及其下游通路对肝再生早期肝脏细胞增殖的调控机制,为研究肝再生过程中复杂精准的信号网络提供更多的实验依据。
1 材料与方法
1.1 实验动物
雄性Nur77基因敲除(knockout, KO)C57BL/6小鼠(由加州大学Wan教授惠赠)及野生型(wild type, WT)对照,均为12~14周龄,体质量范围18.6~24.1 g,其中WT组(21.2±1.21)g,KO组(20.9±1.01)g,两组小鼠体质量无差异。各组设PHx术后1 h、3 h、8 h、24 h、36 h、48 h和72 h,每个时间点5只小鼠,每组共35只小鼠[8]。本研究涉及的与动物实验相关的内容与程序经华南理工大学实验动物中心伦理委员会审核,遵从实验动物使用和管理的相关法律法规,保证实验动物的福利,动物伦理学编号(2017005)。
1.2 实验材料与试剂
TUNEL试剂盒购自Thermo Scientific 公司,real-time PCR Power SYBR@Green PCR Master Mix、cDNA试剂盒、均购自Life Technologies公司。Cleaved Caspase-3抗体、β-actin抗体等购自Santa Cruz公司。
1.3 方法
1.3.1 PHx手术方法参考作者已发表文章[8]
1.3.2 Real-time PCR:取50 mg肝组织,用Trizol试剂提取总RNA,Bioanalyzer 2100测定RNA浓度和纯度。cDNA制备:用cDNA逆转录试剂盒(货号4374967),取1 μg总RNA按试剂盒说明书制备20 μL反应体系,反应条件为25℃ 10min,37℃ 2 h,85℃5min,4℃长期保存。用Primer3web设计小鼠caspase-8基因引物序列。引物、cDNA与Power SYBR@Green Master Mix混合成20 μL反应体系,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)为内参基因,用2-ΔΔCt值法计算相对基因表达量。Ct值来自于3次独立试验的均值。
1.3.3 末端脱氧核苷转移酶介导的dUTP缺口末端标记法(TUNEL)和血清丙氨酸氨基转移酶(ALT)检测。 按In Situ Cell Death Detection Kit, TMR red (德国Roche公司)说明书所示,细胞核用4′,6-二脒基-2-苯基吲哚(DAPI, Invitrogen,美国)。计数在荧光显微镜下呈红色荧光的细胞核,最少5个高倍视野(40×)。血清在-20℃ 保存,使用Liquid ALT Reagent试剂盒测定血清ALT浓度。
1.3.4 Western-blot:肝组织匀浆(40 μg)用聚丙烯酰胺凝胶恒压电泳分离并电转移至PVDF膜,5%脱脂牛奶封闭抗原,与Cleaved Caspase-3单克隆抗体4℃摇床缓慢孵育过夜,洗涤液洗涤室温10min 5次,与HRP标记的二抗4℃摇床缓慢孵育 1 h,洗涤液洗涤室温10min 5次,BeyoECL Plus试剂盒显影,并用Scion Image软件量化蛋白条带密度,以内参蛋白β-actin为参照计算Cleaved Caspase-3蛋白的相对表达量。
1.4 统计学方法
所有数据用EXCEL软件进行处理分析;两组凋亡细胞核计数、血清ALT浓度、定量PCR以及蛋白相对表达量结果比较用成组t检验,P<0.05 被认为差异有统计学意义。
2 结 果
2.1 Nur77基因敲除小鼠肝再生过程出现肝细胞坏死
PHx术后所有小鼠均存活至指定时间点,按各时间点处理小鼠,通过对两组各时间点的肝组织苏木素伊红(hematoxylin-eosin HE)染色并观察,见图1,KO组PHx术后各时间点均发现肝组织局灶性坏死。两组发生肝坏死的例数统计见表1,KO组在PHx术后72小时内共有11只个体出现肝坏死,占比约30%,高于对照组。

表1肝大部分切除术后肝损伤发生率
两组小鼠的血清ALT检测结果显示KO组术后48 h和72 h血清ALT水平高于对照组(466.3±202.4 vs 72.0±58.8,t=4.18,P=0.009;486.2±156.3 vs 63.0±0.3,t=6.06P=0.004)图1B,提示KO组在肝再生过程中存在肝损伤。
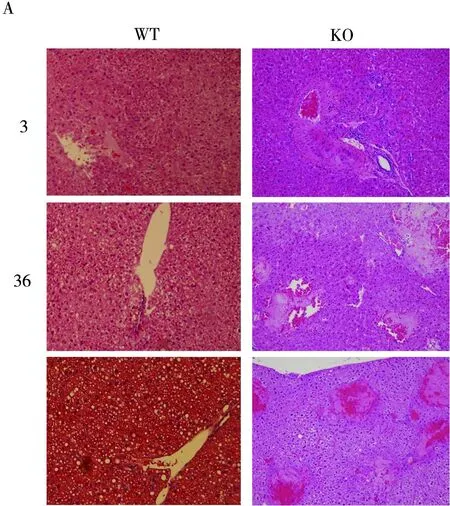

图1 PHx术后各时间点肝坏死情况注:A:小鼠肝组织HE染色(×40)补充放大倍数;B:#:P < 0.01
2.2 Nur77基因缺失诱导再生肝细胞凋亡
为进一步阐释Nur77对诱导KO组肝再生过程中发生肝坏死的分子机制,作者用TUNEL试剂盒对肝组织进行凋亡特异性染色。见图2, KO组术后3 h和48 h肝组织内凋亡细胞核计数高于对照组(38.7±9.6 vs 2.8±0.2,t=8.23,P=0.001;87.3±19.4 vs 8.4±3.1,t=8.96,P=0.001)。提示Nur77缺失导致小鼠肝再生过程发生细胞凋亡。
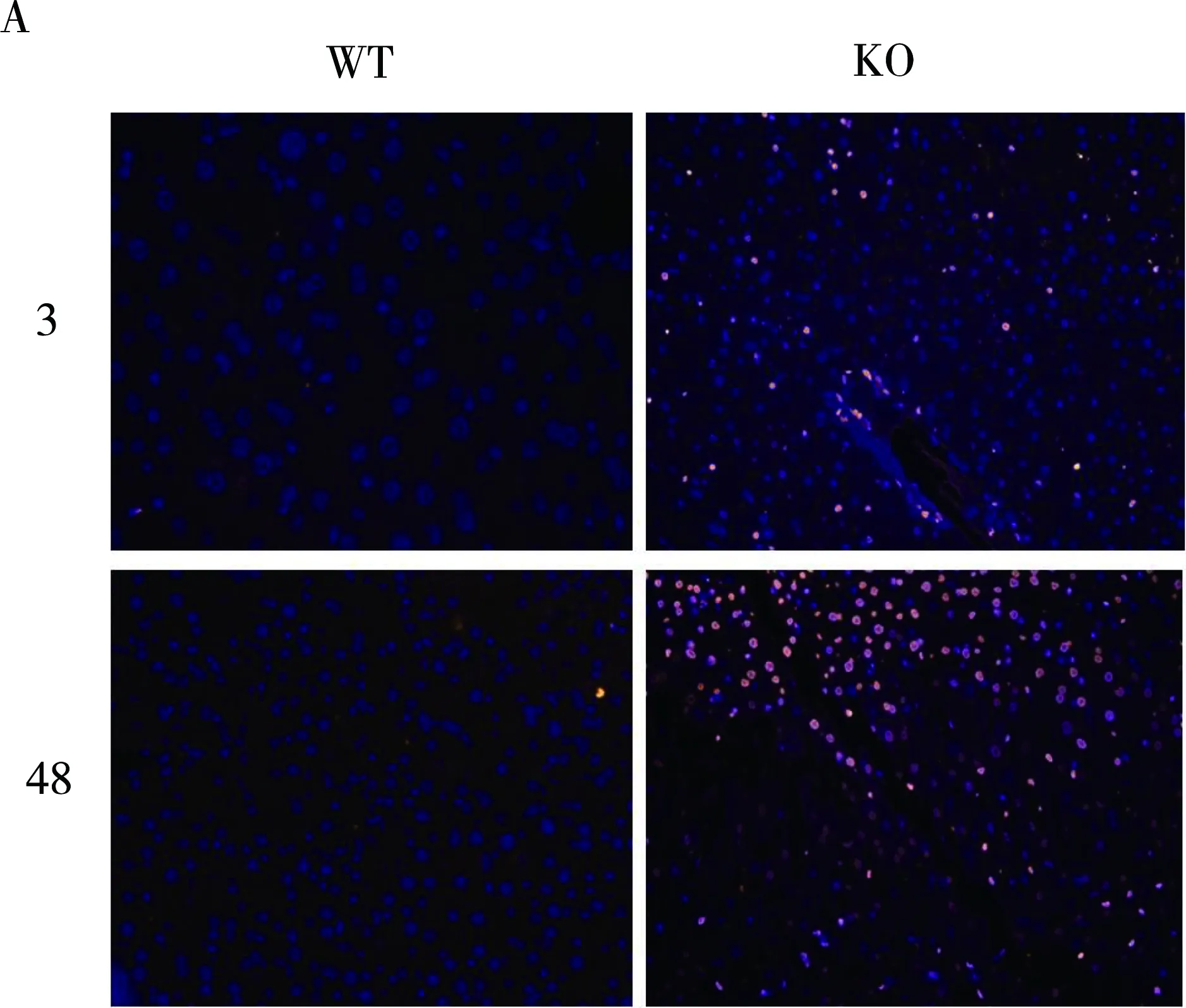
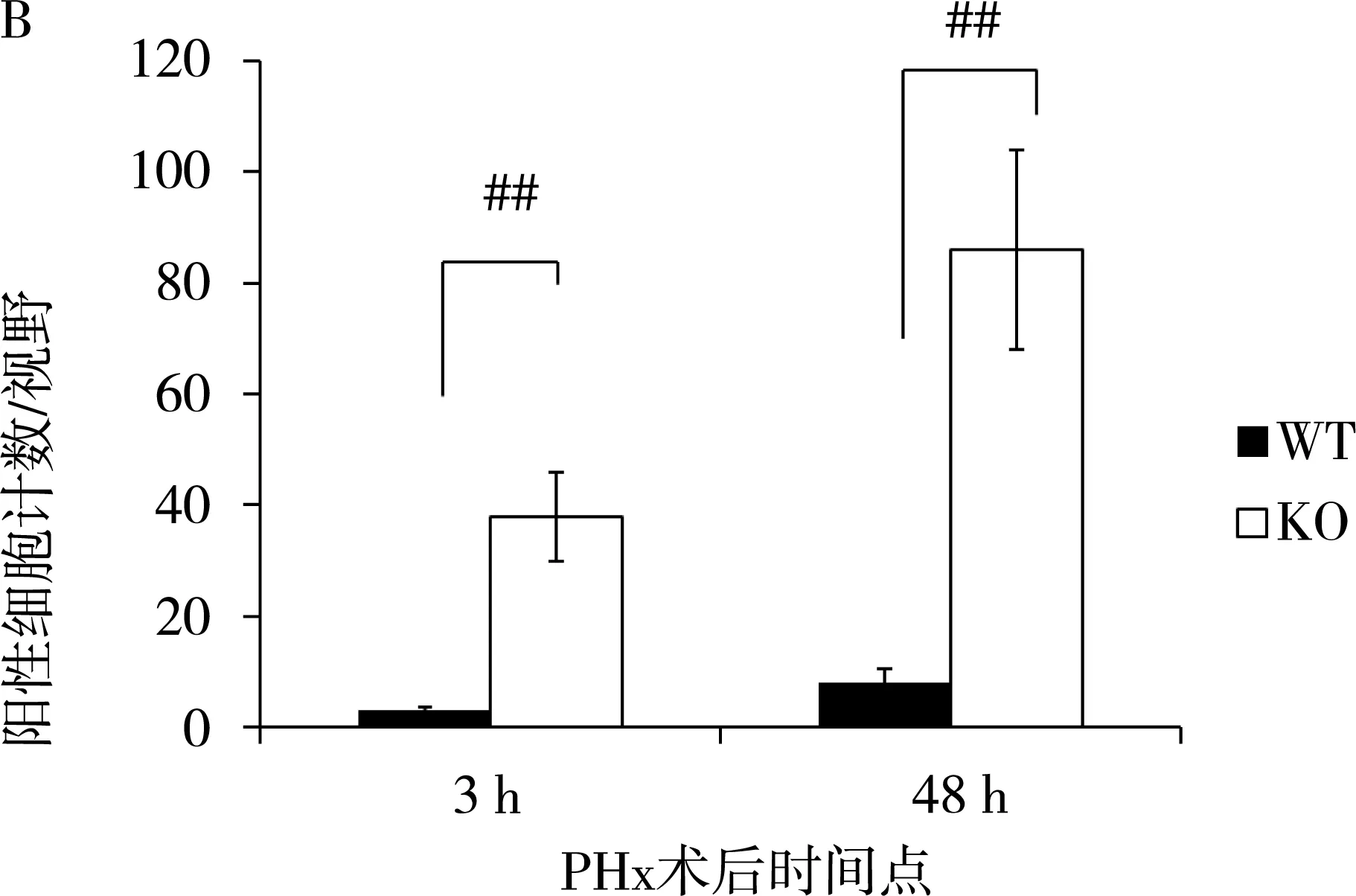

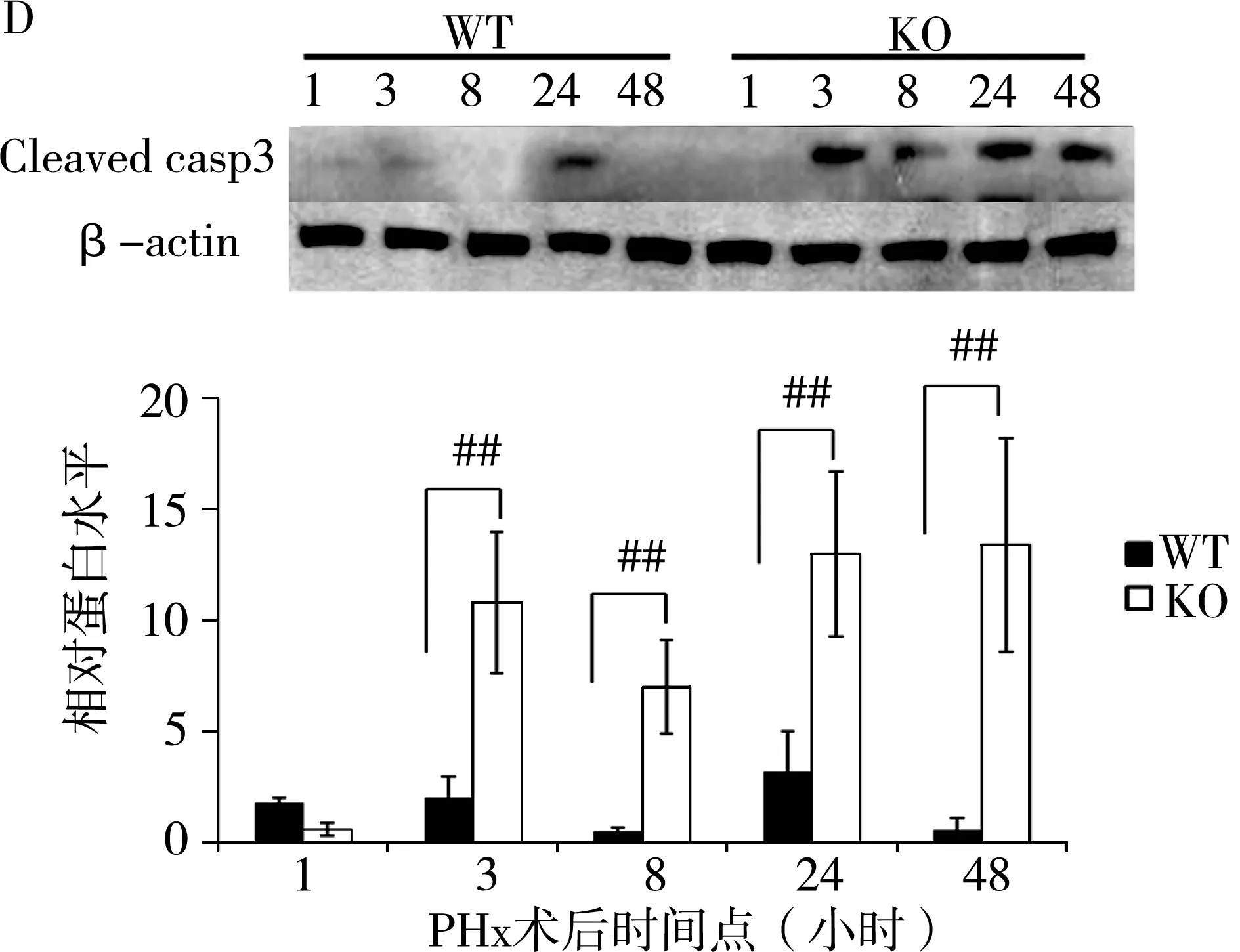
图2 PHx术后3小时、48小时肝细胞凋亡情况注:A:凋亡细胞经DAP-I染色后镜下呈亮红色;B:计数5个高倍视野(×60)内凋亡细胞数;C:PHx术后各时间点小鼠肝内caspase8基因mRNA;D:剪切的caspase3蛋白水平。#:P<0.05;##:P<0.001。
两组肝组织中凋亡基因caspase-8的mRNA水平见图2 C所示,PHx术后1、3、8、24 h KO组caspase-8基因的mRNA水平高于对照组(2.68±0.53 vs 1.88±0.18,t=3.19,P=0.012;5.16±0.85 vs 1.98±0.25,t=8.08,P<0.01;4.34±0.43 vs 2.24±0.47,t=7.38,P<0.01;2.46±0.49 vs 1.35±0.26,t=4.11,P<0.01)。剪切的caspase-3蛋白水平用来衡量组织中细胞凋亡的程度,我们用蛋白免疫印迹检测再生肝组织中剪切caspase-3蛋白表达量,见图2D,PHx术后3、8、24、48 h KO组肝内剪切caspase-3蛋白高于对照组(10.35±3.95 vs 2.34±1.20,t=4.33,P=0.008;7.24±2.47 vs 0.51±0.20,t=6.02,P=0.003;13.04±4.77 vs 3.39±2.03,t=4.16,P=0.007;13.56±5.56 vs 0.60±0.57,t=5.19,P=0.006),提示KO组肝脏再生过程中发生肝细胞凋亡。
3 讨 论
肝脏具有强大的再生能力,发挥并放大肝脏的再生能力,能最大限度的提高肝脏切除术后或者急性肝衰竭患者的存活率[9]。肝再生的早期阶段是一个“肝脏免疫细胞活化——炎症因子释放——免疫再激活”的级联放大的炎症反应过程[10- 12]。然而大量活化的免疫细胞和炎症因子在调控肝细胞进入增殖周期的同时又能够避免对肝组织的炎症损伤,需要有一种“选择机制”精准的切换增殖与死亡相关信号通路的激活。
我们在研究Nur77对肝再生调控机制的过程中发现:该基因的缺失导致肝再生早期进程加速,且肝细胞提前进入分裂周期,提示Nur77可能通过其下游信号通路抑制肝再生的细胞增殖[8]。然而我们进一步研究发现,KO组30%的小鼠发生组织坏死及肝损伤,进一步凋亡特异性染色发现KO组肝组织中凋亡细胞数量显著增加,提示Nur77基因缺失诱导小鼠再生肝脏凋亡及肝损伤。Nur77基因敲除小鼠肝脏再生过程中这种“细胞损伤”与“细胞增殖”并存的现象说明Nur77可能是肝再生过程中维持“炎症损伤-细胞增殖”稳态的关键因子,因此我们假设Nur77通过调控肝再生早期炎症因子信号通路的下游基因表达,并通过其核-浆转运机制实现细胞增殖或者凋亡的效应[13- 14]。
Nur77的核-浆转运与凋亡蛋白caspase-3和caspase-8的表达与活化密切相关[15- 17],为了进一步验证Nur77缺失诱导小鼠再生肝脏凋亡的分子机制,我们分别从mRNA和蛋白水平检测肝再生进程中肝细胞的凋亡过程。结果显示KO组肝脏在PHx术后3小时,凋亡基因caspase-8及剪切的caspase-3蛋白水平即显著上调并持续至术后48小时。这一结果与组织学及血清学改变相一致,后者于术后48至72小时达峰值。然而实验中肝损害与细胞凋亡并非完全一致,部分肝损害个体出现在术后1至3小时,此时肝脏凋亡基因表达开始上调,提示肝细胞凋亡继发于肝损害。肝内KC细胞的激活是肝再生启动的关键机制[18- 19],PHx术后门静脉内快速增多的脂多糖(LPS)诱导肿瘤坏死因子α(TNFα)上调,后者激活肝内KC细胞,活化的KC细胞释放大量炎症介质诱导肝细胞增殖,而Nur77缺失与巨噬细胞的过度激活密切相关[20],进而导致再生肝脏出现炎症损伤。
综上所述,核受体Nur77可能是调控肝再生过程中“增殖-凋亡”稳态的重要调控因子,进一步研究将有助于阐释调控肝再生这一精准且复杂过程的信号网络。
