榆林沙区引种波尔卡树莓的组织培养与快速繁殖
2019-12-19王建新吴志茹冯光惠
王建新,吴志茹,冯光惠
(1.榆林市林业工作站,陕西榆林719000;2.榆林学院生命科学学院,陕西榆林719000)
树莓(Rubus idaeus L.)俗称覆盆子,是蔷薇科悬钩子属(Rubus L.)植物,为多年生落叶灌木果树。树莓果实营养价值高、口感好,果实中除含有丰富的糖类、氨基酸、纤维素外,还有糅化酸、SOD 酶、类黄酮等对人体具有保健作用的成分。树莓的根茎叶在医药、化妆、保健、食品、加工等方面都有着广泛的用途。树莓生长快、耐瘠薄、耐干旱,是优良的水土保持植物[1]。树莓与沙棘、枸杞并列为北方三大水土保持先锋植物,并逐渐向产业化方向发展[2-4]。近年来,树莓的国内外市场需求不断增加,果实价格持续上涨,东北地区和内蒙古等北方优生地人为采摘果实现象普遍,养护管理措施相对滞后,野生种质资源破坏严重,优势野生种源地不断减少,优质果实产量相对降低[5-6]。因此,拓展和引进树莓优质种质资源,在适生地开展树莓新品种的栽培和利用具有十分重要的意义。
榆林市林业站近年从东北地区引进多个红树莓品种,在榆林沙区经过5~6 a 的驯化栽培,生长势良好,抗寒、抗旱、抗病虫害和耐盐碱等适应能力均很强,但不同品种结果能力有差异,其中,波尔卡口感好,味道美,结果性状好。传统的繁殖方法是靠根蘖、扦插、压条进行,繁殖系数低,苗木质量差,不利于规模化生产的需要[7-8]。利用植物组织培养技术生产树莓苗木,不仅能保持母株的优良特性,同时可提高繁殖系数和苗木质量。
本研究以榆林沙区引种成功且结果性状优良的树莓品种波尔卡为试材,以春季新梢幼嫩茎段和茎尖为外植体,通过组培方法研究不同培养基上外植体的生长状况,探索树莓的组织培养和快速繁殖体系,以期为榆林沙区引种树莓的产业化育苗提供技术支持。
1 材料和方法
1.1 试验材料
供试材料是2017 年春季从东北地区引进的2 年生树莓新品种波尔卡,在榆林沙区经过2 a 的引种栽培和田间试验,生长势良好。2019 年4 月于引种基地采集1 年生枝条上萌发的幼嫩新梢,装于保湿透气塑料袋带回实验室进行处理。
1.2 试验方法
1.2.1 外植体的灭菌 剪去幼嫩新梢上的叶片并剪成4~5 cm 长带1~2 个芽的茎段,每次试验剪15~20 个茎段,用1%的吐温-80 浸泡10~15 min,自来水下冲洗0.5~1.0 h,备用。在超净工作台上,将外植体材料转入无菌烧杯中,用75%的酒精浸泡约30 s,无菌水漂洗2 次,再用0.1%的HgCl2溶液浸泡消毒,消毒时间设置为4,6,8,10,12 min,每隔2 min 用玻璃棒搅拌1 次,使漂浮在液面上方的材料能够充分接触消毒液,无菌水漂洗5 次,分装于无菌培养瓶。每瓶接种1 个外植体,不同消毒时间均接种40 瓶,统计不同消毒时间的污染率和对外植体的伤害程度。
1.2.2 外植体的接种与培养
1.2.2.1 初代诱导培养 用无菌滤纸吸取外植体上的多余水分,将外植体切成大约1 cm 长带1 个腋芽或顶芽的茎段,接种在以MS 为基本培养基附加不同质量浓度激素配比(6-BA 分别为0.5,1.0,1.5,2.0 mg/L,NAA 分别为0.05,0.10,0.20 mg/L)的12 种诱导培养基上,每种培养基接种40 个腋芽和10 个顶芽。为降低污染率,每瓶接种2 个外植体。暗培养7 d 后转为25 ℃光照培养16 h。研究不同培养基对愈伤组织诱导的影响,30 d 后统计愈伤组织诱导率以及侧芽和顶芽的萌发率。
1.2.2.2 继代增殖培养 取已萌发1~2 cm 的单芽或切割丛生芽为单芽,接种在含不同质量浓度激素配比(6-BA 分别为1.0,1.5,2.0 mg/L,NAA 分别为0.01,0.02,0.05 mg/L)的9 种增殖培养基上,每瓶接种2 个单芽,每种培养基接种10 瓶。25 ℃光照培养16 h,观察记录生长情况,统计不同培养基对单芽增殖的影响,30 d 后计算平均增殖系数。
1.2.2.3 生根培养 取3~4 cm 长的单株苗,分别接种于MS、1/2 MS、1/3 MS 添加不同质量浓度IBA(0.1,0.2,0.5 mg/L)的9 种生根培养基中,每瓶接种2 个单株苗,每种培养基接种20 瓶。研究不同培养基对树莓组培苗生根的影响,30 d 后统计生根率及根系生长状况。
1.2.3 组培苗的驯化移栽 组培苗的驯化移栽是植物组培快繁的重要环节,需要从无菌向有菌、高温向变温、高湿向低湿、弱光向强光等环境因素转变。选用冀菲等[9]研究黑果枸杞组培苗驯化移栽的基质,前期7 d 的炼苗阶段与培养室环境相似,遮阴降低光照强度,喷洒自来水保湿且降低温度,相对湿度为85%~90%;后期驯化阶段与室外环境相近,逐渐增加自然光照。
2 结果与分析
2.1 消毒时间对外植体污染率的影响
由表1 可知,先用75%的酒精对外植体消毒30 s,再用0.1%的HgCl2溶液消毒8 min 效果最好,污染率为7.5%,外植体颜色未发生变化;灭菌10 min的污染率仍为7.5%,但外植体颜色较消毒8 min变深,有褐变现象,受伤害程度较大;灭菌12 min的污染率为0,受伤害程度严重,严重影响外植体活性,会导致愈伤组织诱导率和成苗率降低。

表1 灭菌时间对外植体污染率的影响
2.2 不同培养基对愈伤组织诱导率及芽萌发的影响
外植体接种到培养基上,对于不易形成不定根的植物,需通过诱导的愈伤组织吸收养分和水分。以MS 为基本培养基,将无菌外植体茎段和茎尖接种于添加不同浓度激素配比的诱导培养基中,暗培养7 d 后,在外植体切口处出现白色的愈伤组织,呈松散的不规则瘤状;转为光照培养,愈伤组织颜色由白逐渐变绿,膨大突起,逐渐增殖变大变松散。30 d 后在愈伤组织表面观察到绿色的不定芽,同时茎段侧芽和顶芽萌发变长。从表2 可以看出,不同激素配比对愈伤组织诱导的影响差异较大,在细胞分裂素6-BA 浓度一定时,随着生长素NAA 浓度的升高,愈伤组织的诱导率相应升高,其中,在4 种6-BA 浓度中,当6-BA 质量浓度为1.0 mg/L 时,相应诱导率均最高;在生长素NAA 浓度一定的情况下,随着6-BA 浓度的升高,愈伤组织诱导率变化不大,其中,当NAA 质量浓度为0.2 mg/L 时,相应诱导率均最高。在愈伤组织形成不定芽的同时,顶芽和侧芽均能够萌发,但二者的萌发率不同,统计12 种培养基中所有侧芽(480 个)和顶芽(120 个)外植体的萌发情况发现,侧芽的萌发率为80%,且在不同培养基中的生长势差异较大;顶芽的萌发率为100%,且生长健壮,整齐一致。因此,最适合树莓外植体愈伤组织诱导的培养基是MS+6-BA1.0 mg/L+NAA 0.20 mg/L,诱导率为96%,选取顶芽为外植体更合适。

表2 不同培养基对树莓外植体愈伤组织诱导率的影响
2.3 不同培养基对芽增殖的影响
取1~2 cm 生长健壮携带少量愈伤组织的单株苗,接种在含不同浓度激素配比的增殖培养基上,培养7 d 后,单株苗基部愈伤组织开始变大变绿,之后逐渐增大并再次分化出丛生不定芽,30 d 后统计平均增殖系数发现,不同培养基诱导分化丛生芽的能力不同,平均增殖系数不同,丛生芽的生长势差异较大。在6-BA 浓度一定时,随着生长素NAA浓度的升高,不定芽总数相应升高,但是,在3 种6-BA 浓度中,当6-BA 质量浓度为1.5 mg/L 时,相应不定芽总数均最高;在生长素NAA 浓度一定时,当6-BA 质量浓度为1.5 mg/L 时,不定芽诱导率均最高。所以,最适树莓不定芽增殖的培养基为MS+6-BA 1.5 mg/L+NAA 0.05 mg/L,平均增殖系数为9.70,玻璃化现象较轻,丛生芽生长健壮(表3)。

表3 不同培养基对不定芽增殖的影响
2.4 不同培养基对组培苗生根的影响
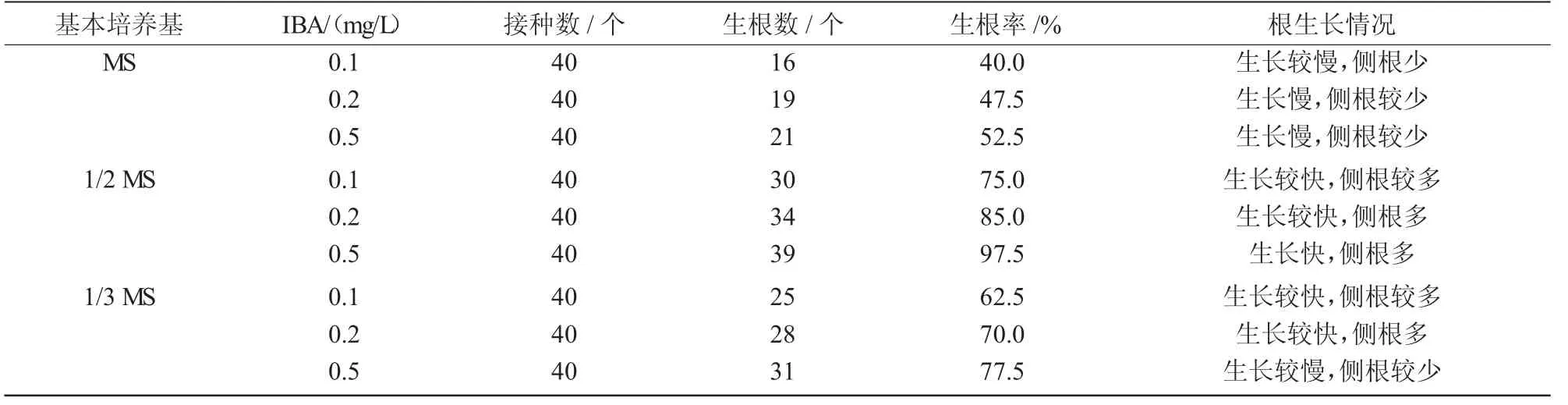
表4 不同培养基对组培苗生根的影响
取3~4 cm的健壮单株,分别接种于MS、1/2 MS、1/3 MS 添加不同浓度IBA 的生根培养基中,7 d 后组培苗基部愈伤组织膨大并生长出白色根尖,14 d后根生长速度加快,在主根上萌发出侧根。30 d 后统计发现,不同培养基及IBA 浓度对树莓组培苗生根的影响不同,生根速度及生根率差异明显,在基本培养基一定时,随着IBA 浓度的升高,生根率均相应升高,其中,1/2 MS 基本培养基的生根率均最高;在IBA 浓度一定时,1/2 MS 基本培养基的生根率也是最高的,且根系生长均正常。所以,最适组培苗的生根培养基为1/2 MS+IBA 0.5 mg/L,生根率达97.5%,且主根比较健壮,侧根数量多,植株生长旺盛(表4)。
2.5 组培苗的驯化移栽
生根培养30 d,选择根系生长健壮、发育良好的组培苗,洗掉根部培养基,剪掉过多须根,仅留主根和部分侧根,将幼苗移入熏蒸消毒基质中,发现泥炭土、蛭石、珍珠岩(体积比为2∶1∶1)营养基质更适合组培苗的生长。经过统计,移栽50 株,成活44 株,成活率高达88%,植株生长健壮,与野生红树莓的外部形态特征相似度高。
3 结论与讨论
本试验结果表明,榆林沙区引种波尔卡树莓的外植体最佳采集时间为4 月下旬,生长活性强,褐变现象较轻;最适外植体材料为新梢顶芽,不仅易诱导形成愈伤组织,而且萌发率高;用HgCl2消毒最佳时间为8 min,最适树莓愈伤组织诱导的培养基为MS+6-BA 1.0 mg/L+NAA 0.20 mg/L,最适树莓不定芽增殖的培养基为MS+6-BA 1.5 mg/L+NAA 0.05 mg/L,平均增殖系数为9.7,最适组培苗的生根培养基为1/2 MS+IBA 0.5 mg/L,生根率达97.5%,且生长势良好,植株健壮。本研究体系能在较短时间内获得数量多且遗传性状稳定的优质树莓组培苗,对推动榆林沙区树莓产业化发展具有重要意义。
在植物组织培养试验过程中,出现污染是普遍现象,其中,外植体接种污染是主要原因,导致试验无法达到预期效果。用0.1%HgCl2溶液灭菌效果要好于10%的NaClO 溶液,但前者一旦污染对人伤害较大,操作要特别小心细致。消毒时间适宜控制在8 min 左右,易双双等[10]、林树燕等[11]有相似报道。在外植体消毒、接种过程中,要严格按照实验规程操作,接种过程中要随时用75%酒精擦拭双手和台面,以减少污染的发生。
在木本植物的组培过程中,易出现褐变现象。褐变是由于植物组织中酚类物质被多酚氧化酶(PPO)氧化后产生醌类物质,逐渐扩散到培养基中并累积起来,抑制细胞中其他酶的活性,毒害培养的外植体材料。在接种前预冷外植体、初代培养前期暗培养、缩短转瓶周期均可抑制褐化现象,李小艳等[12]在黑枸杞组织培养中得出类似的研究结果。外植体取材时间也是影响褐化的重要因素,在榆林沙区最适外植体取材时间是4 月下旬,可能是由于该时期幼嫩茎段部位酚类化合物含量低或多酚氧化酶活性低的原因。
在树莓初代诱导培养中,多数学者以带芽茎段和茎尖为外植体,MS 为基本培养基,并附加不同浓度配比的细胞分裂素和生长素。二者的浓度及比值决定细胞分化的方向,由于所用激素药品的效用不尽相同,采用的激素梯度和配比设计方法不同,导致最终得出的最适培养基配方有一定差异。本研究与毕海林等[13]研究的秋福树莓组织培养相比,所用6-BA 浓度偏小,NAA 浓度相同;与孟静静等[14]研究的黑树莓组培相比,6-BA 和NAA 浓度均偏大,但比值相近,原因有待进一步验证。
在树莓不定芽的继代增殖培养中,因选取的不定芽大小不同、不定芽是否携带愈伤组织以及统计的不定芽大小与时间不同而导致得出的增殖系数均有所差异。本研究选取1~2 cm 带部分愈伤组织的不定芽,得出最适增殖培养基的6-BA、NAA 质量浓度与国内学者[15-17]的研究结果基本一致,即6-BA质量浓度为0.5~2.0 mg/L、NAA 质量浓度多为0.05~0.20 mg/L。在统计不定芽的增殖系数时,衡量芽大小的指标不确定,增殖系数有差异。同一培养基,相同长度的芽,生长过程中的增殖程度也不同,可能是由内部生理生化代谢及培养环境的细微差异导致。另外,培养温度、光照时间等环境因素也是影响增殖系数的因素,仍需进一步深入细致地研究。
生根是木本植物获得健壮组培苗的关键,合适的生长素及浓度是诱导生根的重点。在木本植物组培苗的生根试验中,多数学者选用的生长素是NAA与IBA,有二者混合使用[18-19],也有NAA[20]或IBA[21]单独使用。本试验通过对比得出,单独使用IBA 生根率高,添加NAA 不能有效提高生根率,可能是由于树莓组培苗在增殖培养过程中自身体内合成了较多NAA 的缘故。
驯化移栽是植物组培苗发生质的改变的一个阶段,需要从无菌向有菌过渡,温度、湿度、光照等因子都会发生变化。关于树莓驯化移栽的文献报道较少,冀菲等[9]研究了黑果枸杞组培苗驯化移栽的基质,移栽成活率高;而本研究采用与黑果枸杞相同的基质配方,移栽成活率略低,也低于不同基质配方的树莓移栽成活率[22],可能与树莓不同品种特性及环境的微控有关,仍需深入研究波尔卡树莓品种的生理生化特性,优化驯化移栽的关键环境因子,不断提高移栽成活率,从而能为波尔卡树莓组培苗的工厂化移栽提供技术保障。
