3.0T1H-MRS技术在定量诊断2型糖尿病合并非酒精性脂肪肝病中的应用分析
2019-12-18马春忠王维平蔡春沉刘晓智王建军郭文斌
马春忠,王维平,蔡春沉,张 乐,刘晓智,王建军,郭文斌
(天津市第五中心医院,天津 300450)
0 引言
糖尿病近年来已成为人们关注的健康问题,我国糖尿病发病率大约4.2%[1]。该病往往伴随着心血管疾病、肾脏疾病、眼并发症及脂肪肝等[2]。非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)已成为发达国家最常见肝病类型,也是我国慢性肝病流行的首要病因,成人中发病率为25%~35%,其中2型糖尿病(type 2 diabetes mellitus,T2DM)是 NAFLD的主要病因[3]。NAFLD在我国普通人群的患病率为12%~24%,而T2DM患者NAFLD的患病率高达75%,并且逐年提高[3]。
NAFLD指除外酒精(无饮酒史或饮酒但含乙醇量每周男性<140 g、女性<70 g)和其他明确的损肝因素(病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等)所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征,与胰岛素抵抗和遗传易感性密切相关的获得性代谢应激性肝损伤,包括非酒精性单纯性脂肪肝、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)及其相关肝硬化[4]。随着肥胖和代谢综合征的流行,NAFLD已成为我国第一大慢性肝病和健康查体肝酶异常的首要因素。目前对于NAFLD的诊断,临床上有创伤性和非创伤性2种检测方法。创伤性诊断方法通常以肝穿刺为主,虽然其准确度高,但是因该方法为有创检查,临床很少应用。非创伤性诊断包括以下2种:(1)肝脏影像学表现符合弥漫性脂肪肝的诊断标准且无其他原因可供解释;(2)有代谢综合征相关组分的患者出现不明原因的血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、谷氨酰转肽酶(GGT)持续增高6个月以上,减肥和改善生活习惯后,异常酶谱和影像学脂肪肝改善甚至恢复正常者。2010年修订的《非酒精性脂肪性肝病诊疗指南》中规定了B超及CT诊断非酒精性单纯性脂肪肝的标准,这2种方法可对NAFLD进行定性诊断和半定量诊断。随着影像技术的飞速发展,氢质子磁共振波谱(1H-magnetic resonance spectroscopy,1H-MRS)技术日益发展成熟,在NAFLD的定性和定量诊断上发挥了重要作用[5]。本研究以血清酶谱为NAFLD标准,使用3.0T1H-MRS定量分析T2DM合并NAFLD患者的脂肪含量,并与CT和双梯度回波磁共振成像技术(dual gradient echo-magnetic resonance imaging,DGE-MRI)进行比较,探讨其临床应用价值。
1 资料与方法
1.1 一般资料
将2017年2月至2018年6月在我院经临床与血液生化检测的30例T2DM合并NAFLD患者作为T2DM-NAFLD组。所有患者除T2DM及NAFLD病症外,无其他急、慢性肝病和全身疾病,符合中华医学会糖尿病学分会专家委员会2013年修订的《中国2型糖尿病防治指南(2013年版)》[1]中糖尿病的诊断和分类标准及2010年中华医学会肝病学分会脂肪肝和酒精性肝病学组提出的《非酒精性脂肪性肝病诊疗指南(2010年修订版)》[3]中非酒精性脂肪肝的诊断标准,且未经内科治疗。同期选取30例病史、影像检查及临床证实无糖尿病、脂肪肝或其他可引起脂肪肝疾病的健康志愿者作为正常对照组。排除标准:(1)资料不全者;(2)受试者体内有金属植入物或有MRI检查禁忌证;(3)精神疾病及幽闭恐惧症患者。本研究经医院伦理委员会批准,所有受试者自愿加入并签署书面知情同意书。
1.2 标本采集
所有患者及正常对照组均需禁食8 h后抽取空腹静脉血检测血糖等各项指标,并将T2DM-NAFLD组与正常对照组的 ALT、AST、GGT、血糖水平(Glu)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)的结果进行比对,观察2组人员上述检测指标的差异。血常规检测后所有受试者均进行1H-MRS、DGE-MRI和CT扫描,1H-MRS和DGE-MRI均由同一名有经验的医师实施,CT扫描由另一名有经验的技师实施。
1.3 检测方法及相关仪器
使用传统可靠的己糖激酶法检测Glu,使用酶偶联法检测AST、ALT,使用连续检测法检测GGT,使用酶比色法检测TC、TG水平,使用直接清除法检测HDL、LDL,使用免疫比浊法检测载脂蛋白(ApoA、ApoB)。检测设备为日立7010A型全自动生化仪。
1.4 检查方法及图像处理
1.4.1 肝脏MRI检查
所有受试者MRI检查均使用PHILIPS Achieva/Intera 3.0T超导型磁共振扫描仪、SENSE XL2A-Torso相阵控线圈。
1.4.1.1 肝脏1H-MRS扫描
先进行肝脏横轴位T2WI SPAIR及肝脏冠状位T2WI FSE扫描,所得图像用于1H-MRS扫描感兴趣区容积(volumeoftheinterest,VOI)定位。1H-MRS 数据采集采用PRESS序列,扫描参数:重复时间(repetitiontime,TR)2000ms,回波时间(echotime,TE)60ms,信号平均次数 8,体素 20 mm×20 mm×20 mm,带宽(band width,BW)2 000 Hz。根据 T2WI SPAIR 图像,将感兴趣区(interest of region,ROI)置于肝右后叶3个不同的部位,部位的选取以肝实质成分为主且避开肝内胆管和大血管;同一ROI采集2次,一次为水抑制,一次为无水抑制。所有1H-MRS扫描前均行手动匀场调节和自动预扫描,扫描背景统一定值,测量值同一基准,以达到定量要求。
应用PHILIPS自带软件对采集的原始MRS数据进行优化处理,采集所得的1H-MRS谱线经过基线校正,得到VOI内水及脂类物质的波峰,并计算出峰下面积。肝脏脂肪分数(hepatocytes fat fraction,HFF)的测定为脂水比(lipid water ratio,LWR),即 LWR=水抑制的脂峰下面积ALip/无水抑制的水峰下面积Awater×100%。肝脏脂肪波谱由多个脂峰(Lip峰)组成,主要的 Lip 峰为-CH3(0.9~1.1 ppm)和-CH2(1.3~1.6 ppm),总Lip峰为各峰下面积的总和。
1.4.1.2 肝脏DGE-MRI扫描
采用dual-FFE-BH SENSE序列扫描3次,同时获得正相位(inphase,In)和反相位(outofphase,Op)图像。扫描参数:TR120ms,TE1.20ms(In)、2.58ms(Op),视野(field of view,FOV)400 mm,信号平均次数 1,翻转角55°,层厚6 mm,层间距1 mm。对正反相位图像的处理同样应用PHILIPS自带软件处理包进行处理。ROI位置的选取严格比对MRS体素的位置,通过Mean Curve程序同时测得与MRS相应ROI正反相位的信号值(SIn、SOp)。HFF 的计算公式为:HFF=(SIn-SOp)/(2SIn)×100%。
1.4.2 肝脏CT扫描
所有患者CT扫描均使用PHILIPS 256层iCT,受试者均采取仰卧位姿势,全肝扫描。采用螺旋扫描,准直器宽度80 mm,重建层厚5 mm,层间距5 mm,螺距0.993,管电压120 kV,采用智能调节毫安技术。CT扫描后将原始数据导入影像归档与通信系统(picturearchiving and communication systems,PACS),测定CT值的ROI位置选取参照MRS的体素位置,并在同一层面内测出脾脏的CT值,HFF为肝脏与脾的CT值比值(liver spleen ratio,LSR),即 LSR=CT肝/CT脾。当LSR>1.0为无脂肪肝,0.7<LSR≤1.0为轻度脂肪肝,0.5<LSR≤0.7为中度脂肪肝,LSR<0.5为重度脂肪肝。
1.5 统计学分析
收集T2DM-NAFLD组与正常对照组的血液生化检测结果及影像资料。所有数据符合正态分布,则计数资料用n(%)表示,计量资料用±s表示,以P<0.05为差异有统计学意义。统计1H-MRS、DGE-MRI和CT 3种检查方法对肝脏脂肪变的诊断结果,以空腹静脉血 ALT、AST、GGT、Glu、TG 及 TC 值为诊断标准,分别计算3种影像检查方法的特异度、敏感度、阳性预测值及阴性预测值,比较各方法诊断效能。T2DM-NAFLD组与正常对照组1H-MRS参数用±s表示,以P<0.01为差异有统计学意义。
诊断肝细胞脂肪变及脂肪肝的阈值使用ROC分析。比较3种方法对肝脏脂肪含量测定的准确性采用Kappa检验。分析过程应用统计学软件SPSS 22.0完成。
2 结果
2.1 T2DM-NAFLD组与正常对照组血液生化检测结果
与正常对照组相比,T2DM-NAFLD组的Glu、ALT、AST、GGT、TC、TG 和 LDL 均明显升高,差异有统计学意义(P<0.05),而HDL则降低,差异有统计学意义(P<0.05),符合WHO糖尿病专家委员会提出的《糖尿病诊断和分类标准》及中华医学会肝脏病学分会的《非酒精性脂肪肝诊断标准》,详见表1。
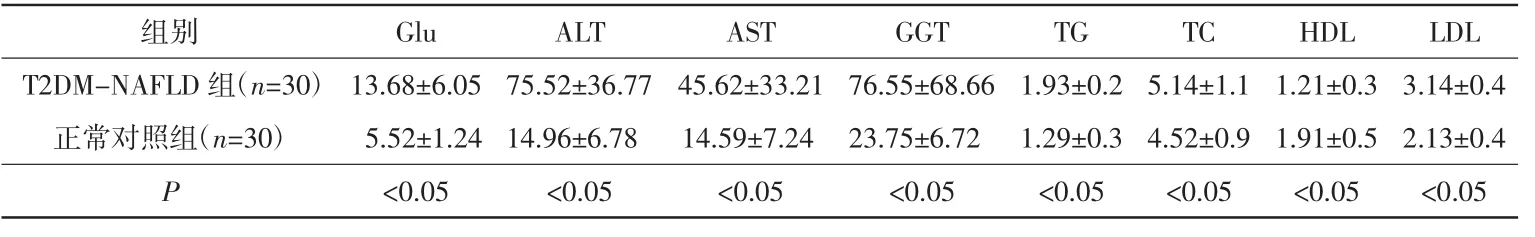
表1 T2DM-NAFLD组与正常对照组血液生化检测结果mmol/L
2.2T2DM-NAFLD的1H-MRS分析结果
正常对照组1H-MRS谱线于1.3ppm处可见低平或几乎不可见的Lip峰(亚甲基峰),其LWR<4.62%,如图1(a)所示;T2DM-NAFLD组谱线均可于1.3 ppm处见Lip峰,随脂肪肝程度不同,波峰高度及ALip发生变化,肝脏脂肪含量越高,Lip峰越高,ALip越大。LWR阈值取4.62%,当LWR>4.62%时,诊断为脂肪肝,LWR与肝脏脂肪变程度呈正比,如图1(b)所示。T2DM-NAFLD组1H-MRS谱线水峰(4.7 ppm)与正常对照组相比,差异无统计学意义(P>0.05)。
T2DM-NAFLD组1H-MRS的Lip峰明显高于正常对照组,差异有统计学意义(P<0.01);T2DMNAFLD组ALip明显大于正常对照组,二者差异有统计学意义(P<0.01)。T2DM-NAFLD组水峰值及Awater变化范围与正常对照组差异不显著,无统计学意义(P>0.05)。T2DM-NAFLD组脂水峰值比较正常对照组显著增加,差异有统计学意义(P<0.01);T2DMNAFLD组LWR相比正常对照组显著增高,差异有统计学意义(P<0.01)。详见表2。
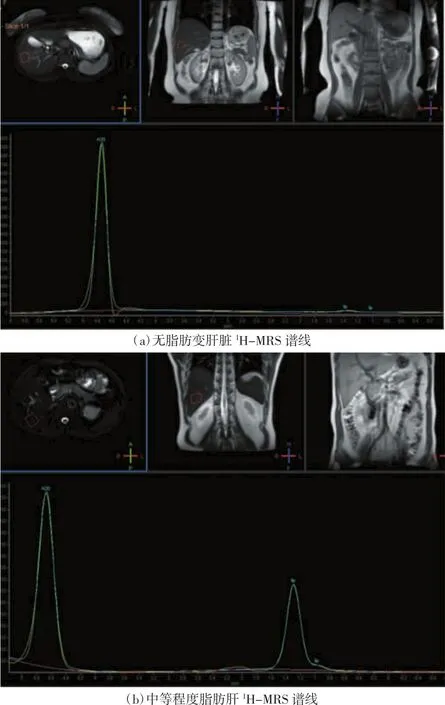
图1 无脂肪变肝脏与中等程度脂肪肝1H-MRS谱线对比图
表2 T2DM-NAFLD组与正常对照组1H-MRS参数比较(±s)

表2 T2DM-NAFLD组与正常对照组1H-MRS参数比较(±s)
组别 Lip峰值ALip/mm2 水峰值Awater/mm2 脂水峰LWR/%(a.u.) (a.u.) 值比/%正常对照组 0.05±0.03 2.48±2.14 1.09±0.54 54.22±39.85 4.59±2.21 4.57±1.15 T2DM-NAFLD 组 0.52±0.28 30.22±25.16 0.89±0.41 49.89±28.89 58.43±38.01 60.57±42.53 P<0.01 <0.01 0.11 0.08 <0.01 <0.01
2.3 1H-MRS、DGE-MRI、CT诊断及定量分析肝脏脂肪浸润的结果
绘制ROC,分别计算3种检查方法的AUC值,1HMRS、DGE-MRI及 CT 分别为 0.978、0.816 及 0.772,1H-MRS、DGE-MRI明显高于 CT,1H-MRS 最大,如图2所示。计算Youden指数和Kappa值:1H-MRS的Youden 指数(0.924)明显高于 DGE-MRI(0.583)和CT(0.450);1H-MRS 的 Kappa值(0.813)显著高于DGE-MRI(0.548)和CT(0.423)。1H-MRS的特异度、敏感度、阳性预测值及阴性预测值分别为100.00%、90.00%、100.00%、90.91%,在3种检查方法中为最高,详见表3。
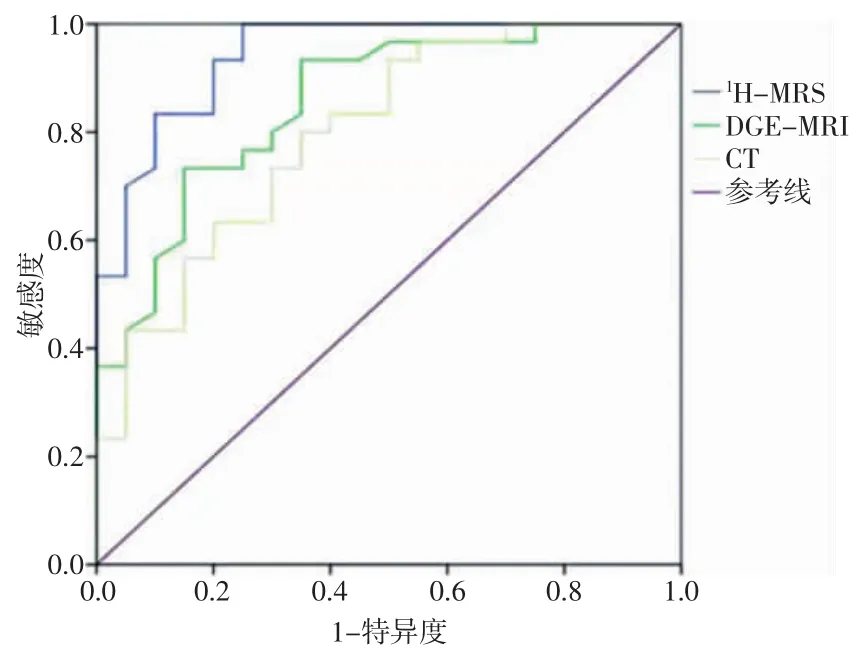
图21H-MRS、DGE-MRI和CT诊断肝细胞脂肪变的ROC曲线
上述3种检查方法在T2DM合并NAFLD患者肝脏脂肪含量的测量中,1H-MRS的诊断效能最高,DGE-MRI次之,CT最低。当1H-MRS测定的LWR达到4.62%时,可认为该患者患有NAFLD。Vuppalanchi等[6]的研究也显示,1H-MRS脂肪评分与组织学分级和肝内脂肪含量均具有显著相关性,相关系数分别为 0.61(P<0.006)和 0.63(P<0.004)。
3 讨论
NAFLD是全球最常见的慢性肝病,包括中国在内的亚洲多数国家NAFLD患病率处于中上水平。近年来,NAFLD已成为健康查体肝功能酶谱异常的主要原因,《非酒精性脂肪性肝病诊疗指南(2010年修订版)》指出:ALT、GGT 增高者应筛查 NAFLD[3,7]。本研究 T2DM-NAFLD 组患者 ALT、AST、GGT、TC、TG和LDL较正常对照组均明显升高,而HDL则降低,差异具有统计学意义(P<0.05)。NAFLD患者起病隐匿、进展缓慢,只有0.6%~3.0%在10~20 a内会进展为肝硬化,而NASH患者则有10%~15%在10~15 a内会发展为肝硬化,因此通过肝脏血清酶学检查及早发现并监测NAFLD患者的治疗效果、病情变化,可使NAFLD患者避免或延迟进入NASH阶段[3]。

表3 1H-MRS、DGE-MRI和CT诊断肝细胞脂肪变的ROC曲线、Kappa分析结果
影像学诊断脂肪肝是NAFLD的重要特征,肝脏脂肪变及其程度与肝脏炎症损伤和纤维化密切相关。上腹部CT检查LSR≤1.0时,诊断为脂肪肝,但LSR反映的只是肝实质密度的改变,当肝实质水肿或其他脂肪变以外因素导致肝实质密度减低时,并不能与脂肪肝导致的密度减低相区分。而B超作为临床应用最广的影像诊断工具,对轻度脂肪肝敏感度低、特异度也有待提高[8]。目前,DGE-MRI技术应用较多,它可在一次重复时间内同时显示同层正相、反相位图,扫描时间短,图像显示清晰,诊断肝脏脂肪变较准确,但DGE-MRI易受肝脏内铁质影响,肝脏铁含量越高,诊断量化准确性越差。2009年Cassidy等[9]首次使用1H-MRS对脂肪肝患者进行脂肪肝定量诊断,并获得了较好的效果。尹子铭等[10]使用1H-MRS技术对肝脏内的脂肪定量进行研究,充分显示出该检测方法的高效性。在以往研究中,由于难以获得脂肪肝穿刺结果,通常以LSR或超声结论作为标准,将1H-MRS技术与其进行比较。在本研究中,笔者尝试以患者临床血生化指标对NAFLD进行诊断评估,再以1H-MRS技术、DGE-MRI及CT同时与其进行比较,分别得出1H-MRS、DGE-MRI及CT的敏感度、特异度、阳性预测值、阴性预测值及Kappa值。三者中1H-MRS诊断肝脏脂肪变的敏感度、特异度、阳性预测值、阴性预测值分别为90.00%、100.00%、100.00%、90.91%,均高于DGE-MRI和CT,且具有高Youden指数(0.924)和Kappa值(0.813)。绘制ROC,分别计算出三者AUC值,其中1H-MRS AUC值为 0.978,高于 DGE-MRI(0.816)及 CT(0.772)。DGE-MRI比较容易显示局部以及弥漫性脂肪肝病灶,但对轻度脂肪肝进行检测时发现其敏感度偏低,而对重度脂肪肝检测时会发生脂水反相,使测得HFF值偏低,且无法对脂肪肝病情恶化程度进行高精度定量分析。1H-MRS检查虽然同样存在非脂肪及非水成分的干扰,但氢质子散发最强信号为水和脂质,由于氢质子在肝实质不同化合物中的化学环境不同,磁屏蔽情况不尽相同,所发生的Larmor频率就有所区别,主要体现在谱线上,表现为不同代谢物对应不同位置波峰,因此1H-MRS准确性更高。通过计算水峰和Lip峰的峰值以及峰下面积,从而得到HFF,可很好地反映肝脏内脂肪含量。
2016年第51届欧洲肝病研究学会年会期间,EASL-EASD-EASO(欧洲肝脏研究协会、欧洲糖尿病研究协会、欧洲肥胖研究协会)共同发布了《EASL-EASD-EASO非酒精性脂肪性肝病管理临床实践指南》,规定肝脏内TG超过5.56%即定为脂肪肝[11]。有研究表明,1H-MRS可以直接用于检测肝脏内TG的含量[12]。肝脏脂质成分复杂,除TG外还包括胆固醇、磷脂、脂肪酸及少量其他脂类,DGEMRI、CT及超声等检查均不能予以区分。1H-MRS的优势在于不同的脂质成分在谱线上位于不同的位置,TG在MRS谱线上有其特定位置,可以认为1HMRS有望代替肝穿刺活检成为诊断脂肪肝的金标准。2017年中国医科大学附属盛京医院有关专家在研究中使用1H-MRS测定肝脏内脂肪及其他组成成分,首次在分子水平上检验了该方法的可靠性,这在NAFLD的治疗效果监测方面具有极为重要的意义[4]。
本研究受研究样本数量影响,存在一定局限性,样本中轻度、中度、重度脂肪肝比例不均匀,重度脂肪肝病例偏少,且本研究方法并不适用于不均匀脂肪肝,在临床应用上尚缺乏普遍性。本研究尝试以血清酶谱为NAFLD的标准,与肝穿刺金标准比较还具有一定的误差,今后还需要更多的样本及其他有意义的相关指标来证实1H-MRS的准确性。目前,1HMRS还不能鉴别NAFLD与NASH,期待在未来的研究中能有所突破。另一方面,在进行1H-MRS扫描过程中,由于时间较长,仪器设备磁场均一性是否稳定会直接影响结果的准确性,该方案仍需进一步优化。
对本实验数据统计分析比较发现,1H-MRS对T2DM合并NAFLD患者肝脏的检测精确度高于DGEMRI和CT。因此,本研究认为高稳定性、高精确度的1H-MRS是评估T2DM合并NAFLD脂肪变的最佳无创性检查方法,可取代创伤性较大的肝穿刺活检,用于T2DM合并NAFLD脂肪含量的定量诊断及临床治疗效果的监测。
