黄河三角洲刺槐臭椿混交林与纯林土壤细菌群落结构和多样性特征分析
2019-12-18马风云崔浩然秦光华黄雅丽
安 然,马风云,崔浩然,秦光华,黄雅丽,田 琪
1 山东农业大学林学院,山东农业大学生态与环境实验室,泰安 271018 2 黄河下游森林培育国家林业局重点实验室,泰安 271018 3 山东省泰山森林生态系统国家定位观测研究站,泰安 271018 4 山东省林业科学研究院,济南 250014
在森林生态系统中,土壤细菌是土壤的重要组成部分,参与土壤中发生的多个生态过程,在推动和确保生态系统物质循环、能量流动以及信息传递[1-2]等生态过程中发挥着极为重要的作用。良好的土壤细菌结构能够改善土壤理化性质,提高土壤肥力,从而促进林分的生长[3]。土壤细菌群落多样性是评价土壤质量的一项重要指标。土壤中细菌多样性越高,越有利于土壤恢复力和抗压力的提高[4]。土壤细菌的种类和分布不仅受土壤理化性质的影响,也受植物种类的影响[5-6]。很多研究表明,土壤细菌群落多样性与植物群落多样性呈正相关,植物群落物种多样性能够显著影响土壤细菌多样性及其群落结构和功能[7]。
黄河三角洲地区是我国典型的盐碱地区域,土壤盐分含量高,导致适合在这里栽培的乔木树种较少,其中刺槐(Robiniapseudoacacia)和臭椿(Ailanthusaltissima)是较为耐盐碱的树种,以往该地区主要大面积栽培单一树种的纯林,尤其是刺槐纯林,由各种耐盐树种组成的混交林则很少。而单一树种构成的纯林有很多缺陷,很多地方营造的纯林极早的出现了退化,因此营造混交林并对其进行研究将是该地区今后造林的发展方向。据不完全统计,在黄河三角洲河口区垦利县(试验所在地)刺槐臭椿混交林栽培总面积在0.2 km2左右。很多学者已经对该地区建立的混交林进行了研究,对黄河三角洲人工刺槐混交林细根分布进行研究时发现刺槐臭椿混交林可提高人工林细根生物量(白世红等[8])。侯本栋等[9]研究表明在黄河三角洲盐碱区混交林有机质、速效氮含量均高于刺槐纯林,同时显著改善了土壤中主要土壤酶活性。由于传统研究方法技术的限制[10],很难完整的对土壤细菌群落的结构和多样性进行分析。近几年发展的第二代高通量测序技术可更全面更准确地描述各种土壤细菌群落信息[11]。但目前利用该技术对刺槐和臭椿混交林土壤细菌的研究还较少。鉴于此,本文选取刺槐臭椿混交林作为研究对象,以相应的2种纯林为对照,比较两种纯林及混交林中土壤细菌群落结构及多样性的差异,这对于该地土壤及植被的恢复具有重要的指导意义,同时可为黄河三角洲盐碱地混交林的营造及管理提供理论依据。
1 材料与方法
1.1 研究地概况
研究地点位于山东省东营市河口区(118°53′27″—118°55′41″E,37°59′14″—37°88′23″N),该地区属暖温带半湿润区大陆性季风气候,年均气温12.94 ℃,无霜期201 d,年均降水量500—600 mm,7—8月降水量约占全年降水量的50%,且多暴雨,易形成旱涝灾害;年均蒸发量为1962.1 mm。土壤为冲积性黄土母质在海浸母质上沉淀而成,层次变化复杂(刘云等[12])。天然植被以盐生、湿生的禾本科植物为主,主要造林树种有刺槐(Robiniapseudoacacia)、国槐(Sophorajaponica)、苦楝(Meliaazedarach)、杨树(Populuseuramericana))、白蜡(Fraxinuschinensis)、柽柳(Tamarixchinensis)等。
1.2 林型选择及采集方法
2016年11月在刺槐纯林、臭椿纯林、刺槐臭椿混交林3种林型中分别设置面积为20 m ×20 m 标准样地各3块,在每个样地按S型设置5个样点,在每个采样点采集0—20 cm土层的原状土,将相同标准地各个样点土样混合均匀,每个土样采集大约500 g左右。所得样品分为2份,装入无菌自封袋,于冰盒中带回实验室。其中1份自然风干后过2 mm筛后用于土壤理化性质的测定;另一份鲜样保存在-80 ℃冰箱中,用于土壤微生物特性的测定[13]。
1.3 土壤理化性质测定
土壤理化性质的测定采用常规分析法:含水量使用便携式土壤水分测定仪测定(TZS-IW);土壤pH采用电位法(Starter 2C);有机质(soil organic matter, SOM)采用容量法(外加热法)重铬酸钾氧化-油浴加热法测定;碱解氮(available nitrogen, AN)采用碱解扩散法;有效磷(available phosphorous, AP)采用氟化铵-盐酸法测定;速效钾(available K, AK)采用火焰光度计法,全氮(total nitrogen,TN)采用凯氏定氮法;全磷(total phosphorus,TP)采用NaOH熔融-钼锑抗比色法[14-15]。
1.4 土壤细菌DNA提取、处理及上机流程
采用CTAB方法对样本的总DNA进行提取[16]。用Qubit2.0检测DNA浓度,琼脂糖凝胶电泳检测DNA完整性。每个样品3个重复,将同一样品的土壤DNA混合,作为每份土壤样品的总DNA。使用带Barcode的特异引物Phusion® High-Fidelity PCR Master Mix with GC Buffer(New England Biolabs,USA)以及高效和高保真的酶进行细菌PCR扩增,以确保扩增效率和准确性。引物对应区域为:16S V4区引物为515F-806R。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等浓度混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,采用胶回收试剂盒GeneJET(Thermo Scientific, USA)对DNA进行回收。回收产物用Qubit 2.0定量,根据测得的DNA浓度,将所有样品按照1∶1的比例进行混合,该混合样品可用于后续的测序,从而省去建库过程。
试验上机流程主要包括:PCR扩增、等量混样以及产物纯化。以上流程由北京诺禾致源生物信息科技有限公司提供,测序仪器为Illlumina公司Miseq,测序所得结果截掉质量低的数据,以提高后续序列融合比率。通过Flash软件融合双末端序列,使其形成一条序列。采用 prinseq软件对各个样品进行去引物序列、短片段、低复杂度序列、低质量序列。
1.5 物种注释与丰度计算
利用Uparse[17]软件对所有样品的全部有效序列(Effective tags)进行聚类,默认以97%的一致性(Identity)将序列聚类成为OTUs(Operational taxonomic units),同时选取OTUs的代表性序列,依据其算法原则,筛选OTUs中出现频率数最高的序列作为OTUs的代表序列。将这些代表性序列集合用RDP Classifier[18]与GreenGene数据库[19]进行物种注释分析(设定阈值为0.8—1),研究OTUs之间的系统发生关系,获得分类学信息用Mothur软件包以97%为划定阈值对16S rRNA基因序列划分操作分类单元(OTU),并构建稀释曲线。利用QIIME软件计算样品包括Chao 1指数和Shannon指数的Alpha多样性值[20]。
1.6 数据分析
利用QIMIE(Version 1.50)软件对样品的Alpha多样性进行计算,包括Observed species指数、Chao1指数和Shannon指数,利用SPSS 22.0进行单因素方差分析(Duncan)及相关性分析(Pearson)。采用R语言进行统计分析和作图。
2 结果与分析
2.1 土壤理化性质分析
由表1可知,刺槐臭椿混交林土壤含水量显著高于纯林,且两纯林土壤之间差异显著(P< 0.05)。混交林土壤含水量分别是臭椿纯林、刺槐纯林的137%、252%。臭椿刺槐混交林土壤pH值、全磷含量、碱解氮含量与两纯林相比无显著差异。混交林有机质、全氮含量和速效钾含量显著高于刺槐纯林(P<0.05)但与臭椿纯林相比无显著差异。混交林土壤有效磷含量是臭椿纯林的3.05倍,其差异达5%显著水平,但与刺槐纯林之间无显著性差异。混交林土壤有效磷速效钾含量显著高于刺槐纯林(P< 0.05),但与臭椿纯林之间无显著性差异。
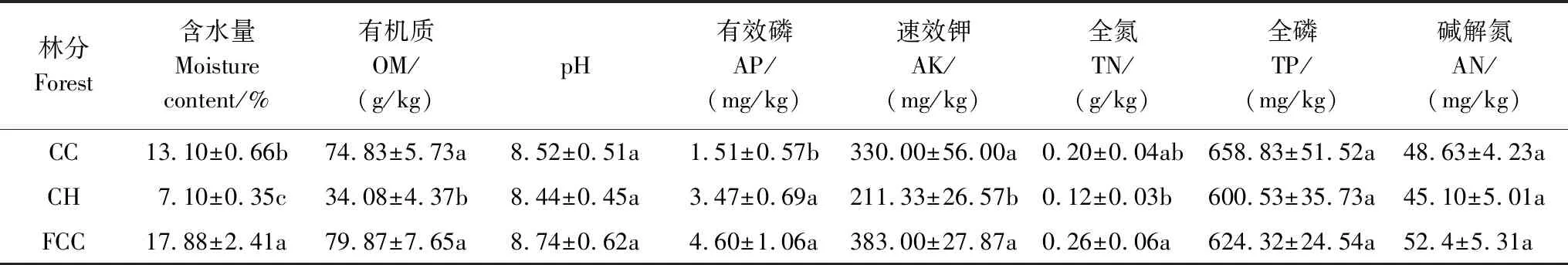
表1 不同林分土壤理化性质
同列不同小写字母表示处理间差异显著 (P<0.05);CC: 刺槐纯林Robiniapseudoacacia;CH: 臭椿纯林Ailanthusaltissima;FCC:Robiniapseudoacacia×Ailanthusaltissima; OM: Organic Matter;AP: Available Phosphorus;AK: Available Kalium;TN: Total Nitrogen;TP: Total Phosphorus;AN: Available Nitrogen
2.2 测序数据分析
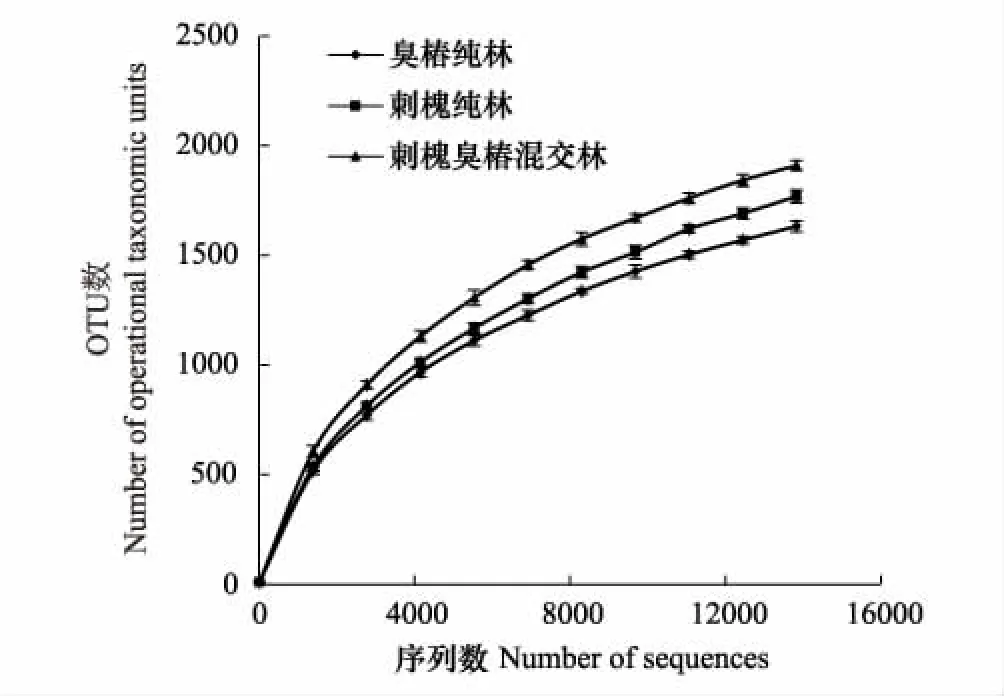
图1 细菌稀释曲线分析Fig.1 Rarefaction curve analysis of OTUs
通过高通量测序,从臭椿纯林、刺槐纯林、刺槐臭椿混交林3种土壤样品中分别获得26316、31281、38657条原始序列(Raw Tags),过滤掉低质量的序列后,有效序列(Effective Tags)条数分别为25949、30964、37911。采用随机抽样法,将这些序列在97%相似度上进行聚类,形成用于物种分类的OTU。由图1可知,OTU数随序列的增加而增加,不同林分之间的OTU数按下列顺序递减:刺槐臭椿混交林>刺槐纯林>臭椿纯林,且其差异均达5%显著水平。3种林分细菌稀释曲线随OTU数增大基本趋于平缓,但未达到饱和。更多的测序数据对发现新的OTU贡献率较小,表明测序数据合理。
2.3 门水平上土壤细菌群落结构相对丰度分析
在门水平上,3种林分土壤共检测出31门细菌,其中臭椿纯林、刺槐纯林、刺槐臭椿混交林土壤分别检测出27、25、31门细菌。酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、硝化螺旋菌门(Nitrospirae)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、芽单胞菌门(Gemmatimonadetes)、疣微菌门(Verrucomicrobia)8种细菌在3种林分土壤中相对丰度均超过1%。除这8种细菌以外,在刺槐臭椿混交林土壤中拟杆菌门(Bacteroidetes)的相对丰度也超过1%。其中臭椿纯林土壤中变形菌门细菌相对丰度最高,比例为35.3%,其细菌相对丰度显著高于其他两种林分土壤中的丰度。臭椿纯林、刺槐纯林和混交林土壤中酸杆菌门细菌的丰度分别为20.4%、25.2%、27.6%,其中混交林土壤中酸杆菌门细菌相对丰度显著高于臭椿纯林(P< 0.05)。研究发现拟杆菌门相对丰度仅在臭椿刺槐混交林中超过1%,其丰度为1.02%,在其他两种林分土壤丰度中分别为0.61%、0.81%。由图2可知,臭椿纯林、刺槐纯林土壤有酸杆菌门、变形菌门、放线菌门、硝化螺旋菌门4种优势细菌群落(群落丰度>10% 为优势菌落),而臭椿刺槐混交林土壤则只有3种优势细菌(酸杆菌门、变形菌门、放线菌门);硝化螺旋菌门不是混交林土壤中的优势种,丰度仅为6.45%,其在刺槐纯林和臭椿纯林2种纯林土壤中丰度分别为11.6%、11.9%。此外,刺槐臭椿混交林中还有两个特有的门SBR1093和PAUC34f。
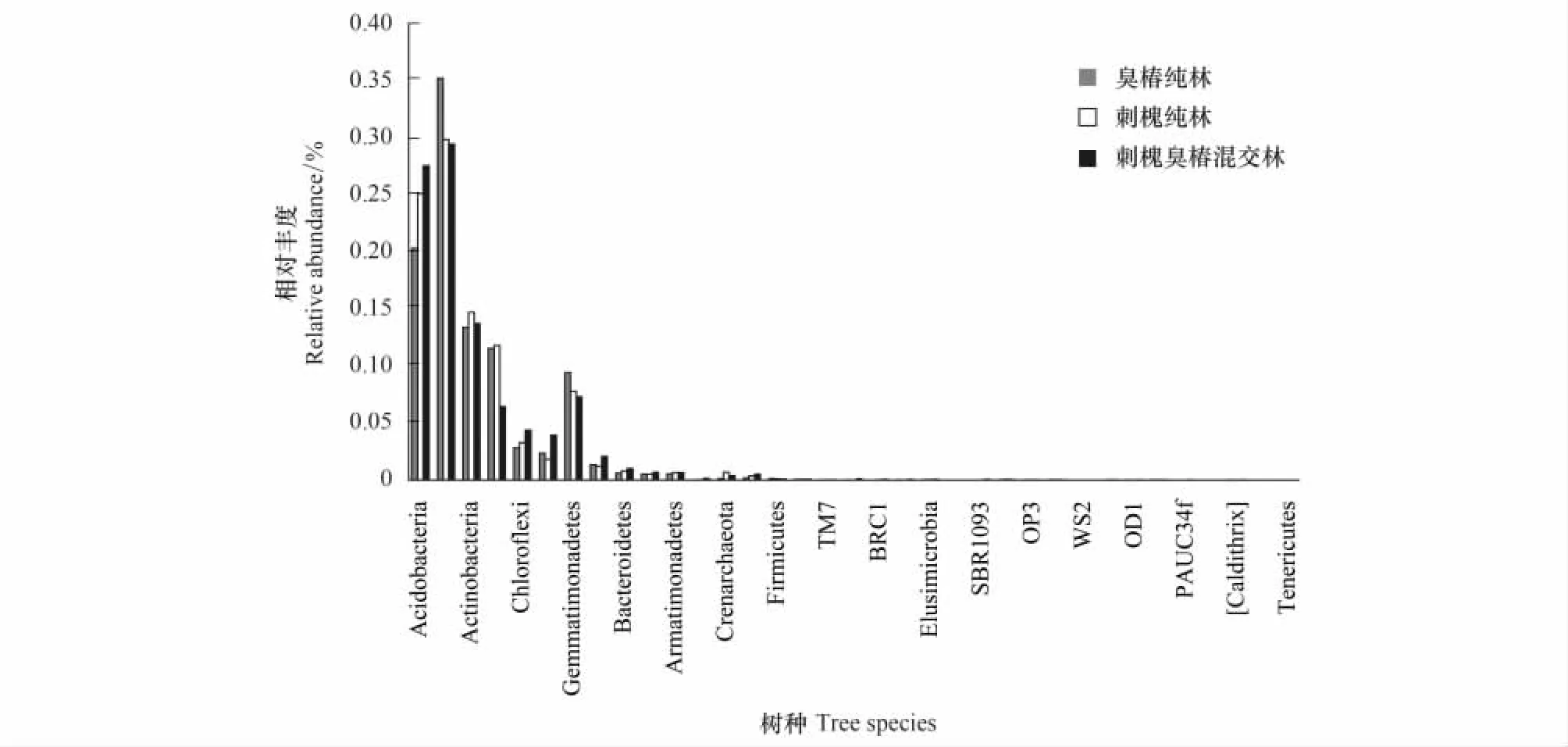
图2 门水平土壤细菌群落结构Fig.2 Soil bacterial community on the phylum level Acidobacteria:酸杆菌门,Proteobacteria:变形菌门,Actinobacteria:放线菌门,Nitrospirae:硝化螺旋菌门,Chloroflexi:绿弯菌门,Planctomycetes:浮霉菌门,Gemmatimonadetes:芽单胞菌门,Verrucomicrobia:疣微菌门,Bacteroidetes:拟杆菌门,Armatimonadetes:装甲菌门,Cyanobacteria:蓝细菌门,Crenarchaeota:泉古菌门,Euryarchaeota:古生菌门,Firmicutes:厚壁菌门,Chlorobi:绿菌门,Elusimicrobia:迷踪菌门,Fibrobacteres:纤维杆菌门,Fusobacteria:梭杆菌门,Caldithrix:蓝藻门,Tenericutes:柔膜菌门,(WS3,TM7,WYO,BRC1,NKB19,Thermi,SBR1093,GAL15,OP3,WS2,OD1,TM6,PAUC34f,NC10,WPS-2)未定菌,Others:其他
2.4 细菌多样性指数
刺槐臭椿混交林的物种数、Chao1指数、Shannon指数分别为1910.0、2419.0、9.1(表2),其中刺槐臭椿混交林的物种数显著高于刺槐纯林和臭椿纯林,且物种数在2种纯林种也表现出显著差异(P< 0.05)。刺槐纯林的Chao1指数为2526.6,显著高于臭椿纯林和刺槐臭椿混交林(P< 0.05),但Chao1指数在臭椿纯林和混交林中无显著差异。3种不同林分土壤的Shannon指数无显著差异。
2.5 细菌群落与土壤理化性质主成分分析
以土壤理化性质数据作为土壤环境变量,3种不同林分细菌群落在门水平上相对丰度大于1%的8种细菌门类相对丰度数据作为物种数据进行主成分分析,结果如图3A所示,第1主成分(PC1)解释了细菌群落变化的75.79%,第2主成分(PC2)解释了24.21%,在第1主成分轴上含水量、全氮含量贡献较大,在第2主成分轴上有效磷含量、pH与混交林土壤细菌高度相关。图3B表示,3种不同林分之间土壤细菌群落结构差异显著,有较高程度的分离,与臭椿纯林相关性较强的是变形菌门、芽单胞菌门;与刺槐纯林相关性较强的是放线菌门、硝化螺旋菌门;与混交林相关性较强的是酸杆菌门、绿弯菌门、浮霉菌门、疣微菌门。

表2 不同林分土壤中细菌群落多样性分析
同一行标注不同小写字母的数据表示处理间存在显著差异(P<0.05)
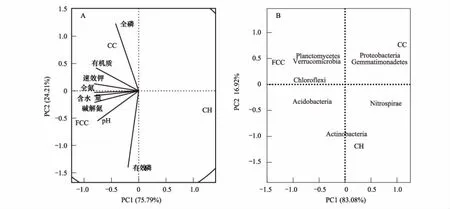
图3 主要细菌群落与土壤理化性质主成分分析Fig.3 Principal component analysis of main bacterial communities and soil physical and chemical properties CC: 刺槐纯林Robinia pseudoacacia;CH: 臭椿纯林Ailanthus altissima;FCC: Robinia pseudoacacia×Ailanthus altissima;
3 讨论
3.1 不同林分类型对土壤细菌结构及多样性的影响
一般来说陆地生态系统可分为地上和地下两部分。地下的土壤生态系统中的土壤细菌在驱动物质循环和能量交换过程而作用于地上生态系统的同时,自身也受到地上生态系统的影响,其中植物对土壤细菌群落多样性的影响显得尤为突出[21]。植被是土壤细菌赖以生存的有机营养物和能量的重要来源,植被通过影响土壤有机碳和氮的水平、土壤含水量、及pH值等来影响土壤细菌多样性[22]。植物地下部分的根系会产生各种分泌物,能形成特殊的根际环境。Kourtev等[23]研究表明,通常外来植物取代土著植物后会改变根系对土壤的营养物质输入,从而影响土壤细菌的结构与功能。因此,不同树种的混交实际上是改变了植物的类型,许多研究[24-25]表明,混交林可较好地促进土壤细菌的生长并丰富其多样性。本试验研究发现,刺槐臭椿混交林及其纯林因林分类型不同,土壤细菌群落的组成和结构也不同。其中刺槐臭椿混交林土壤中检测出31门细菌,而臭椿纯林、刺槐纯林土壤中分别只有27、25门细菌,刺槐臭椿混交林土壤中拟杆菌门(Bacteroidetes)细菌是相对丰度超过1%的主要细菌群落,而在两种纯林土壤中拟杆菌门则不是主要细菌群落,说明刺槐臭椿混交后不仅使土壤细菌组成更丰富,土壤中细菌丰度也有提高。很多研究表明森林土壤细菌群落组成是由主要树种决定的[26-27],对针阔混交林的研究发现针阔混交林的土壤微生物结构与针叶林和阔叶林均有明显区别。罗达等[28]的研究也表明:与纯林相比,南亚热带乡土树种营造的人工混交林可提高土壤生态系统的稳定性,增加土壤细菌种类。王凌云等[29]在研究马尾松纯林与枫香木荷混交林土壤微生态环境差异时发现,香枫木荷混交林在改善土壤细菌生存环境方面有更明显效果。造成这种现象的原因可能是在门水平上,土壤细菌群落结构的变化受到自身细菌生长速率等因素的驱动[30],另外混交林相比纯林有更为丰富和多样的植物凋落物,提高了土壤保水能力,使得土壤环境和营养条件得以改善,加快细菌生长为土壤细菌数量的增加和群落结构的丰富创造了条件[31]。不同林分类型,在凋落物数量和质量、土壤有机质含量以及土壤含水量等方面会有较大差异,这些差异会影响到土壤细菌的生存环境,从而影响到土壤细菌种类、数量、组成和分布等[32]。从前人的研究成果和本文的研究结果来看,与相应的纯林比较,混交林能改变土壤细菌的结构,提高土壤细菌的多样性,为土壤功能的恢复奠定基础。植物与土壤细菌群落的关系是复杂的,是各种影响因素综合作用的结果,植物与土壤细菌之间的相互作用推动着由它们共同组成的生态系统功能的变化[33]。因此应加强土壤微生物功能多样性与植被之间的关系研究,使其发挥更大的生产和生态作用。
3.2 土壤理化性质对土壤细菌多样性的影响
土壤细菌的生存和繁衍需要一定的环境条件。土壤水分是土壤细菌所需的最基本条件,参与土壤细菌的各种的代谢活动[34],较好的土壤水分条件可为细菌的生长繁殖提供更为优越的条件。吴俐莎等[35]研究表明,土壤含水量减少, 不利于细菌生长, 细菌数量会减少。本研究中,刺槐臭椿混交林土壤含水量显著高于纯林,3种林分土壤含水量呈刺槐臭椿混交林>臭椿纯林和>刺槐纯林,表明树种混交增加了土壤含水量,这可能也是混交林土壤中细菌物种数高于纯林的原因之一。本研究相关性分析也表明土壤含水量与物种数和Shannon指数呈正相关,说明土壤含水量对土壤细菌群落多样性有一定影响,与安韶山等[36]和区余端等[37]的研究结果相似。
刺槐臭椿混交林有机质含量显著高于刺槐纯林,土壤中细菌多样性和丰富度也高于相应的纯林。邓娇娇等[38]研究也发现混交林土壤有机质含量比纯林高,同时混交林土壤细菌的多样性和丰富度也较纯林高。这可能是土壤中的有机质可直接为土壤细菌提供生长所需的营养。Tóth等[39]研究证实,有机质含量的高低能对土壤细菌群落的结构和组成产生影响。
土壤中磷也是土壤细菌的重要营养来源,磷元素的多少也影响土壤细菌在土壤中生存和繁殖。唐宏亮等[40]研究磷供应对玉米根际微生物的影响时发现当土壤含磷量较高时,可增加土壤微生物的代谢,提高土壤微生物的多样性。本试验中,刺槐臭椿混交林有效磷含量显著高于臭椿纯林,与土壤细菌物种数呈正相关,表明土壤有效磷含量变化会引起土壤细菌群落变化。李亚娟等[41]研究发现当土壤中的磷元素大部分以迟效性状态存在时,并不能很好地为土壤生物所利用,因此土壤全磷含量有时不能作为土壤磷素供应的指标。所以在研究磷素对土壤细菌的影响时,应综合考虑土壤中全磷和有效磷两种形式(杨菁等[42])。
细菌的多样性高低不仅和物种数量有关,还与物种分布的均匀程度有关。在计算刺槐纯林、臭椿纯林和刺槐臭椿混交林细菌多样性时,刺槐林的Chao 1指数高于其他两种林分,物种数又低于其他两种林分,这可能与刺槐林分中土壤细菌分布较为均匀有关,因而多样性也稍高于另外两种林分。
本文以黄河三角洲刺槐臭椿混交林及其纯林作为研究对象,探究混交对土壤细菌群落的影响,通过运用高通量测序技术,更准确地分析刺槐和臭椿混交对土壤细菌群落影响。本研究发现刺槐臭椿混交改善了土壤理化性质,提高了土壤细菌多样性,说明混交栽培较相应的纯林有一定的优势,因此在黄河三角洲地区应提倡栽培具有耐盐性树种组成的混交林,以提高林分的稳定,使其发挥更好的生态效益和经济效益。
4 结论
酸杆菌门、变形菌门、放线菌门细菌丰度占到了细菌总量的69%—71%,是3种林地的共同优势细菌群落,尤其是在刺槐臭椿混交林中所占比例最高。刺槐臭椿混交林土壤细菌多样性显著高于刺槐纯林和臭椿纯林,混交林丰富了土壤细菌群落。同时,混交增加了物种数量,混交林土壤细菌多样性优于单一树种纯林,土壤理化性质也在一定程度上有所改善尤其是土壤含水量、有效磷含量。
