我省药品生产企业质量控制实验室实施《计算机化系统》附录的调研分析
2019-12-18李乐贾娜
李乐,贾娜
(辽宁省药品认证中心,辽宁 沈阳 110000)
良好的计算机化系统是保证药品生产和质量管理过程中数据准确、可靠,并处于客观真实状态的重要方面[1]。国家食品药品监督管理总局于2015年05月26日正式发布《药品生产质量管理规范(2010年修订)》《计算机化系统》附录,自2015年12月1日起施行[2],附录共5章24条,对计算机化系统涉及的数据管理提出了明确要求。从近年检查情况看,国内药品生产企业数据管理的规范性问题仍旧突出,多集中在质量控制实验室的数据管理方面,且计算机化系统等附录的实施情况与法规要求存在一定差距,发现的问题较多[3-4]。
为了解掌握我省药品生产企业《计算机化系统》附录实施情况,评估企业数据可靠性风险、促使企业进一步提升数据管理水平,我中心对省内药品生产企业质量控制实验室的《计算机化系统》附录实施情况开展了调研。
1 调研基本情况
本调研采取问卷的方式,共涉及40家药品生产企业,其中口服固体制剂生产企业30家、无菌制剂生产企业7家、原料药生产企业2家、外用制剂生产企业1家。调研内容主要包括企业是否完成计算机化系统验证、QC化验室仪器配备审计跟踪功能比例情况、批放行前是否对审计跟踪内容进行审核、仪器使用是否可追溯、权限分级管理情况、手动积分及多次进样是否有sop支持、系统时间是否锁定、数据备份方式、计算机化系统文件制定等。
2 调研结果
2.1 计算机化系统验证工作的完成情况
药品生产与质量管理所使用的计算化系统,要求设备必须进行必要的检查、校准和验证,并使验证活动得以持续,确保其工作性能安全稳定。在调研的40家企业中,15家企业已完成计算机化系统验证工作,完成比例为37.5%。已完成计算机化系统验证的15家企业中,自主完成验证工作的企业9家,由第三方完成验证工作的企业6家。
2.2 审计跟踪
企业应根据风险评估的结果,考虑在系统中建立数据审计跟踪系统,用于记录数据的输入和修改,及系统的使用和变更[5]。从调研结果来看,色谱系统由于数据的生成处理复杂、数据管理难度大,数据可靠性风险相对较高[6],配备审计跟踪功能的比例也是最高的。
以液相色谱系统调研数据为例,在调研的40家企业中,24家企业所有液相色谱系统均具有审计跟踪功能,12家企业部分液相色谱系统具备审计跟踪功能,仅4家企业液相色谱系统无审计跟踪功能,具体调研数据见表1。此外,仪器系统配备审计跟踪功能的企业中有27家(73%)在批放行前对审计跟踪内容进行审核。
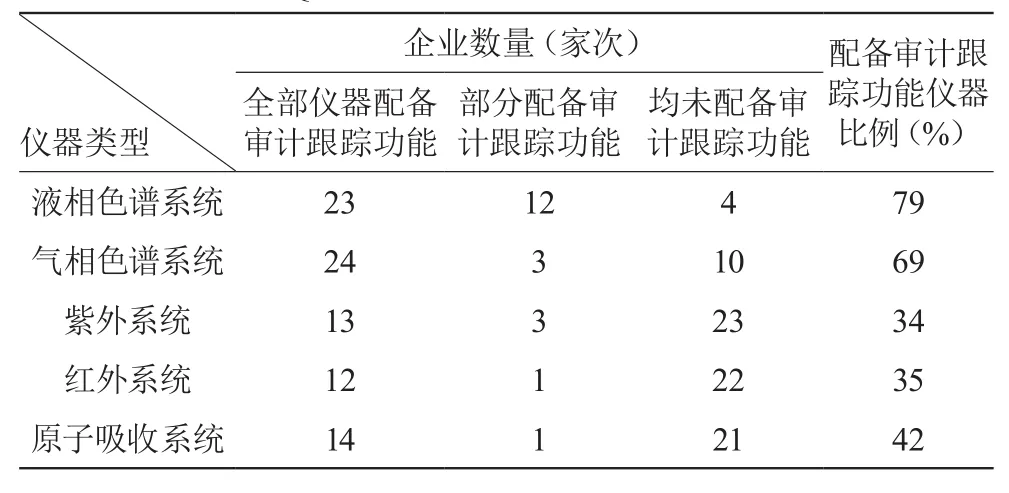
表1 调研企业QC化验室仪器配备“审计跟踪”功能统计
2.3 账户管理及权限控制
计算机化系统账户管理的核心在于访问控制,而独立账户和密码是实现访问控制的主要方式。在用户名和密码控制方面,调研的40家企业中,39家企业对仪器工作站的用户名和密码进行了设置,1家企业仪器工作站未进行密码设置,通过纸质记录进行追溯。企业基本能够做到独立账户,但年度跟踪检查发现有个别企业存在共用液相色谱工作站用户名和密码的情况。
权限控制的途径主要是账户分级和权限分配,操作过程中保证用户角色与账户权限的一致性。账户分级要求赋予管理员和操作人员相应的访问层级,权限分配要求对每一层极账户分配恰当的权限,保证用户角色和账户权限的一致性[7]。调研发现,31家(77%)企业将账户分为三级、4家(10%)企业将账户分为四级、3家(8%)企业将账户分为二级、2家(5%)企业尚未对账户进行分级管理,具体情况如图1所示。
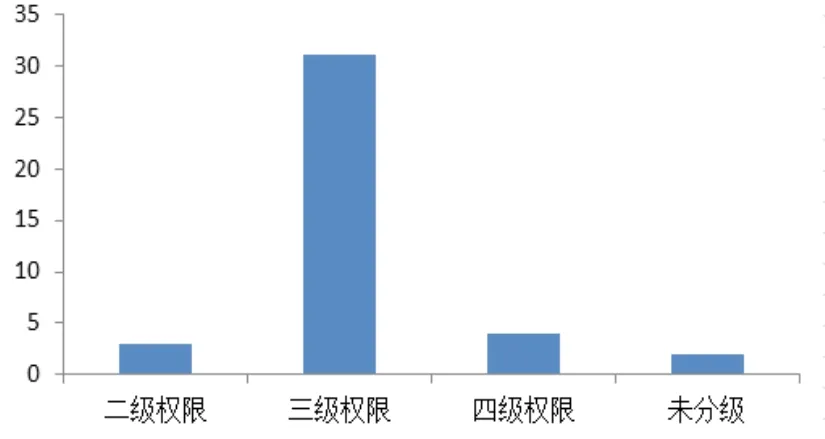
图1 账户分级管理统计
虽然绝大部分企业均根据计算机化系统附录要求对系统进行分级管理,但年度跟踪检查发现企业普遍对权限分配的合理性关注较少,如:某企业不同检验员的试验图谱数据可以相互查看修改;某企业技术部(研发部门)与化验室共用Chromelen7网络版色谱工作站,研发人员与QC人员能够互相访问对方色谱数据;某企业QC实验室红外光谱仪的一级管理员(拥有最高权限)被分配了基础红外解析、定量分析等权限,但实际工作中并不需要,而二级管理员无法直接调阅图谱进行审核等。
2.4 系统时间
电子数据生成的时间均以电脑系统时间作为时间戳,因此准确的电脑时间及修改权限的锁定是保证数据可靠性的前提。在调研的40家企业中,36家(90%)企业的系统时间已锁定,但年度跟踪检查发现部分企业所使用的仪器系统未锁定系统时间并可以修改。
2.5 数据存储与备份
数据备份应考虑备份方法、备份介质和备份周期。调研的企业目前采用的备份介质有移动硬盘、光盘、服务器、专用电脑等,其中采用移动硬盘备份的企业有32家(80%)、采用光盘备份的2家(5%)、采用服务器及专用电脑备份的1家(2.5%)。
在选择数据备份周期方面,按月备份数据的企业有25家,占62%,选择其他备份周期有每日备份、每周备份、每10天备份、每季度备份、每半年备份、每批备份等。调研发现有个别企业存在未进行数据备份或将工作站数据存于同一电脑不同文件夹的情况。
2.6 手动积分与多次进样
规范操作是保证数据可靠性的前提。自动积分的积分参数批内应保持一致,修改应经过审批;手动积分权限应进行控制,积分结果应经过复核。调研的40家企业中,仅16家(40%)企业对手动积分操作有明确规定。
“检测至符合规定”的操作是不科学和不被允许的。一个样品复验的最多次数应事先在书面的SOP中明确规定[8]。采集的色谱图和数据结果不允许删除,出现偏差或者检查结果异常应及时记录并进行调查。调研发现:5家(13%)企业明确记录多次进针目的是为了检测系统适应性等同时选择性使用数据过程能够留有记录,并启动偏差处理;24家(60%)企业明确记录多次进针的目的是为了检测系统适应性等,但选择性使用数据过程未制定相关SOP;5家(13%)企业选择性使用数据过程留有记录并启动偏差调查,但试针行为未制定相关的SOP;6家(15%)企业选择性使用数据过程及试针行为均未制定相关SOP。
2.7 文件制定情况
通过汇总、统计企业制定的计算机化系统相关制度文件发现,企业缺失的文件主要集中在计算机化系统变更操作规程与记录、系统应急方案、系统故障/损坏的操作规程及记录等方面,说明企业对系统变更及安全工作关注不多,目前阶段更关注软硬件的升级和配置等方面。文件制定情况见图2。
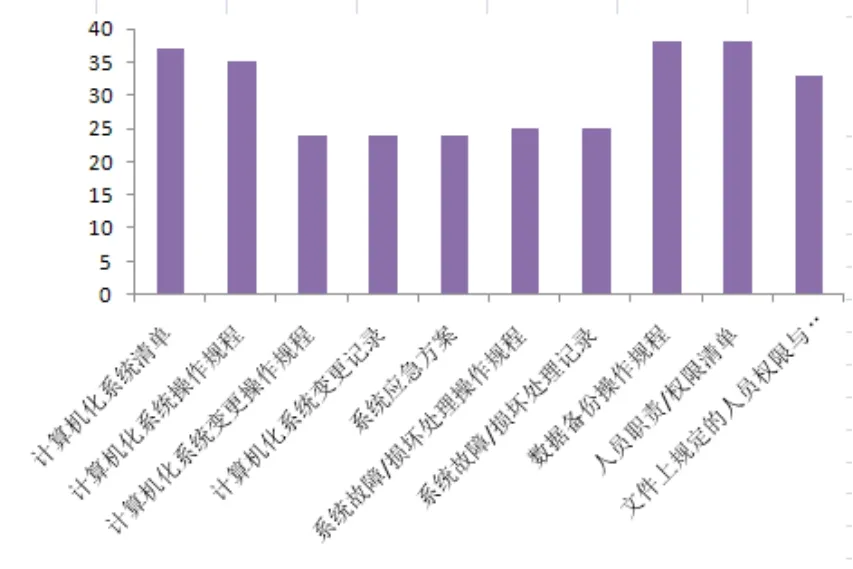
图2 制度文件制定情况
此外,现场检查时需要关注文件制度和执行2层皮的情况,年度跟踪检查发现某企业制定了计算机系统操作权限管理规程,其中规定一级人员无法修改参数或删除数据,但实际工作中企业液相操作人员(一级人员)可以按正常计算要求保存原始图谱后修删杂质峰进行计算,审计追踪有记录,但未记录更改理由。
3 分析与建议
通过调研发现,企业对于《计算机化系统》附录的理解和执行情况参差不齐,部分企业将计算机化系统视为一台普通的设备或系统,仅仅按照GMP的要求进行IQ、OQ和PQ,验证深度和广度均严重不足,计算机化系统具有自身特殊性,企业应着重完善系统软件的确认工作。
企业应从确保数据可靠性的角度出发,基于科学的风险分析评估管理,合理设置用户权限、并对各类权限进行确认与测试、进行挑战性测试,如:数据安全性确认、审计跟踪功能的确认、断网断电功能的确认、执行科学的数据备份及还原的方式等,进一步保证所产生数据的完整、可靠、可追溯,为生产和质量管理提供依据。
监管机构应准确把握法规要求,通过培训、检查、调研等方式,增进数据可靠性管理的共识,推动计算机化系统附录实施的进一步完善;充分利用检查数据,及时发现监管风险,汇总、分析检查缺陷项并进行风险评估,将共性问题纳入跟踪检查方案重点关注,降低系统性缺陷发生的概率;重点关注系统权限管理、审计跟踪功能配备、制度文件建立及完善等现阶段发现比较多的共性问题,督促企业尽快提升。
