US-CT/MRI融合成像在肝癌患者超声引导下射频消融治疗中的应用价值分析
2019-12-18河南科技大学临床医学院河南科技大学第一附属医院超声科河南洛阳471003
1.河南科技大学临床医学院(河南科技大学第一附属医院)超声科(河南 洛阳 471003)
2.河南科技大学临床医学院(河南科技大学第一附属医院)介入科(河南 洛阳 471003)
3.河南科技大学临床医学院(河南科技大学第一附属医院)影像科(河南 洛阳 471003)
薛 静1 杜廷伟2 王运昌1张周龙1 姚俊东1 刘 冰3
肝癌是我国第二大恶性肿瘤,仅次于肺癌[1]。手术治疗仍是目前肝癌治疗的主要手段,但不少患者就诊时已属中晚期,伴明显肝硬化,错失最佳手术时机,需采取非手术治疗。射频消融术(radiofrequency ablation,RFA)有着微创、疗效显著等优点,成为治疗肝癌的重要手段[2]。RFA治疗肝癌需在影像学引导下进行,超声(US)因可实时引导、简便、经济、安全等优点,成为经皮肝癌消融治疗首选的影像引导方法[3]。然而,与CT、MRI相比,超声对于肝脏肿瘤的显示能力较差,易受病灶大小、部位、背景回声等因素影响,部分病灶显示困难,从而影响消融治疗的顺利进行[4]。此外,部分病灶常规超声显示困难,即便顺利进行RFA术也难以判断消融是否完全。故对于常规超声显示困难的肝癌病灶,不适合在超声引导下行RFA。近年出现的US-CT/MRI融合成像技术,将超声的实时引导与CT/MRI的高分辨率的优势进行了结合,弥补了常规超声的不足,为超声显示困难的肝癌病灶行超声引导下RFA术及疗效评价提供了可能[5]。本研究旨在探讨US-CT/MRI融合成像在肝癌患者超声引导下RFA治疗中的应用价值,现报告如下。
1 资料与方法
1.1 研究对象 收集2017年1月至2018年12月在我院拟行超声引导下RFA术的肝癌患者86例(96个病灶),均取得穿刺活检病理证实,或肝增强CT/MRI有典型恶性肿瘤征象,且符合肝肿瘤RFA适应症者[6]。根据常规超声能否清晰显示病灶,将患者分为两组:超声显示困难组34例(38个病灶)和超声显示清晰组52例(58个病灶),两组基本情况对比无统计学差异(P>0.05,表1)。本研究获得伦理委员会批准,所有患者均对研究知情并签署同意书。
1.2 仪器与方法
1.2.1 仪器:采用GE LOGE9超声诊断仪,凸阵探头(频率为1~5MHz),配置虚拟导航系统和磁定位器等相关组件。RFA设备采用美国RTC公司RF2000射频消融仪及冷循环电极针。超声造影剂采用声诺维(Bracco公司)。CT设备采用GE lightspeed VCT64D多排螺旋CT;MR设备采用西门子Siemens 3.0TIM Trio MR扫描仪。
1.2.2 方法:RFA术前定位:对于常规超声显示困难的病灶,于US-CT/MRI融合成像下明确病灶部位和范围,具体为:选择可清晰显示病灶和肝内血管的CT/MRI序列,将其DICOM格式图像导入超声诊断仪内,应用内定标法中的一面一点法进行图像对位融合,融合匹配超声图像和CT/MRI图像。完成融合匹配后,超声图像和CT/MRI图像可在空间上实时对位显示,参照CT/MRI图像,在超声实时图像上描记病灶位置、范围,并通过超声造影检查进一步确认病灶信息。如果图像融合匹配未取得成功或即便成功仍不能清楚显示病灶,则将其剔除。
超声显示困难组:应用USCT/MRI融合成像明确病灶位置、范围之后,若常规超声可辨别病灶,则于常规超声引导下行RFA治疗,否则在US-CT/MRI融合成像引导下行RFA治疗,遵照单针单次或者数次消融之策略,以实现肿瘤的完全覆盖。RFA术后即时于融合成像下进行超声造影,以判断消融区是否将原病灶完全覆盖。
超声显示清楚组:于常规超声引导下行RFA术,术后即时予以超声造影,以判断消融区是否将原病灶完全覆盖。
根据术前设计实施、完成消融治疗后,术中即时进行疗效评估,若消融区将原病灶完全覆盖,则结束治疗,若原病灶未被完全覆盖,则补充消融,直至原病灶完全覆盖,做好记录。
1.3 术后疗效评估 所有患者均于术后1个月复查增强US-CT/MRI、肝功能等,判断肝肿瘤是否完全消融。消融不完全:增强US-CT/MRI检查提示局部残留有肿瘤;消融完全:增强US-CT/MRI检查显示肿瘤完全消融。
1.4 统计学处理 使用SPSS20.0软件处理数据。定量资料描述为(±s),组间对比用独立样本t检验;定性资料描述为例(%),用χ2检验或Fisher精确概率检验;以双侧P<0.05为差异有统计学意义。
2 结 果
超声显示困难组:34例患者(38个病灶),均获得病灶对位成功,其中18个病灶采取CT对位,20个病灶采取MRI对位,图像对位时间4~14(5.7±2.5)min。于USCT/MRI融合成像下,2个病灶仍未能清晰显示,其中1个病灶部位在隔顶为肺气所遮挡,1个病灶对应位置显示等回声,超声造影亦未能明确呈现异常灌注的病灶,此2个病灶(2例患者)最终被剔除,US-CT/MRI融合成像病灶定位成功率为94.74%(36/38)。最终,仅32例患者(36个病灶)于US-CT/MRI融合成像下完成RFA术。
超声显示困难组36个病灶中,其中19个于常规超声引导下进行穿刺,9个于导航引导下进行穿刺,8个于超声造影下进行穿刺。病灶RFA术后,即时超声造影发现,12个病灶未取得完全消融,经过补充消融最终实现病灶完全覆盖,补充消融率为33.33%(12/36)。术后1个月复查,仍有2个病灶未获得完全消融。
超声显示清楚组52例患者(58个病灶)经RFA术,术中即时超声造影发现,5个病灶未完全覆盖,经补充消融,均获得完全消融,补充消融率为8.62%(5/58)。术后1个月复查,仍有1个病灶未取得完全消融。

表1 两组基本情况对比
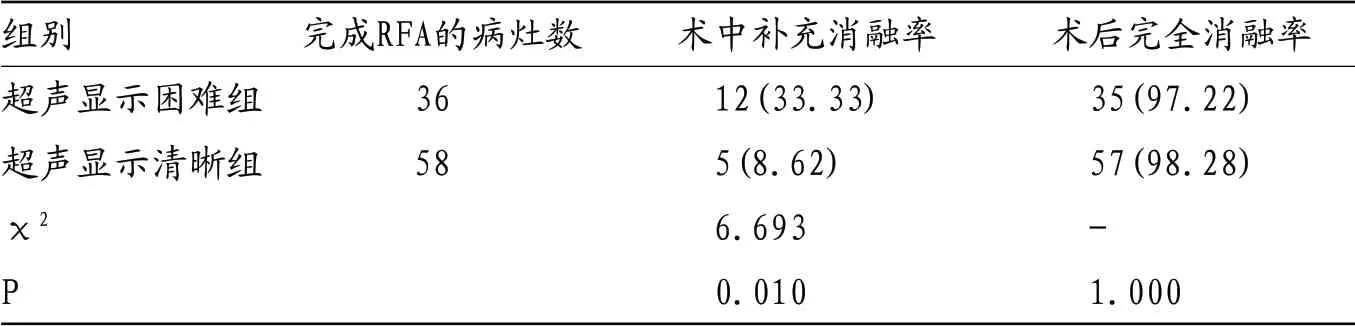
表2 两组术中补充消融率及术后完全消融率对比

图1-6 患者,女,原发性肝癌,行RFA治疗。图1 术前常规超声无法清晰显示目标病灶;图2 术前CT图像显示病灶处在S8(如红色箭头所示);图3-4 US-CT融合成像,根据CT图像病灶标记位置,系统自动显示US图像相应虚拟部位(绿色标记);图5 US-CT融合图像引导下行RFA治疗;图6 术后1个月增强CT复查显示消融完全(绿色箭头)。
超声显示困难组术中补充消融率明显高于超声显示清晰组(P<0.05),两组术后完全消融率对比无统计学差异(P>0.05)。见表2。两组术中均无相关并发症。术前22例甲胎蛋白升高者(≥20ng/ml),术后1个月甲胎蛋白水平均恢复正常。典型病例,见图1-6。
3 讨 论
超声引导下RFA术以其可实时引导、简便、安全、疗效显著等优点,逐渐成为医生及患者青睐的肝癌治疗手段。然而,常规超声检测肝脏病灶的敏感度、特异度均较低,即便是经验丰富的医师也仅能探测到不超过80%的直径在1cm左右的病灶,因而对于部分病灶显示困难[7]。国内研究报道,常规超声仅可探测57%的病灶[8]。常规超声难以清楚显示部分肝癌病灶可能与以下原因有关:肝硬化背景致使肝内回声杂乱,使得病灶显示不清晰;病灶处在隔顶,易为气体或肋骨所遮挡;病灶呈现等回声,和周围肝组织不存在明显差别;病灶直径太小,这些因素均可能导致丧失行RFA治疗的机会。
US-CT/MRI融合成像将超声可实时引导的特性和CT/MRI的高分辨率进行了组合,有效提高常规超声对病灶的显示能力,对疑难病灶的检出有着明显优势。研究报道,对于常规超声无法显示的肝脏病灶,US-CT/MRI融合成像的检出率达78.7%,明显高于常规超声造影的36.2%[9]。本研究显示,US-CT/MRI融合成像下病灶成功定位率为94.74%(36/38),与既往报道[10]接近。US-CT/MRI融合成像充分发挥了超声与CT/MRI两类影像手段的优势,使病灶检出率得到提高,并可提供更为丰富的病灶信息,有助于病灶定位,为常规超声显示困难的肝脏病灶行超声引导下RFA治疗创造了可能。
近些年来,US-CT/MRI融合成像在超声显示困难的肝脏病灶治疗上已取得初步应用。既往研究不仅表明US-CT/MRI融合成像不仅能够提高常规超声显示困难病灶的检出率,且体现出融合成像在肝癌RFA术中引导和术后疗效评估上的重要价值[11]。故本研究针对超声显示困难的病灶,应用融合成像技术引导下行RFA,既提高了对于此类病灶的显示能力,又很好地对病灶是否获得完全消融进行了疗效评估。RFA术后,肝脏病灶常显得模糊不清,常规超声难以判断原发灶是否完全被覆盖,尤其是常规超声显示困难的病灶,即时评估的困难程度更大,而应用融合成像在RFA术后仍可较准确地判断病灶所处位置和范围,利用超声造影可对病灶是否取得完全覆盖加以判断。故本研究中超声显示困难组的术后完全消融率与超声显示清晰组无明显差异。此外,常规超声显示困难病灶应用融合成像技术,可更精确地判断消融范围,故术中常需进行补充消融来追求病灶的完全覆盖。在本研究中,共2例(2个病灶)术后1个月时病灶未获得完全消融,1例属于超声显示困难组,其术中即时评估显示病灶完全覆盖,但可能由于图像匹配过程中存在误差,使得病灶边缘未能完全消融;1例属于超声显示清楚组,该病灶与血管相邻,可能与消融范围受限制有关。
综上所述,US-CT/MRI融合成像不但可提高常规超声显示困难肝癌病灶的检出率,还能够在RFA治疗中引导消融和进行即时疗效评价,获得与超声显示清楚病灶相当的术后消融效果,有望成为肝癌消融治疗的重要影像学引导手段,应用前景良好。
