芽孢杆菌BLy的鉴定及抑菌活性物质特性
2019-12-17叶生梅程其国
叶生梅,严 航,程其国
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
世界卫生组织发表文章呼吁应对全球耐药感染问题,并援引英国经济学家吉姆·奥尼尔(JimOnell)爵士发表的《全球抗菌素耐药回顾》报告及建议指出,到2050年,抗菌素耐药每年会导致1 000万人死亡。如果任其发展,可累计造成100万亿美元的经济损失。当前,所有的常规抗生素都出现了相应的抗药性致病株系,致病菌的抗药性问题已经日益严重地威胁着人们的健康。寻找和开发无毒、无副作用的新型抗菌物质是解决致病菌抗药性问题的一条有效途径[1-4],而芽孢杆菌,特别是枯草芽孢杆菌、地衣芽孢杆菌是一种在土壤和环境中常见的细菌,营养要求低,繁殖力强,能形成芽孢,抗逆性强;它们能够调节动物微生态平衡、促进肠道有益菌生长、降低病原菌的数量,从而增加动物机体的抗病力和提高机体的免疫功能[5-6]。研究表明,芽孢杆菌能够产生多种生物活性物质,包括蛋白酶、淀粉酶、抗菌蛋白、抗菌多肽类物质和一些小分子活性物质等,因此芽孢杆菌成为人们高度重视和研究的一类微生物[7-10]。
实验室筛选到一株芽孢杆菌BLy,其对金黄色葡萄球菌具有显著抑制作用。对菌株BLy进行鉴定,并研究抑菌物质的抗菌谱和有关性质,为进一步研究其抑菌物质的组成、结构及抑菌机理等奠定基础。
1 材料与方法
1.1 菌种
供试菌株:芽孢杆菌BLy(BacillusBLy),安徽工程大学微生物实验室保藏。
抗菌活性测定指示菌:大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis)、酵母菌(Saccharomycescerevisiae)、红酵母(Rhodotorulasp.)、毛霉菌(Mucorsp.)、根霉菌(Rhizopussp.)、青霉菌(Penicilliumsp.)、黑曲霉(Aspergillusniger)等,均由安徽工程大学微生物实验室保藏。
1.2 试剂及仪器
试剂:酵母膏和蛋白胨(Oxoid公司);TaqDNA聚合酶、dNTP(TaKaRa公司);胰蛋白酶1∶250(猪胰)(沪试);枯草杆菌蛋白酶10万 U/g(MACKLIN);蛋白酶K 20 mg/mL Solution(SANGON.COM);葡聚糖凝胶G75(Sephadex G-75);其他试剂均为国产分析纯。
仪器:S1000PCR仪(BIO-RAD);GDS-8000 System凝胶成像系统(UVP Biolmaging systems);H-1850型台式高速离心机(湖南湘仪实验仪器开发有限公司);DYY-6D型电泳仪(北京六一仪器厂);BM1000生物显微镜(江南永新光学)。
1.3 培养基
LB培养基:蛋白胨10 g,酵母膏5 g,NaCl 10 g,琼脂15~20 g(BL液体培养基不加琼脂),蒸馏水1 000 mL,pH 7.0,用于细菌的保藏和培养。
菌株BLy产抑菌物质发酵培养基LB液体培养基。
PDA培养基:按文献[11]方法配置,用于真菌的保藏和培养。
1.4 菌株BLy的鉴定
(1)BLy的形态、生理生化特性测定。按照文献[12]方法进行形态观察实验(菌落形态、革兰氏染色、芽孢染色)及生理生化试验(接触酶试验、V.P试验、甲基红试验、吲哚试验、硝酸盐还原试验、蛋白质及碳源利用实验等)。
(2)菌株BLy的16SrDNA基因测序及分析。BLy基因组DNA的提取采用文献[11]方法,挑取BLy菌株的一个单菌落放入装有LB液体培养基的试管中于37 ℃振荡培养过夜(12~18 h)。培养液用于基因组DNA提取。16SrDNA基因的PCR扩增引物为通用引(F:AGAGTTTGATCATGGCTCAG;R:TAGGGTTACCTTGTTACGACTT)(上海生工合成),反应体系如下:10×PCR缓冲液2.5 μL;4种dNTP混合物(10 mmol/L)0.5 μL;上游引物(-F)(10 pmol/L)1.0 μL;下游引物(-R)(10 pmol/L)1.0 μL;模板DNA 0.8 μL;TaqDNA聚合酶0.5 μL;无菌去离子水补加18.7 μL至反应体积25.0 μL。PCR反应条件:94 ℃预变性5 min后进入循环,94 ℃变性50s→52 ℃退火50s→72 ℃延伸2 min,共30个循环,最后一个循环为72 ℃延伸10 min。取5 μL反应液1%琼脂糖凝胶电泳检测后,将PCR扩增产物送交到上海生工生物工程股份有限公司进行DNA测序。将测序得到的碱基序列在NCBI核酸序列数据库内进行BLAST序列比对,找出数据库中与该菌株同源性较高的模式菌株。然后利用MEGA 5.1软件对BLy菌株和其同源性菌株进行16SrDNA序列比对,并将比对结果用于系统发育树的构建。
1.5 方法
(1)菌株BLy的种子培养和发酵。活化的BLy斜面菌种一环接种于装有液体LB的三角烧瓶,37 ℃、200 r/min条件下振荡培养12~18 h获得菌株BLy种子液。吸取1 mL种子液转接于装有50 mL LB液体培养基的250 mL三角瓶中,置于37 ℃、200 r/min培养,得发酵液。
(2)菌株Bly产抑菌物质的无菌发酵液的制备。取发酵液于10 000 r/min下,离心10 min,上清液用0.22 μm的微孔过滤器过滤,得到无菌发酵液。
(3)抗菌活性测定指示菌的种子制备。取活化的各细菌菌种一环接种于装有液体LB的三角烧瓶,37 ℃、200 r/min培养12~18 h获得各细菌的种子液。霉菌的种子是孢子数1×105个/mL的孢子悬液。
(4)抗菌活性的测定。采取抑菌圈法[13],取0.1 mL指示菌的种子液于装有20 mL灭菌的冷却到约45 ℃的LB培养基,摇匀后倒入培养皿(直径为9 cm)中,待凝固后利用无菌打孔器在培养基上打孔(直径为5 mm)。吸取BLy的无菌发酵液于平板孔内,以无菌水作为空白对照,每个试样三平行。37 ℃恒温培养箱培养24 h,24 h后观察并记录抑菌圈直径的大小。用PDA培养基同样方法测定抗真菌活性。
1.6 菌株BLy产抑菌物质的发酵过程
每隔2 h取一次BLy发酵液,以600 nm吸光度(OD600 nm)测定菌株的生长曲线。按1.5(2)方法制备无菌发酵液。以金黄色葡萄球菌为指示菌,按1.5(4)抑菌圈法测定抑菌活性与培养时间的关系。
1.7 菌株BLy的抑菌物质的理化性质
(1)温度对BLy抑菌物质活性的影响。将培养12 h的无菌上清液分装于无菌试管中,分别置入50 ℃、80 ℃、100 ℃水浴锅中保温30 min,以不做任何处理无菌上清液为对照。处理后冷却至室温,以金黄色葡萄球菌为指示菌,测量各样液的抑菌活性。
(2)pH对BLy抑菌物质活性的影响。分别用1 mol/L的HCl溶液和1 mol/L的NaOH溶液将发酵液pH分别调为3.0~12.0,将样液室温保存过夜后用1 mol/L的NaOH溶液和1 mol/L的HCl溶液分别将各样液pH值调回至7.0,以金黄色葡萄球菌为指示菌,测量各无菌样液的抑菌圈。
(3)水解酶对BLy抑菌物质活性影响。分别配制胰蛋白酶、枯草杆菌蛋白酶、蛋白酶K,再将各酶液加入到装有无菌上清液的试管中,使酶的终浓度分别是胰蛋白酶250 U/mL,枯草杆菌蛋白酶60 U/mL,蛋白酶K 60 U/mL,置于37 ℃下保温1 h。以未处理的无菌发酵液作为对照,以金黄色葡萄球菌为指示菌,测量各样液的抑菌圈。
1.8 拮抗物质的分离纯化

(2)提取蛋白的色谱柱层析进一步分离。将葡聚糖凝胶G-75(Sephadex G-75)装柱完成后,连接层析系统,用0.9% NaCl溶液作为洗脱液。洗脱液的流速为0.5 mL/min。分部收集洗脱流出液,5 min/管。核酸蛋白检测仪调节为波长280 nm,记录仪走纸速度设为2 mm/min。通过2~3 BV的洗脱液使柱床平衡。待层析柱平衡以后,将盐析分离的混合蛋白质溶液缓慢地加入层析柱上端中央后立即用0.9%的NaCl溶液洗脱,观察记录仪的出峰情况。将出峰相应段的邻试管中的液体合并。将不同峰段对应的蛋白质溶液取出编号,适度的浓缩后,经过0.22 μm的无菌过滤器过滤到无菌管内,吸取20 μL无菌处理液加入同一个接有金黄色葡萄球菌的平皿中做抑菌实验,37 ℃下保温24 h,测量各组分液的抑菌圈大小,对其抑菌活性进行评估,从而得出具有抑菌活性的物质位于哪个组分。
2 结果与分析
2.1 菌株BLy的鉴定
(1)形态和生理生化鉴定。菌株BLy菌落形态及染色观察如图1所示。由图1a可知,菌株BLy菌落表面粗糙,乳白色,不透明,中间略有隆起,菌落边缘向外扩展,不整齐,呈锯齿状。由图1b可知,其液体震荡培养呈浑浊分散状态。该菌株革兰氏染色阳性,杆状,菌体单个或成对排列。由图1c可知,芽孢杆状,近中生,芽孢囊稍膨大。对菌株BLy进行生理生化特性试验结果如表1所示。
从菌落形态、个体染色观察和生理生化特性判断,此菌株与《伯杰氏细菌鉴定手册》(第八版)中的地衣芽孢杆菌比较接近,初步确定菌株BLy为地衣芽孢杆菌。

图1 菌株BLy菌落形态及染色观察

表1 菌株Bly形态学及生理生化特性
注:“+”表示阳性反应;“-”表示阴性反应
(2)菌株BLy 16SrDNA克隆及序列分析。用高渗法制备BLy菌株总DNA后,用制备的BLy菌株总DNA进行16SrDNA的PCR扩增,利用琼脂糖凝胶电泳对PCR扩增产物进行电泳检测,结果表明,PCR扩增产物的片段长度在1 500 bp左右。
将BLy菌株的16SrDNA序列在NCBI核酸序列数据库内进行BLAST同源性序列比对,根据序列比对结果,BLy菌株与地衣芽孢杆菌具有99%的同源性。利用MEGA 5.1软件对所测定的BLy菌株与和它同源性最高的菌种的16SrDNA全序列进行遗传距离计算,并根据遗传距离得到了该菌株的系统发育进化树如图2所示。结合形态特征和生理生化指标,鉴定菌株BLy属于地衣芽孢杆菌。
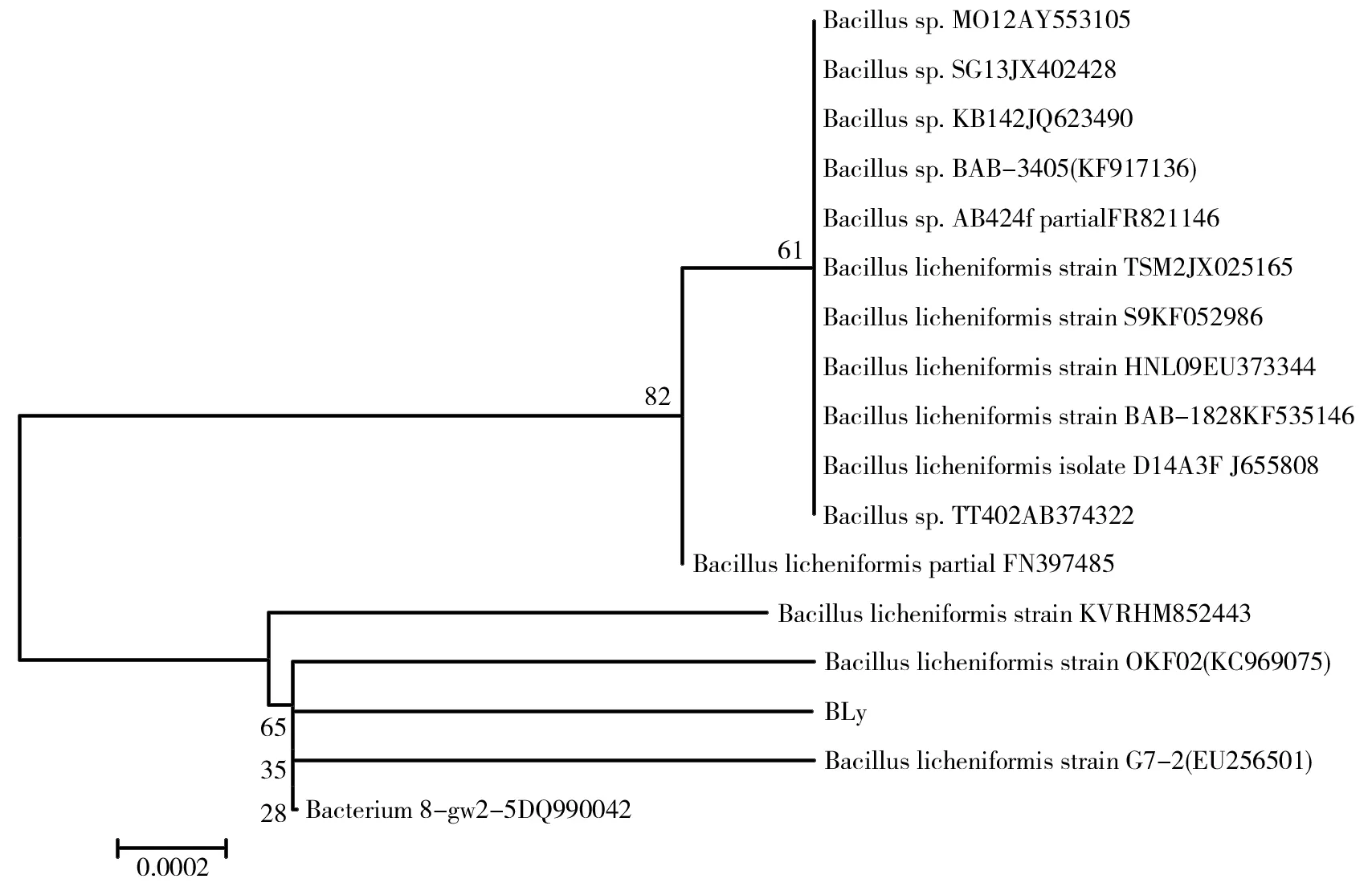
图2 BLy菌株的系统发育树
2.2 菌株BLy产抑菌物质发酵过程
测定不同时间的BLy菌发酵液的OD600 nm,以金黄色葡萄球菌为指示菌,每孔中加入15 μL BLy无菌发酵液,37 ℃培养24 h的抑菌圈,得到了BLy菌株产抑菌物质发酵过程曲线如图3所示。从图3分析可知,以LB培养基发酵,BLy菌株产抑菌物质的活性随发酵时间而变化,在菌种的对数生长期抑菌物质积累最快,8~12 h抑菌物质增加缓慢,12 h抑菌活性达到最大,随后下降。以LB为培养基,其产抑菌物质的合适发酵培养时间为10~12 h,可见BLy产抑菌物质的发酵周期与文献[1]报道的24 h以及文献[14]的48 h相比,发酵时间短,更易于生产和节约成本。15 μL BLy发酵10 h的无菌液与15 μL 10 U/mL青霉素对S.aureus的抑菌效果如图4所示。由图4可知,BLy对S.aureus抑制作用强,有进一步研究的价值。

图3 菌株Bly生长曲线及产抑菌物质的发酵过程

图4 BLy 10 h发酵液与10 U/mL青霉素对金黄色葡萄球菌的抑制作用
2.3 菌株BLy抑菌谱
通过抑菌圈法测定20 μL BLy菌株的发酵液对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌等的抑制作用。BLy的抗菌谱如表2所示。从表2中可以看出,BLy菌株的发酵液对金黄色葡萄球菌抑制作用最强,对枯草芽孢杆菌有微弱的抑制作用,在试验条件下对供试的其他菌株没有抑制作用。由此可见,菌株BLy产生的抗菌物质是窄谱抗菌的,与文献[15-16]中的广谱抑菌报道的不同,说明其抑菌活性物质的组成及结构有不同特性,有待进一步研究。
表2 BLy的抗菌谱
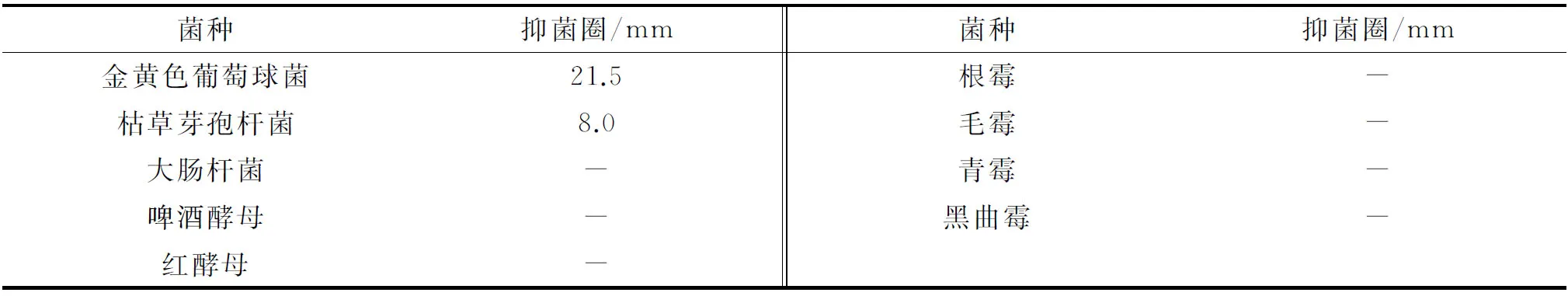
菌种抑菌圈/mm金黄色葡萄球菌21.5枯草芽孢杆菌8.0大肠杆菌-啤酒酵母-红酵母-
注:“-”表示没有抑制作用
2.4 BLy产生的抑菌物质的理化性质
(1)温度对抑菌活性的影响。将BLy培养12 h的菌液上清液除菌后60 ℃、80 ℃、100 ℃水浴保温30 min,冷却到室温取20 μL测定对S.aureus的抑菌活性。测定结果如表3所示。
(2)pH对抑菌活性的影响。研究中用1 mol/L HCL和1 mol/L NaOH调节发酵上清液的pH分别至3.0~12.0放置4 ℃过夜,再用1 mol/L NaOH和1 mol/L HCL将pH调至7.0,0.22 μm过滤除菌,取20 μL除菌液测定对S.aureus的抑菌圈。测定结果如表3所示。
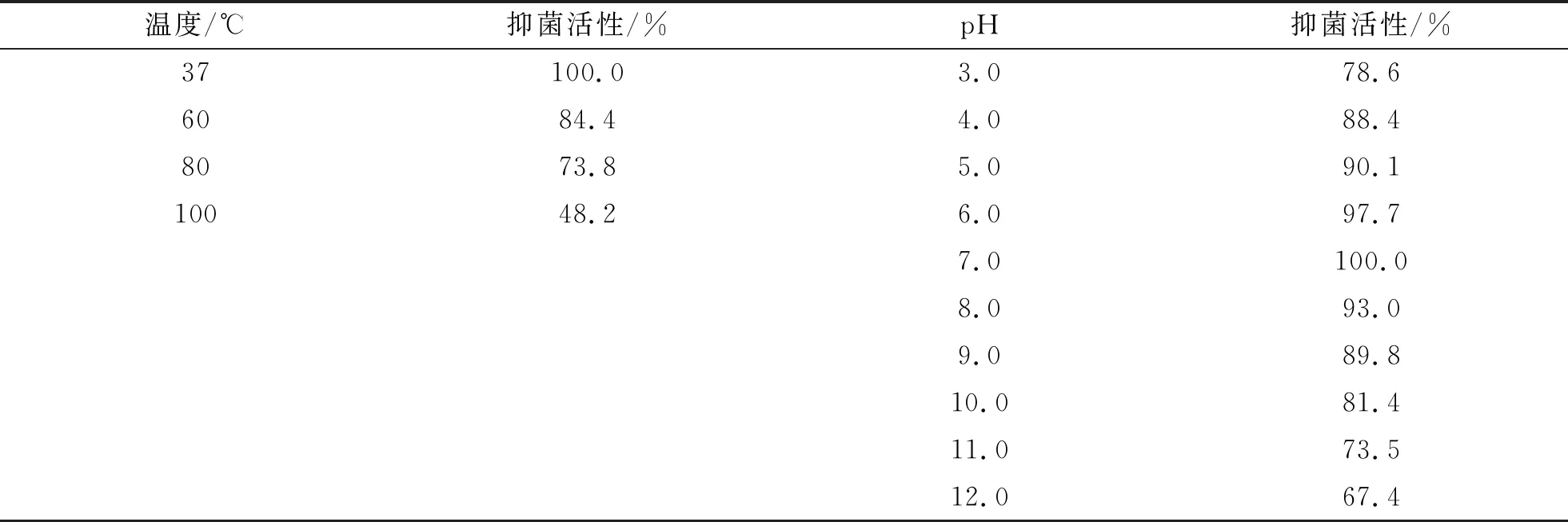
表3 温度和pH对Bly发酵液抑菌作用的影响
(3)水解酶对抑菌活性的影响。发酵上清液中酶的终浓度分别是胰蛋白酶250 U/mL,枯草杆菌蛋白酶60 U/mL,蛋白酶K 60 U/mL,37 ℃反应1.0 h。用0.22 μm过滤除菌,取20 μL除菌液测定对S.aureus的抑菌圈。测定结果如表4所示。

表4 水解酶对Bly发酵液抑菌活性的影响
以上实验结果表明,菌株BLy产生的抗菌活性成分能耐环境pH的变化,说明活性物质是具有酸碱两性的电解质,具有一定的缓冲能力;而耐热和抗水解酶等的作用说明抗菌活性成分不是大分子蛋白质类,综合分析菌株BLy产生的抗菌活性物质可能是抗菌多肽(AMP)类。
2.5 Bly产生的抑菌物质的分离纯化结果
菌株BLy发酵液中的拮抗物质经除菌体,硫酸铵盐析,葡聚糖凝胶柱层析步骤分离后,拮抗物质的混合蛋白液葡聚糖凝胶G75(SephadexG-75)色谱层析结果如图5所示。由图5可知,从发酵液中提取的混合蛋白经Sephadex G-75层析分离以后,可粗略地分离为两个组分(命名为δ1和δ2),将两个组分分别收集后做抑菌实验,组分δ1没有抑菌圈(为阴性“-”),而组分δ2有抑菌圈(为阳性“+”),说明具有抗菌活性的组分存在于分子量相对较小的δ2组分当中。
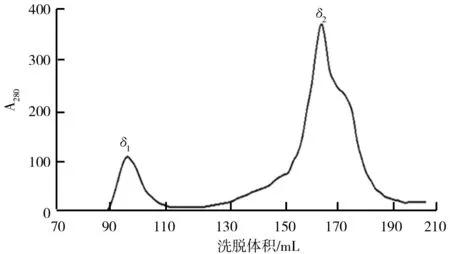
图5 混合蛋白液色谱层析结果
3 讨论
研究表明,菌株BLy在分类上属于地衣芽孢杆菌,能产生对金黄色葡萄球菌具有强的抑制作用的活性物质;菌株利用LB培养基产抑菌物质,在菌株的对数生长期约10~12 h达到最大抑菌活性,比In-CheolYe[1]报道的24 h以及Nithyalakshmy Rajarajanbao[14]报道的48 h短;对BLy的抗菌谱测定表明其产生的抑菌物质对革兰氏阳性菌作用效果比革兰氏阴性菌好,且对供试真菌没有抑菌作用。与高兆建[15]和李清[16]报道的广谱抗菌不同,地衣芽孢杆菌BLy抗菌肽具有窄的抗菌谱,说明它的代谢产物有较好的选择抗性,具有成为筛选具有选择抗性的活性化合物的菌种资源的潜力;菌株BLy产生的抑菌活性物质具有较强的耐热性能,100 ℃保温30 min仍保持48.19%的抑菌性能,与In-Cheol Ye[1]报道的地衣芽孢杆菌100 ℃处理后失去抑菌活性不同。且耐环境pH、抗蛋白酶等水解酶的水解作用,说明具有抗菌活性成分,是分子量相对较小的组分,初步确定菌株BLy产生的抑菌活性物质为抗菌肽(AMP)。
随着致病菌对抗生素耐药性的不断出现,研发新型抗菌药物已迫在眉睫。抗菌肽是一种广泛存在于生物体内具备多生物活性的小分子多肽,是机体天然防御系统的重要组成部分,其独特的抗菌机制使细菌不易对其产生耐药性,从而倍受人们关注。从动、植物体内直接提取抗菌肽的难度大、工艺要求高,难以应用于规模化生产,并且对于某些高等生物或人类源而言抗菌肽难以实现。细菌中已发现的抗菌肽有bacitracin,polymyxinE,gramicidinS和nisin等4种类型,革兰阴性菌或阳性菌均可分泌[3,17-18]。而细菌具有生长快、培养条件简单、发酵周期短、短期内可获得大量的代谢产物等优点。研究中的地衣芽孢杆菌BLy为具有益生作用的菌种,环境友好、易于培养、金黄色葡萄球菌在医学临床上是对青霉素等抗生素产生耐药性的微生物。菌株BLy的抗菌肽对金黄色葡萄球菌具有特异性抑制,有一定研究价值。有关BLy产生的抗菌肽的进一步分离纯化,抗菌活性物质的组成、结构及抗菌机理等有待进一步研究。
