拟南芥At5g58100基因T-DNA纯合插入突变体PCR鉴定及表型观察
2019-12-13刘瑶刘春宏庞朝廷高菊芳
刘瑶 刘春宏 庞朝廷 高菊芳


摘 要: 以拟南芥SPOT1功能缺失突变体spot1和野生型(WT)植株为材料,比较研究了它们在花粉发育和结实率方面的差异.spot1-1,spot1-2和spot1-3突变体都能形成可育的三核花粉,但用扫描电子显微镜 (SEM) 观察发现其花粉粒皱缩,花粉外壁存在纹理缺陷.用荧光显微镜观察了这些花粉粒的树脂半薄切片,发现花粉内壁无纤维素的自发荧光,spot1突变体成熟果荚中的种子数量显著少于野生型.对spot1-3突变体花药发育过程进行观察后发现,从花粉母细胞时期开始,突变体细胞壁组成与野生型已出现差异.10 μmol·L-1(物质的量浓度)茉莉酮酸既不能抑制黄化spot1幼苗的顶钩反应,又不能抑制1×10-6(质量分数)乙烯利引起的夸张顶钩反应.上述结果提示SPOT1基因的功能与小孢子初生外壁、花粉内壁的发育,以及花丝伸长(长度)有密切关系,SPOT1可能与茉莉酮酸信号传导通路相关联.
关键词: 初生外壁; 花粉内壁; 花丝伸长; 顶钩反应; 茉莉酮酸
中图分类号: Q 78; Q 943 文献标志码: A 文章编号: 1000-5137(2019)05-0503-08
Abstract: The differences between the spot1 mutants and wild type (WT) in their pollen development and spikelet fertility were compared in the paper.The pollen grains with spot1 mutants (spot1-1,spot1-2 and spot1-3) were shrunken and spotty in exine pattern by scan electron microscopy (SEM) observation,although they can all develop into male fertile pollens.There was no blue fluorescence in pollen wall at trans-section pollen grains by fluorescence microscope analysis.The average number of seeds in mature fruit pods with mutants is significant less than that of wild type because of insufficient pollination.The earliest change in the cell wall component occurs at the microspore mother cell stage of anther development by observation the sequential transverse sections of the spot1-3 mutant flower inflorescence.10 μmol·L-1 jasmonic acid treatment can neither inhibit the curvature of apical hook of etiolated spot1 mutant seedling,nor inhibit ethylene from promoting the formation of apical hook of etiolated spot1 mutant seedling.The results indicated that the function of SPOT1 gene might involve in the construction development of primexine and intine,and in filament elongation.SPOT1 gene might be related to jasmonic acid signal transduction pathway.
Key words: primexine; intine; filament elongation; apical hook response; jasmonic acid
0 引 言
花粉細胞壁在帮助雄配子抵御环境压力、微生物侵袭,以及在细胞识别中都起到重要作用.它由来自配子体的花粉内壁和来自孢子体的花粉外壁组成[1-2].当小孢子开始有丝分裂时,会在细胞膜与外壁中间分泌一层致密的物质——内壁.内壁的化学成分主要是果胶和纤维素,其生物化学和结构特征与经典的植物细胞壁类似[3].纤维素的分子结构非常简单,为不分支的β-1,4-葡聚糖链.通常数十条葡聚糖链组装成索状的结晶态微纤丝,微纤丝将进一步聚集成纤维素的高级结构,成为细胞壁的基本骨架[4].目前对花粉内壁的形成及调控的分子机制所知甚少,由于 3个涉及初生壁纤维素合成酶基因的突变体都是雄性不育突变体,其花粉壁也不正常,因此认为小孢子表面纤维素的沉积对于花粉壁的发育来说至关重要[5].另外,拟南芥中AtUSP是一个编码UDP-sugar 焦磷酸化酶的基因,突变体表型为外壁正常,而败育的小孢子内壁特异缺失,其突变体表现出配子体败育表型[6].
花粉外壁又可分为蜂窝状的外壁外层以及平坦的外壁内层.外壁外层是由网格状结构的柱状结构、顶盖层,和填充在它们之间空隙的含油层构成.花粉外壁的主要构成是孢粉素[3].研究发现小孢子在四分体 (Tds) 时期形成的暂时细胞壁基质——初生外壁为花粉外壁的形成提供了模板,决定了后期花粉外壁的纹理[7-8].近年来,通过对花粉壁发育缺陷突变体的研究,DEX1,RPG1,NPU,EFD,SPONGY,UPEX等多个与初生外壁发育相关的基因得以被克隆,这些基因的功能缺失突变体在花粉发育过程中均表现出初生外壁的结构异常,从而造成花粉外壁纹理缺陷[9-15].
花丝是开花植物雄性生殖器——雄蕊的组成部分,花丝伸长将花药托起,使成熟的花粉粒 (PG) 落到柱头上进而完成授粉受精过程,因此花丝的正常发育对于种子植物繁衍后代至关重要.研究表明:茉莉酮酸(JA) 直接参与调控花药开裂、花粉成熟和花丝伸长[16-17].
At5g58100基因编码一种功能未知蛋白,DOBRITSA等[18]在大规模筛选花粉壁发育缺陷突变体时发现At5g58100基因的3个根癌农杆菌DNA(T-DNA)纯合插入等位突变独立株系 (SALK_061320c,SALK_041228和SALK_079847),它们插入At5g58100基因的不同位置,但是均导致花粉外壁的相似表型缺陷——花粉外壁缺乏顶盖,表明At5g58100基因与孢粉素的沉积模式有关.他们将这种花粉壁发育缺陷突变体命名为spot1突变体.
为了进一步研究At5g58100基因的功能,本文作者观察了spot1突变体的营养生长和生殖生长过程、花粉发育过程,发现spot1突变体小孢子初生外壁和花粉内壁发育异常,而且由于花开放时花丝伸长(长度)不足造成授粉不足,使突变体的结实率显著低于野生型 (WT) 的结实率.在此基础上,利用黄化幼苗的顶钩反应,观察了spot1突变体种子对茉莉酮酸处理和乙烯利处理的反应.结果发现10 μmol·L-1茉莉酮酸既不能抑制黄化spot1幼苗的顶钩反应,也不能抑制1×10-6(质量分数)乙烯利引起的夸张顶钩反应.上述结果提示SPOT1可能作为茉莉酮酸信号传导通路的组成成分之一,参与小孢子初生外壁和花粉内壁的发育以及花丝伸长反应.
1 材料与方法
1.1 植物材料
拟南芥(Arabidopsis thaliana):Columbia(Col)生态型种子,由杨仲南教授实验室继代种植培养所得.
将从SALK突变体库购买的7种At5g58100基因的T-DNA插入突变体(salk-072486,salk-073032,salk-041237,salk-041228,salk-072490,salk-079847,salk-06130c)种子种下,经过扫描电子显微镜 (SEM) 筛选、T-DNA插入,鉴定得到At5g58100基因的T-DNA纯合插入突变体spot1-1(salk_072490),spot1-2(salk_079847)和spot1-3(salk_061320c).
植物种植方法参照文献[19].
1.2 方 法
1.2.1 T-DNA插入及插入位点鉴定
提取野生型和spot1突变体植株DNA的方法参照文献[19].利用TAIR (http://www.arabidopsis.org/) 网上提供的引物序列(LB1.3:
ATTTTGCCGATTTCGGAAC;
SALK_079847LP AGCTTGCTCTTTGTGAAGGTG,
SALK_079847 RP CAATGCAGGATCCTCAGAGAG;
SALK_072490LP GCAGTTGCAGGTACTATTCGC,
SALK_072490RP TCCATTCGTCTTAGTGCATCC;
SALK_061320c LP AAAGGAGCCAACCTTGAGAAG,
SALK_061320c RP AAAGAAGCCTTTCCTTGATGC)
分别进行左边界序列(LP)引物 +右边界序列(RP)引物和通用(LB)引物+ RP引物聚合酶链式反应(PCR),纯合插入植株的LB+RP PCR反应产物送上海杰李生物技术有限公司测序,通过旁临序列分析获得T-DNA插入位点.
1.2.2 SPOT1基因表达量测定
根据trizol 试剂盒的说明提取野生型和spot1突变体花序RNA,并用DNA酶处理得到纯化的RNA,用逆转录酶反转录成cDNA.根据突变体基因组中T-DNA的插入位点设计3对引物EX13 F TTATCGATTTAACTGCTGGCC,EX15 R CCTTCACAAAGAGCAAGCTTC(spot1-1);EX17 F AAAATTACACAGTTGCACGC,EX19R ATATGAACGAACAGTCTTCCG(spot1-2);EX19 F TTAACACTCTCTGAGGATCCTG,EX20 R CCATAATAGTGATCGCCCG (spot1-3)进行逆转录定量聚合酶链式反应(qRT-PCR).反应体系(20 μL):SYBR Green I master mix:10 μL,引物F:0.4 μL,引物R:0.4 μL,cDNA:0.7 μL,水:8.5 μL,每对引物重复3次,在ABI PRISM 7300 detection system上进行扩增.以野生型的表达量为1计算突变体的相对表达量.
1.2.3 植株生殖生长和花粉发育观察
野生型和突变体植株从营养生长过渡到生殖生长后两周,随机各抽取10株植株,测定最早出现的5个果荚中的种子数量,求得平均值和标准差;每株选取一朵处于盛开的花,测量四强雄蕊和雌蕊的长度,四强雄蕊的长度取平均值记录结果.
13期花粉中细胞核的4′,6-二脒基-2-苯基吲哚(DAPI)染色,花粉外貌的SEM观察,树脂半薄切片样品制备和观察方法参照文献[20].
1.2.4 对茉莉酮酸和乙烯利响应能力的观察
将野生型和spot1突变体种子作除菌处理,春化3 d后播种在1/2 MS培养基、含10 μmol·L-1 JA的1/2 MS培养基、含1×10-6乙烯利的1/2 MS培養基,以及含1×10-6乙烯利+10 μmol·L-1 JA的1/2 MS培养基上,用锡箔纸包裹培养皿,22 ℃培养3 d.每个条件重复3次.培养结束后,在每种条件培育的组中随机抽取不少于10个幼苗个体,将它们放置于具有黑色背景的培养皿中,在相同放大倍数的解剖镜下拍照,保存照片.根据照片的比例,测定记录不同条件下生长的幼苗的顶钩角度,进行统计分析.通过组间差异显著性检验,判断spot1突变体对茉莉酮酸和乙烯利的响应能力.
2 结 果
2.1 SPOT1功能缺失突变体的获得和鉴定
为了获得SPOT1功能缺失突变体,从SALK突变体库购买了针对At5g58100基因的7个株系(salk_072486,salk_073032,salk_041237,salk_072490,salk_079847,salk_061320c和salk_041228)的T-DNA插入突变体的种子.植株开花后提取花序总DNA,利用T-DNA上特异性引物LB及基因上的引物LP,RP,从salk_072490,salk_079847,salk_061320c株系中鉴定出了纯合的T-DNA插入突变体.用SEM观察13期花粉的外貌,发现花粉外壁发育缺陷与T-DNA纯合插入紧密连锁,将其分别命名为spot1-1(salk_072490),spot1-2(salk_079847)和spot1-3(salk_061320c)突变体,如图1(a),1(f)所示.用LB及各自的RP引物扩增得到PCR产物,经琼脂糖凝胶电泳后,切取含目的片段的琼脂糖胶,回收后,用T-DNA特异的LB引物进行测序.测序结果经过TAIR数据库比对,发现spot1-1突变体的T-DNA插在SPOT1基因组的ATG下游3502 bp处(第14个内含子),spot1-2突变体的T-DNA插在该基因ATG下游4453 bp处(第17个内含子),spot1-3突变体的T-DNA插在该基因ATG下游5657 bp处(第20个外显子),如图1(b)所示.
为了解T-DNA纯合插入对SPOT1基因表达的影响,在3种突变体T-DNA两侧的外显子序列处,设计了3对引物,分别是spot1-1:EX13F,EX15R;spot1-2:EX17 F,EX19R;spot1-3:EX19 F,EX20 R进行实时定量RT-PCR.qRT-PCR结果显示:在3种突变体背景下 SPOT1基因在花苞中的表达量显著下调,如图1(c)所示.这表明T-DNA的插入导致At5g58100基因在花器官中的正常表达被阻断.至此,获得了3个独立株系的SPOT1功能缺失突变体spot1-1,spot1-2和spot1-3.
2.2 spot1突变体表型的初步观察
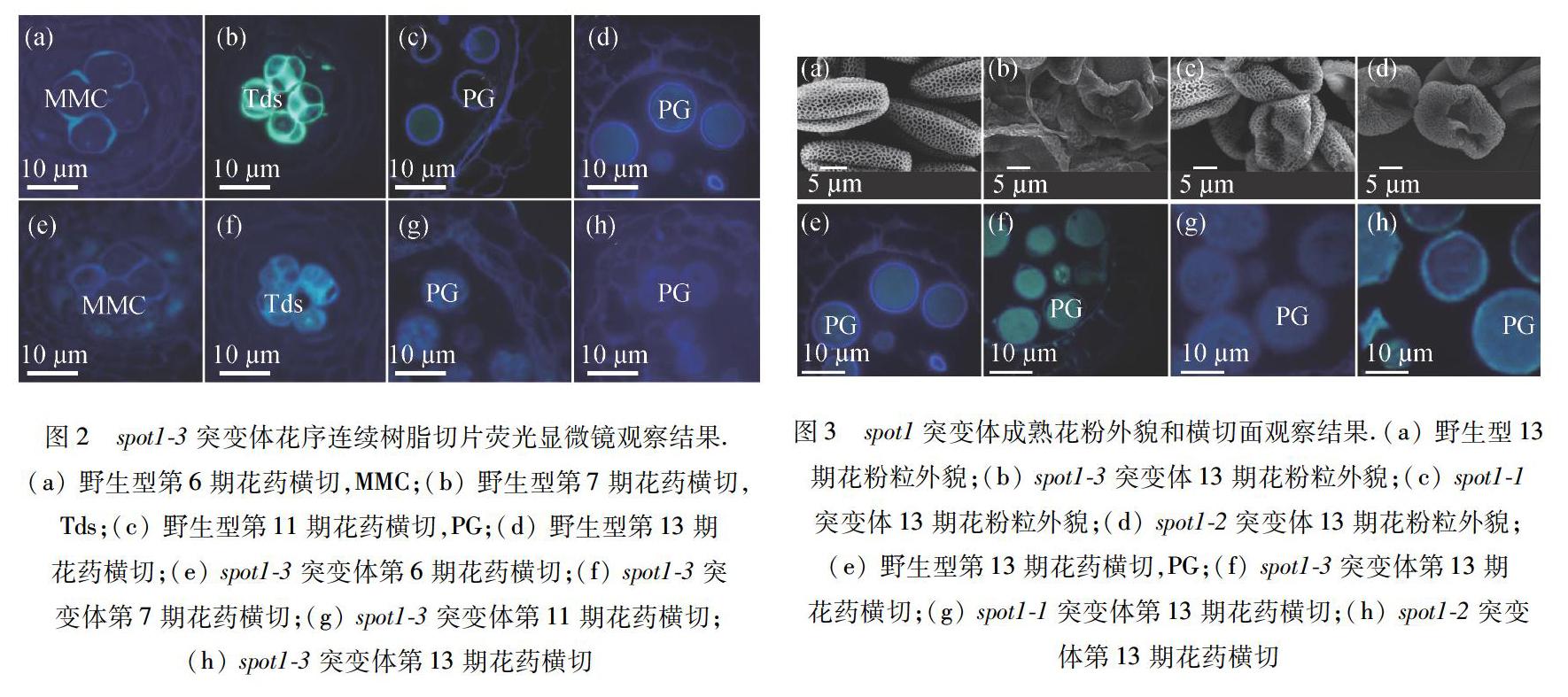
观察发现spot1突变体在营养生长时期与野生型没有显著差异,但在生殖生长时期却出现了明显不同,主要表现为spot1突变体果荚短小,成熟花粉皱缩,和花粉外壁纹理缺陷,如图1(d),1(f)所示,虽然DAPI染色表明13期花药中的花粉粒均为三核花粉,如图1(g)所示,亚历山大染色表明花粉都是可育的,如图1(e)所示.与野生型盛开的花相比,spot1突变体花的萼片、花瓣及花药的形态和数目均正常,但是花丝的长度略短.野生型拟南芥花丝顶端的花药通常高于柱头,而突变体花丝顶端的花药刚刚能够着柱头或者在柱头之下,如图1(h)所示.
统计分析表明野生型每个果荚中的种子数量平均为(28±2)粒,极其显著地高于spot1-1突变体的(17±5)粒、spot1-2突变体的(9±4)粒和spot1-3突变体的(14±6)粒(表1).从表1中还可以看到,spot1-1突变体雄蕊与雌蕊长度之差为(0.28±0.13) mm,spot1-2突变体雄蕊与雌蕊长度之差为(-0.10±0.12) mm,spot1-3突变体雄蕊与雌蕊长度之差为(0.15±0.10) mm,与野生型雄蕊与雌蕊长度之差[(0.55±0.12)mm]相比,均具有极其显著的差异.上述结果表明,spot1突变体雄蕊与雌蕊在生长发育上的不协调,影响了正常的授粉,从而导致结实率的下降.
2.3 spot1突变体花粉内壁结构缺乏纤维素成分
为了寻找造成spot1突变体花粉外壁纹理缺陷的原因,利用荧光显微镜技术对spot1-3突变体花序的树脂半薄连续切片进行了观察.结果发现:在花药发育的第6期,野生型拟南芥小孢子母细胞 (MMC) 细胞壁的主要成分是胼胝质,与苯胺蓝水溶液反应后,在紫外光激发下发出黄绿色荧光,如图2(a)所示.而spot1-3突变体小孢子母细胞细胞壁发出的荧光比较弱且偏蓝色,如图2(e)所示,提示突变体小孢子母细胞细胞壁的成分发生了变化.在花药发育的第7期,野生型药室中的四分体不仅四周包裹的胼胝质壁发出较强的黄绿色荧光,而且小孢子之间新生的分隔带也发出属于胼胝质的强烈黄绿色荧光,如图2(b)所示.而尽管小孢子之间新生的分隔带发出微弱的黄绿色荧光,spot1-3突变体药室内的包裹四分体的细胞壁发出的是偏蓝色的荧光,如图2(f)所示.在花药发育的第11期,二核花粉会在质膜和花粉外壁之间形成以纤维素为主要结构成分的内壁.由于纤维素有自发荧光,所以在野生型第11期以后的药室里,在紫外光激发下可以看到有一个蓝色的圆环围绕在花粉粒的四周,如图2(c),2(d)所示.与此相对应地,spot1-3突变体同期的药室里没有蓝色圆环围绕花粉粒,如图2(g),2(h),图3(f)所示;成熟的spot1-1突变体花粉粒外壁之内虽有蓝色荧光,如图3(g)所示,但比野生型的弱得多;成熟的spot1-2突变体花粉粒外壁之内的荧光偏黄绿色,类似胼胝质发出的荧光.上述结果表明:SPOT1功能的缺失使突变体雄配子细胞壁中胼胝质和纤维素等结构成分的合成发生异常,表现为小孢子母细胞时期胼胝质合成减少,纤维素合成增多,而二核花粉期后,内壁纤维素合成显著减少,胼胝质合成可能增加.因此,spot1突变体花粉外壁孢粉素沉积异常可能是初生外壁结构异常的结果,而花粉外形皱缩是由于缺乏花粉内壁纤维素的支撑.
2.4 spot1突变体对茉莉酮酸刺激無应答
植物激素JA和乙烯(ET)可协同调控植物防御和器官发育,两者之间还存在拮抗作用,表型之一就是乙烯利促进避光生长的种苗形成顶端弯钩,而JA抑制这一过程.依据spot-1突变体因花丝伸长不足造成结实率显著下降的现象,推测SPOT-1蛋白的功能可能与茉莉酮酸信号传导有关.将野生型和spot1春化后的种子播种在不同基质的1/2 MS培养基上避光生长3 d,3日龄黄化幼苗的顶钩弯曲度如图4所示,统计分析结果如表2所示.
由圖4和表2可知:在正常生长条件下(1/2 MS培养基),3日龄黄化spot1-3幼苗的顶钩弯曲度[(179±7)°]显著大于3日龄黄化野生型幼苗的顶钩弯曲度[(140±14)°].在1×10-6乙烯利处理下,3日龄黄化spot1-3幼苗与黄化野生型幼苗一样形成夸张的顶端弯曲,弯曲度分别为 (350±8)° 和 (345±7)°,两者没有显著性差异.在10 μmol·L-1 JA处理下,3日龄黄化野生型幼苗的顶钩弯曲度受到抑制,为 (83±16)°,而3日龄黄化spot1-3幼苗的顶钩弯曲度不受影响,为 (164±22)°.在1×10-6乙烯利和10 μmol·L-1 JA同时存在的条件下,JA抑制了乙烯促进黄化野生型幼苗顶钩形成的作用,其弯曲度为 (170±8)°,但JA不能抑制乙烯促进黄化spot1-3幼苗顶钩形成的作用,其弯曲度为 (348±9)°.上述结果表明spot1-3突变体对外源乙烯刺激的反应能力正常,但失去了对内源和外源JA刺激的反应能力,提示SPOT1蛋白可能是茉莉酮酸信号传导途径的关键成分之一.
3 讨 论
根据SPOT1基因的突变会影响花粉外壁纹理形成的研究报道[18],首先利用SEM技术观察花粉外貌,再结合T-DNA插入位点鉴定及T-DNA旁临序列分析等技术,获得了3个独立的SPOT1基因功能缺失株系spot1-1,spot1-2和spot1-3,再次证实SPOT1确实参与花粉外壁纹理的形成.
研究结果表明:SPOT1功能缺失突变体spot1失去了对内源性和外源性茉莉酮酸的反应能力,改变了小孢子母细胞细胞壁、四分体时期小孢子初生外壁和花粉内壁的结构成分,使花丝伸长与柱头发育不协调,造成了spot1成熟花粉外壁结构缺陷,内壁缺乏纤维素刚性支撑而皱缩,以及果荚中种子数量显著下降等结果.本研究结果为进一步从分子水平研究SPOT1的作用机制提供了参考.
参考文献:
[1] 朱骏,杨仲南.花粉壁发育研究进展 [J].自然杂志,2013,35(2):112-117.
ZHU J,YANG Z N.The research progress of pollen wall development [J].Chinese Journal of Nature,2013,35(2):112-117.
[2] BEDINGER P.The remarkable biology of pollen [J].The Plant Cell,1992,4(8):879-966.
[3] BLACKMORE S,WORTLEY A H,SKVARLA J J,et al.Pollen wall development in flowering plants [J].New Phytologist,2007,174(3):483-498.
[4] PAREDEZ A R,SOMERVILLE C R,EHRHARDT D W.Visualization of cellulose synthase demonstrates functional association with microtubules [J].Science,2006,312:1491-1495.
[5] BRETT C T,WALDRON K W.Physiology and Biochemistry of Plant Cell Walls [M].London:Unwin Hyman,1990.
[6] SCHNURR J A,STOREY K K,JUNG H J,et al.UDP-sugar pyrophosphorylase is essential for pollen development in Arabidopsis [J].Planta,2006,224:520-532.
[7] FITZGERALD M A,KNOX R B.Initiation of primexine in freeze-substituted microspores of Brassica campestris [J].Sex Plant Reproduction,1995,8:99-104.
[8] SCOTT R J,SPIELMAN M,DICKINSON H G.Stamen structure and function [J].Plant Cell,2004,16(Suppl):46-60.
[9] PAXSON-SOWDERS D M,DODRILL C H,OWEN H A,et al.DEX1,a novel plant protein,is required for exine pattern formation during pollen development in Arabidopsis [J].Plant Physiology,2001,127:1739-1749.
[10] CHEN L Q,HOU B H,LALONDE S,et al.Sugar transporters for intercellular exchange and nutrition of pathogens [J].Nature,2010,468:527-532.
[11] GUAN Y F,HUANG X Y,ZHU J,et al.RUPTURED POLLEN GRAIN 1,a member of the MtN3/saliva gene family,is crucial for exine pattern formation and cell integrity of microspores in Arabidopsis [J].Plant Physiology,2008,147:852-863.
[12] CHANG H S,ZHANG C,CHANG Y H,et al.No primexine and plasma membrane undulation is essential for primexine deposition and plasma membrane undulation during microsporogenesis in Arabidopsis [J].Plant Physiology,2012,158:264-272.
[13] SHI J X,CUI M H,YANG L,et al.Genetic and biochemical mechanisms of pollen wall development [J].Trends in Plant Science,2015,20(11):741-753.
[14] UEDA K,YOSHIMURA F,MIYAO A,et al.COLLAPSED ABNORMAL POLLEN1 gene encoding the arabinokinase-like protein is involved in pollen development in rice [J].Plant Physiology,2013,162(2):858-871.
[15] LI W L,LIU Y,DOUGLAS C J.Role of glycosyl transferases in pollen wall primexine formation and exine patterning [J].Plant Physiology,2017,173(1):167-182.
[16] SHI X,DAI L Y,LIU F Q,et al.COS1:an Arabidopsis coronatine insensitive1 suppressor essential for regulation of jasmonate-mediated plant defense and senescence [J].The Plant Cell,2004,16(5):1132-1142.
[17] McCONN M,BROWSE J.The critical requirement for linolenic acid is pollen development,not photosynthesis,in an Arabidopsis mutant [J].The Plant Cell,1996,8 (3):403-416.
[18] DOBRITSA A A,GEANCONTERI A,SHRESTHA J,et al.A large-scale genetic screen in Arabidopsis to identify genes involved in pollen exine production [J].Plant Physiology,2011,157(2):947-970.
[19] ZHANG Z B,ZHU J,GAO J F,et al.Transcription factor AtMYB103 is required for anther development by regulating tapetum development,callose dissolution and exine formation in Arabidopsis [J].Plant Journal,2007,52:528-538.
[20] 高菊芳,楊太为.荧光显微术在鉴别拟南芥花粉壁发育相关基因功能中的应用 [J].上海师范大学学报(自然科学版),2010,39(6):615-622.
GAO J F,YANG T W.Application of fluorescence microscopy in distinguish the functions of pollen wall development related genes in Arabidopsis [J].Journal of Shanghai Normal University (Natural Sciences),2010,39(6):615-622.
(责任编辑:顾浩然)
