河豚毒素在半褶织纹螺体内富集和消除的研究
2019-12-13陈页张小军曾军杰严忠雍宗靖靖
陈页 张小军 曾军杰 严忠雍 宗靖靖

摘要 以有毒的河豚鱼肝脏和无毒虾肉饲喂半褶织纹螺,定期取样,通过免疫亲和柱净化-超高效液相色谱-串联质谱法分析织纹螺体内河豚毒素含量的变化。结果表明,半褶织纹螺对河豚毒素的耐受力高,投喂有毒河豚鱼肝脏后,其体内毒素含量迅速增加。当投喂无毒虾肉后,其体内的河豚毒素初期会呈现减少趋势,此后又快速增加。处理组和对照组几乎在同一时间段内出现毒素升高。因此,推断半褶织纹螺能自身产生河豚毒素,也能从食物链获得河豚毒素。
关键词 织纹螺;河豚毒素;富集;超高效液相色谱-串联质谱(UPLC-MS/MS)
中图分类号 S917.4文献标识码 A
文章编号 0517-6611(2019)22-0097-03
Abstract The common snails of Nassarius semiplicatus were fed with toxic pufferfish liver and nontoxic shrimp meat in laboratory environment.The samples were taken regularly to analyze the changes of TTX content by UPLCMS/MS based on immunoaffinity column (IAC) purification.The results showed that Nassarius semiplicatus had high tolerance to toxin.After feeding toxic puffer fish liver,the toxin content in the body increased rapidly.When the nontoxic shrimp meat was fed,the accumulated TTX tended to decrease initially,but then the toxin content increased rapidly.In the same time period,there was an increase of toxin in the treatment group and the control group.Therefore it could be hypothesized that TTX in Nassarius semiplicatus might be produced by themselves.At the same time,Nassarius semiplicatus could enrich TTX through the food chain.
Key words Nassarius spp.;Tetrodotoxin;Enrichment;UPLCMS/MS
織纹螺(Nassarius spp.)是一类海洋腹足类动物,是沿海地区常见的螺种,大多生活在潮间带滩涂上,腐食性,在我国从南到北都有分布,主要在浙江、江苏、广东、福建一带,其中最常见的是半褶织纹螺(Nassarius semiplicatus)。调查显示,我国东南沿海织纹螺按带毒情况大致分为无毒织纹螺、有毒织纹螺和季节性有毒织纹螺[1]3类,如图1所示。
我国沿海部分地区居民因食用织纹螺中毒事件时有发生,甚至出现人员死亡[2]。由于织纹螺食物中毒死亡率高,规模大,范围广,2012年国家卫生健康委员会《关于预防织纹螺食物中毒的公告》已明令禁止销售、经营和食用织纹螺。目前已有大量研究表明织纹螺的主要致毒成分为河豚毒素(tetrodotoxin,TTX)及其衍生物[3-6]。
关于织纹螺体内河豚毒素来源一直存在争议,主要分为外源性和内源性,其中外源性分为食物链来源与微生物起源。织纹螺是腐食性动物,可能摄食了环境中有毒动物尸体或有毒藻类,导致毒素在体内蓄积。此外,也有研究表明织纹螺体内及其生活环境中均能分离培养出产生河豚毒素的细菌,但这些细菌的毒素含量很低,可能与毒素的产生或累积关系不大[7],或是并非所有细菌都能在实验室条件下培养;内源性来源可能是织纹螺像有些特定物种一样能够自身产生河豚毒素[8-9]。研究表明,携带河豚毒素的动物本身对其毒性有较强的耐受性[10-11],这些动物食用有毒物质后,不会出现中毒症状,反而会将吸收的毒素转变为体内的一部分蓄积起来,停止摄入有毒物质后则毒性减少[12]。目前,在携带TTX的多种生物中,进行了广泛的饵料饲喂研究,为TTX的食物来源提供了依据[13-15]。尽管TTX的最终来源仍不确定,但这些物种从食物中获取TTX以及用它来增加自身的适应性是确定的。笔者开展高毒性半褶织纹螺的室内饲养试验,以投喂有毒饵料的方式,考察毒素在织纹螺体内富集和消除的情况,进而探讨半褶织纹螺体内毒素的可能来源。
1 材料与方法
1.1 试验材料
半褶织纹螺采集自浙江温岭,另购买暗纹东方鲀的肝脏,冷冻保存,作为投喂织纹螺的有毒饵料;使用虾肉作为无毒饵料。采用免疫亲和柱净化-超高效液相色谱-串联质谱法[16]测得暗纹东方鲀的肝脏毒素含量约125 mg/kg,而虾肉中未检出毒素。
1.2 主要仪器与试剂
1.2.1 主要仪器。ACQUITYTM型超高效液相色谱仪、Waters Xevo TQS四极杆质谱仪(配电喷雾离子源);Centrifuge 5810高速离心机;VisiprepTMDL固相萃取装置;MS2漩涡混合器; N-EVAP112氮吹仪;超声波清洗器;河豚毒素(TTX)免疫亲和柱。
1.2.2 试剂。
河豚毒素(TTX)标准品(纯度≥98.0%);乙酸、NaCl、Na2HPO4·12H2O、NaOH、NaH2PO4·2H2O、甲酸、乙酸铵、甲醇、乙腈;试验用水均为超纯水。
1.3 试验设计
织纹螺清理干净后,饲养在容积120 L的水箱内,试验用水为沉淀、过滤后的海水,盐度为(24±2)‰,连续充氧,每2 d更换1次海水,室温控制在(24±1) ℃,静水条件净化驯养7 d,期间不投食;7 d后每隔2 d投喂1次虾肉,后续选择状态良好、大小均一的个体进行试验。试验期间织纹螺活动正常,健康无病,自然死亡率小于5%。
室内模拟试验设置处理组和对照组,每组又分为3个小组。处理组试验分为暴露阶段和净化阶段2个阶段。暴露阶段持续20 d,每天对织纹螺投喂有毒河豚鱼肝脏。净化阶段持续50 d,每天投喂无毒虾肉。整个试验期间,对照组的织纹螺始终投喂无毒虾肉。摄食2 h后换水。定期分别从处理组和对照组中各取样约40个,于-20 ℃下保存,备用。取样时间点设置为0、1、3、6、10、16、20、21、23、25、28、30、40、50、60和70 d。
1.4 溶液配制
①TTX 标准溶液。准确称取1.00 mg TTX 标准品,用含0.1%甲酸的5 mmol/L乙酸铵溶液-乙腈(1∶1,V/V)溶液溶解并定容至50 mL,避光4 ℃冷藏保存,保存期限为6个月;使用时将浓度稀释至1.0 μg/mL。②磷酸盐缓冲液(PBS)。分别称取NaCl 4.25 g,NaH2PO4·2H2O 1.09 g,Na2HPO4·12H2O 6.45 g,用超纯水溶解并稀释至500 mL。
1.5 样品提取与净化
1.5.1 样品提取。
清洗并解剖织纹螺,将得到的所有软体组织勻浆。准确称取0.5~1.0 g已充分均质的样品置于50 mL离心管中,加入10 mL含有1%乙酸的甲醇溶液,涡旋振荡3 min,60 ℃水浴超声提取15 min,冷却至室温后,6 000 r/min离心5 min。移取上清液1~2 mL,置于另一个10 mL离心管中,加入4倍体积的PBS 溶液稀释,用1 mol/L NaOH溶液调节pH为6.9~7.5,待过柱净化。
1.5.2 免疫亲和柱净化。
免疫亲和柱待温度回至室温,放出柱内保存液,取样品液过柱。过柱结束后用8 mL 20%甲醇水进行淋洗,淋洗完毕后挤干柱内残留液,并弃去以上全部流出液,最后用4 mL含2%乙酸的甲醇溶液洗脱,收集洗脱液,60 ℃水浴氮气吹干,用1 mL含0.1%甲酸的5 mmol/L乙酸铵溶液-乙腈(1∶9,V/V)溶解并定容,经0.22 μm滤膜后供分析。
2 结果与分析
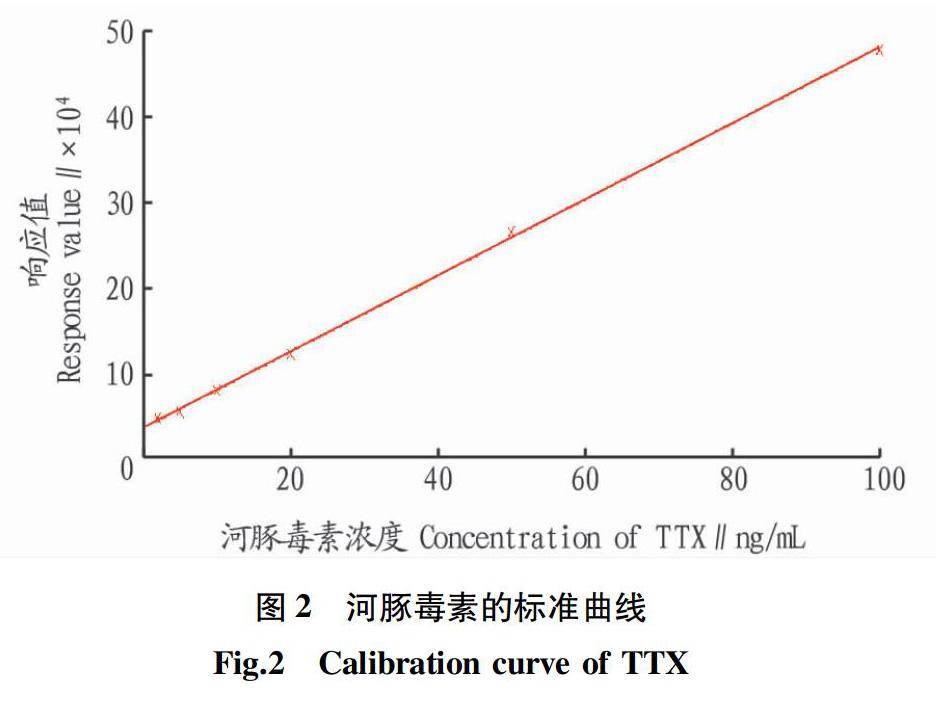
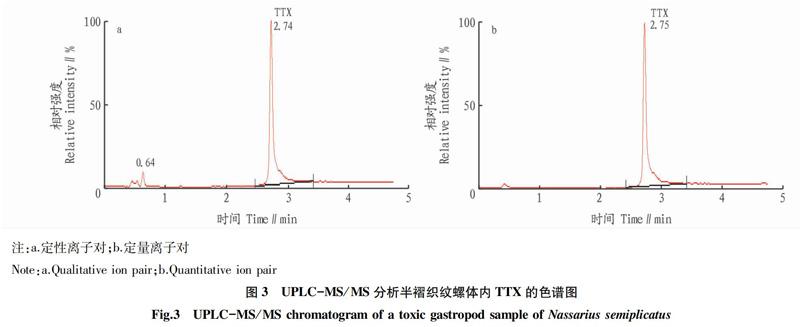
2.1 TTX的UPLC-MS/MS分析方法 所用分析方法参照2015年实验室已完善的海洋生物中TTX的测定方法[16]。将浓度1.0 μg/mL的TTX标准使用液逐级稀释成浓度分别为2.0、5.0、10.0、20.0、50.0、100 ng/mL的标准工作液,绘制标准曲线,其线性回归方程为y=4 037.18x+31 207.5,相关系数R2=0.999 534,TTX在2.0~100 ng/mL范围内线性良好(图2)。半褶织纹螺体内TTX为主要毒素成分,色谱图如图3所示。由于缺少TTX同系物标准品,所以暂不讨论其他同系物。
2.2 半褶织纹螺体内毒素含量的变化 在整个试验过程中,织纹螺摄食活跃,未观察到异常情况。使用Sigmaplot软件对试验所得数据进行绘图,如图4所示。在暴露阶段,投喂高毒性的河豚鱼肝脏后,半褶织纹螺中的毒素含量迅速增加, 第20天升至最高(74.577 mg/kg)。当投喂无毒虾肉后,毒素含量呈现下降趋势,第25天短暂上升,此后继续降低。第40天开始毒素含量又迅速上升,第60天含量上升至仅次于投毒阶段结束时的含量。60 d后毒素含量降低但仍维持在较高水平。
在整个试验过程中,对照组半褶织纹螺投喂无毒虾肉,刚开始其毒素含量呈逐渐下降的趋势,第16天毒素含量降至最低水平(0.14 mg/kg)。但此后至第25天毒素含量呈现升高趋势,第25天毒素含量达到1.14 mg/kg,接近第0天水平,此后又呈现下降趋势。第50~60天,毒素含量又迅速上升,第60天毒素含量大约是第0天时的4倍。试验后期又降至较低水平。由此可见,处理组和对照组几乎在同一时间段内出现了毒素升高的情况。
3 讨论
河豚毒素(tetrodotoxin,TTX)是一种小分子量非蛋白神经毒素,剧毒,存在于织纹螺科的多种生物中。该研究发现,投喂高毒性饵料时处理组织纹螺并没有中毒死亡,在行为上与对照组没有任何区别,表明携带河豚毒素的生物对河豚毒素有较高的耐受性。在实验室环境受控条件下,半褶织纹螺能够通过食物链快速累积一定量的河豚毒素。当改投无毒饵料时,体内累积的河豚毒素刚开始会呈现减少趋势,但随后几乎在相同的时间段内,处理组和对照组都出现了一个明显的毒性高峰,因此很可能半褶织纹螺毒素由其自身产生。
张农等[2]研究表明,织纹螺的毒性与其种类、生长季节、生活区域都有关系。通过监测不同地区织纹螺毒性季节性消长,发现每年4—9月是毒力较高的时期,与已报道的食物中毒的变化规律[2,17-18]相一致。半褶织纹螺虽然大多数情况下无毒,但因季节和栖息地不同有时会有毒[1]。此次样品均采自浙江温岭坞根镇伏屿山外海涂,排除了种内地域性差异。调查发现,在相同的生态环境下,半褶织纹螺相比于其他螺类毒性更高,认为可能与其有较高的富集毒素能力有关[19]。此外在其他一些携带TTX的动物中发现,海星(Astropecten scoparius)毒性的季节变化规律与性成熟时期相关,9—11月为性成熟季节,毒性较高[20];河豚鱼(T.niphobles)和(T.alboplumbeus)毒性的季节变化与他们的产卵季节有一定的相关性[21]。综上所述,半褶织纹螺体内高含量的河豚毒素可能通过食物链累积得到,同时在某些条件下其自身也会产生河豚毒素,并且体内毒素的产生或累积遵循一定的生物节律,有可能与繁殖、产卵相关。
該研究表明织纹螺能够通过食物链富集河豚毒素,但缺少对野外采样环境中可识别的河豚毒素来源的调查,因此对织纹螺体内河豚毒素食物链来源缺少有利的证据。后续将开展进一步的研究,选择代表性地区进行长期采样和毒性监测,同时对采样环境中其他生物等各种因子进行密切观测和调查,更全面阐明织纹螺体内毒素来源的问题。
参考文献
[1] 张农,苏捷,刘海新,等.我国东南沿海地区织纹螺科的种类与毒性[J].生态毒理学报,2009,4(2):289-294.
[2] 张农,刘海新,苏捷,等.织纹螺及其毒性[J].中国水产,2007(3):72-73.
[3] HWANG D F,SHIU Y C,HWANG P A,et al.Tetrodotoxin in gastropods (snails) implicated in food poisoning in Northen Taiwan[J].Journal of food protection,2002,65(8):1341-1344.
[4] HWANG P A,TSAI Y H,DENG J F,et al.Identification of tetrodotoxin in a marine gastropod (Nassarius glans) responsible for human morbidity and mortality in Taiwan[J].Journal of food protection,2005,68(8):1696-1701.
[5] SUI L M,CHEN K,WANG J Y,et al.Tetrodotoxin-associated snail poisoning in Zhoushan:A 25year retrospective analysis[J].Journal of food protection,2003,66(1):110-114.
[6] 于仁成,周名江,李爱峰,等.中国沿海两例食用织纹螺中毒事件中织纹螺体内毒素分析[J].中国水产科学,2007,14(5):801-806.
[7] 王晓杰,于仁成,罗璇,等.半褶织纹螺(Nassarius semiplicatus)及其生活环境中分离培养的细菌毒性测试与种类分析[J].微生物学报,2008,48(7):911-916.
[8] MATSUMURA K.Production of tetrodotoxin in puffer fish embryos[J].Environmental toxicology and pharmacology,1998,6(4):217-219.
[9] CARDALL B L,BRODIE E D,JR,BRODIE E D III,et al.Secretion and regeneration of tetrodotoxin in the roughskin newt(Taricha granulosa)[J].Toxicon,2004,44:933-938.
[10] KOYAMA K,NOGUCHI T,UZU A,et al.Individual,local,and sizedependent variations in toxicity of the xanthid crab Zosimus aeneus[J].Nippon Suisan Gakkaishi,1983,49(8):1273-1279.
[11] YAMAMORI K,YAMAGUCHI S,MAEHARA E,et al.Tolerance of shore crabs to tetrodotoxin and saxitoxin and antagonistic effect of their body fluid against the toxins[J].Nippon Suisan Gakkaishi,1992,58(6):1157-1162.
[12] SATO S,OGATA,KODAMA M.Accumulation of tetrodotoxin by marine snail Neptunea arthritica through tetrodotoxincontaining diet[J].Nippon Suisan Gakkaishi,1991,57(2):315-318.
[13] HONDA S,ARAKAWA O,TAKATANI T,et al.Toxification of cultured puffer fish Takifugu rubripes by feeding on tetrodotoxincontaining diet[J].Nippon Suisan Gakkaishi,2005,71(5):815-820.
[14] NOGUCHI T,NARITA H,MARUYAMA J,et al.Tetrodotoxin in the starfish Astropecten polyacanthus,in association with toxification of a trumpet shell,“Boshubora” Charonia sauliae[J].Nippon Suisan Gakkaishi,1982,48(8):1173-1177.
[15] NOGUCHI T,ARAKAWA O,TAKATANI T.Toxicity of pufferfish Takifugu rubripes cultured in netcages at sea or aquaria on land[J].Comparative biochemistry & physiology part D,2006,1:153-157.
[16] 严忠雍,张小军,李奇富,等.免疫亲和柱净化-液相色谱-串联质谱法测定海洋生物中河豚毒素[J].分析化学,2015,43(2):277-281.
[17] 罗璇,于仁成,王晓杰,等.福建沿海部分地区织纹螺毒性消长及毒素成分分析[J].水产学报,2008,32(4):636-643.
[18] 张农,苏捷,刘海新,等.节织纹螺毒力的季节变化规律[J].上海海洋大学学报,2011,20(4):553-556.
[19] 郑典元.不同海滩栖息地半褶织纹螺毒力调查[J].中国公共卫生,2006,22(10):1262.
[20] LIN S J,HWANG D F.Possible source of tetrodotoxin in the starfish Astropecten scoparius[J].Toxicon,2001,39:573-579.
[21] YU C F,YU P.Are puffer fish more toxic in their spawning seasons?[J].Marine biology,2002,10(5):1053-1057.
